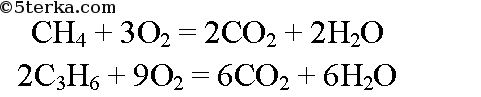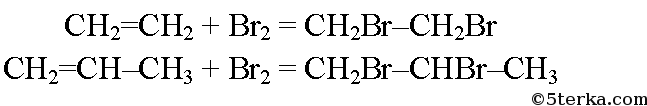Расчет теплоты сгорания и теплотворной способности этилена
Расчет теплотворной способности этилена
Задача 45.
Рассчитайте теплоту сгорания и теплотворную способность этилена С2Н4 (энтальпия образования этилена равна +52кДж/моль). Сколько тепла выделяется при горении 140г этилена. Какой объем СО2 образуется при этом?
Решение:
М(С2Н4) = 28 г/моль;
∆H°[С2Н4](г) = +52 кДж/моль;
∆H°[СО2](г) = -393,5 кДж/моль;
∆Н°[Н2О](ж) = -286 кДж/моль;
Расчет теплоты сгорания и теплотворной способности этилена
Уравнение реакции горения этилена имеет вид:
1. Расчет теплоты сгорания этилена 1 , получим:
2. Расчет теплотворной способности 2 этилена
Для расчета используем формулу:
Q = ∆Н(B)/(M(В) . 10 -3 ), где
∆Н(B) — теплота сгорания топлива, кДж/моль;
M(В) — молярная масса вещества, кг/моль.
Qв(С2Н4) = -1411/(28 . 10 -3) = 1411/0,028 = 50378,57 кДж/кг.
3. Рассчитать количества тепла выделяемого при горении 140 г этилена, получим:
Q = (140 . 1411)/28 = 7055 кДж/моль.
4. Рассчитаем объем СО2, получим:
Из уравнения реакции вытекает, что 1 моль С2Н4 соответствует 3 моль СО2, т.е. n(С2Н4) = 3n(CO2).
V(CO2) = [n(С2Н4)/M(С2Н4) . 3Vm] = (140/28) . 3 . 22,4 = 336 л.
Ответ: ∆Нх.р.= -1411 кДж/моль; Qв(С2Н4) = 50378,57 кДж/кг; Q(С2Н4) = 7055 кДж/моль; V(CO2) = 336 л.
Реакция разложения пероксида водорода
Задача 46.
Возможно ли самопроизвольное протекание при стандартных условиях реакции: 2Н2О2(ж) = 2Н2О(ж)+ О2(г)
Решение:
∆Н[Н2О2](ж) = = –187,8 кДж/моль;
∆Н[Н2О](ж) = -286 кДж/моль;
S°[Н2О](ж) = 70 Дж/(моль·К);
S°[Н2О2](ж) = 109,5 Дж/(моль·К);
S°[O2](г) = 205 Дж/(моль·К).
1. Расчет энтальпии реакции получим:
2. Расчет энтропии реакции получим:
∆Sх.р.= ∆S°(обр.прод.) — ∆S°(обр.исх.);
∆Sх.р. = [2S°Н2О(ж] + [S°О2(г) — S°Н2О2(ж)];
∆S°298 = (2·70 + 205) — (2·109,5) = 126 Дж/(моль·К) = 0,126 Дж/(моль·К).
3. Расчет энергии Гиббса реакции, получим:
∆G° = ∆H° – T∆S°
∆G°(298) = -196,4 – 298·(0,126) = –234 кДж.
Таким образом, ∆G°(9298)
Ответ: ∆G°(298) = –234 кДж; возможно.
1 Теплота сгорания вещества (Q) – это тепловой эффект реакции окисления кислородом элементов, входящих в состав этого вещества до образования высших оксидов (CO2(г), H2O(ж)).
2 Теплотворная способность топлива — это высшая удельная теплота сгорания топлива.
Реакция сгорания этилена уравнение реакции
Подожгите выделяющийся газ. Почему этилен горит более светящимся пламенем, чем метан?
- Чем отличаются свойства этилена от свойств предельных углеводородов?
- Напишите уравнения соответствующих реакций.
В этилене процентное содержание углерода больше, чем в метане, поэтому при горении этилена, в результате неполного сгорания углерода, образуются частички углерода (копоть), которые при нагревании придают пламени более светящийся характер.
Свойства этилена отличаются от свойств предельных углеводородов тем, что этилен может вступать в реакции присоединения.
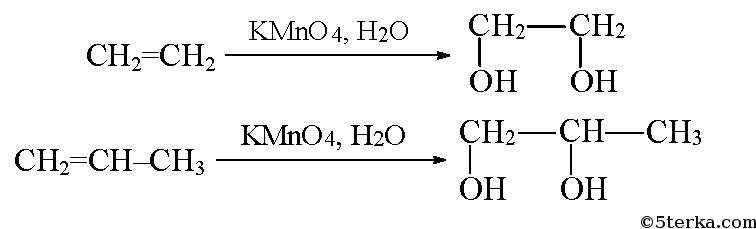
№9. Напишите уравнения реакций горения этилена и пропилена и их взаимодействия с бромной водой и раствором перманганата калия.
а) При горении этилена и пропилена образуются вода и оксид углерода (IV).
б) При реакции этилена и пропилена с бромной водой образуются соответственно 1,2-дибромэтан и 1,2-дибромпропан.
в) При взаимодействии этилена и пропилена с перманганатом калия образуются этиленгликоль (1,2-этандиол) и пропиленгликоль (1,2-пропандиол).

задача №9
к главе «Глава IV. Непредельные углеводороды (алкены, алкадиены и алкины) §1 (стр. 39) Вопросы».
http://gomolog.ru/reshebniki/10-klass/rudzitis-i-feldman-2019/prakt-2/4.html
http://5terka.com/node/4497