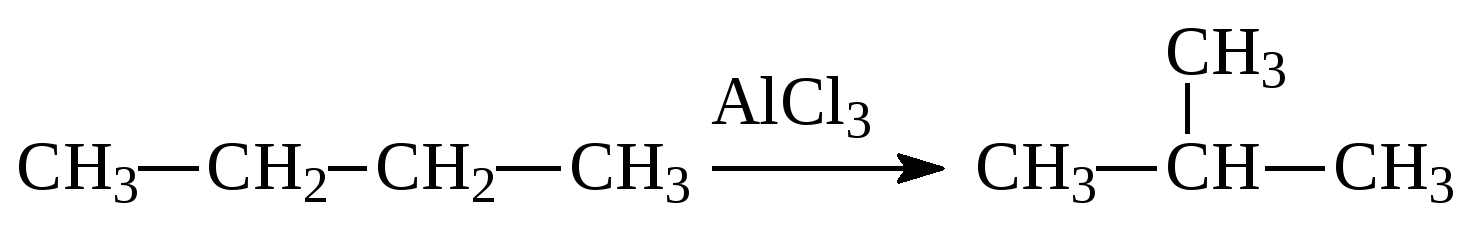Тестовая работа » Химические реакции»
Данная тестовая работа предназначена для учащихся 11 класса. С помощью этой работы можно закрепить изученный материал, обобщить о химических реакциях. В данном тесте очень объемно представлен материал, что дает возможность проверить качество усвоенного материала по многим разделам темы.
Просмотр содержимого документа
«Тестовая работа » Химические реакции»»
Тема «Химические реакции» (тестовая работа)
1. Взаимодействие гидроксида натрия с ортофосфорной кислотой относится к реакциям
а) замещения; б) обмена; в) присоединения; г) разложения.
2. Реакция, уравнение которой 2Na + 2H2O = 2NaOH + H2 + Q, относится к реакциям:
а) замещения, экзотермическим; в) соединения, эндотермическим;
б) разложения, экзотермическим; г) обмена, эндотермическим.
а) хлорида кальция и карбоната натрия;
б) сульфида кальция и углекислого газа;
в) гидроксида кальция и углекислого газа;
г) ортофосфата кальция и карбоната калия.
4. В соответствии с термохимическим уравнением реакции
2СО(г) = СО2(г) + С(т) = 173 кДж выделилось 1730 кДж теплоты. Объем оксида углерода (II), вступившего в реакцию, равен:
а) 112л б) 224л в) 336л г) 448л.
а) увеличении концентрации азота; в) увеличении концентрации аммиака;
б) уменьшении концентрации азота; г) уменьшении концентрации аммиака.
6. Для увеличения скорости реакции железа с соляной кислотой следует:
а) добавить ингибитор; в) повысить давление;
б) понизить температуру; г) увеличить концентрацию HCl.
а) понижении температуры; в) повышении концентрации СН3ОН;
б) понижении концентрации СО; г) повышении температуры.
а) катализатор; в) изменение температуры;
б) изменение концентрации г) изменение давления.
9. Какая из солей не подвергается гидролизу?
10. Щелочную среду имеет раствор
а) ацетата натрия; в) нитрата бария;
б) нитрата алюминия; г) сульфата железа (III).
11. Установите соответствие между названием соли и средой ее водного раствора
1. Сульфат натрия
2. Сульфид калия
4. Нитрат алюминия
12. Установите соответствие между реагирующими веществами и сокращенными ионными уравнениями реакций обмена.
Сокращенные ионные уравнения
а) Ag + + Br — = AgBr
в) Al 3+ + 3Cl — = FlCl3
e) Na + + Cl — = NaCl
13. При охлаждении реакционной смеси с 50С до 20С скорость химической реакции уменьшилась в 27 раз. Температурный коэффициент реакции равен __________________________________________________________
14. Начальная концентрация одного из реагирующих веществ составила 0,8 моль/л. Скорость данной химической реакции при данных условиях равна 0,001 моль/л . с. Через 40 секунд концентрация данного вещества составит _______________________________________________________
15. При наступлении равновесия в системе N2 + 3H2 = 2NH3 концентрации веществ имели следующие значения: азот – 0,5 моль/л, водород – 1,5 моль/л, аммиака – 1 моль/л. Определите константу равновесия данной системы. Вычислите исходные концентрации азота и водорода.
1. Реакцией замещения является
а) горение водорода в кислороде;
б) восстановление оксида меди (II) водородом;
в) взаимодействие гидроксида калия с серной кислотой;
г) термическая дегидратация гидроксида цинка.
а) обратимой, экзотермической; в) обратимой, эндотермической;
б) необратимой, экзотермической; г) необратимой, эндотермической.
3. Сокращенное ионное уравнение реакции Cu 2+ + 2OH — = Cu(OH)2 соответствует взаимодействию между
а) нитратом меди (II) и гидроксидом железа (III);
б) оксидом меди (II) и гидроксидом натрия;
в) хлоридом меди (II) и гидроксидом кальция;
г) оксидом меди (II) и водой.
а) 90 г б) 180 г в) 270 г г) 360 г.
а) увеличить концентрацию СО; в) понизить давление;
б) уменьшить концентрацию О2; г) понизить температуру.
6. На скорость химической реакции между раствором серной кислоты и железом не оказывает влияния
а) концентрация кислоты; в) температура реакции;
б) измельчение железа; г) увеличение давления.
а) при повышении температуры; в) в присутствии катализатора;
б) при повышении давления; г) при понижении температуры.
а) повышения температуры; в) повышение концентрации NO;
б) повышение давления; г) уменьшение концентрации N2.
9. Кислую среду имеет водный раствор
11. Установите соответствие между названием соли и средой ее водного раствора
Реакция уравнение которой 2h2o 2h2
1. Аллотропными видоизменениями являются
б) графит и алмаз
в) карбин и карбид кремния
2. Характеристика реакции уравнение которой Ba +2H2O=Ba(OH)2 +H2 +Q
а) обмена ОВР экзотермич
б) замещения ОВР экзотермич
в) замещения ОВР эндотермич
г) обмена не ОВР эндотермич
3. Сокращенное ионное уравнение 2H(+)+SiO(2-/3)=H2SiO3 соответст. взаимодействию веществ
а)кремниевой кислоты и гидроксида натрия
б)оксида кремния(4) и гидроксида калия
в)оксида кремния(4) и воды
г)силиката натрия и серной кислоты
4. Характеристика реакции уравнение которой СH3—CH2—CH3—Ni,p,t—>CH3—CH==CH2+H2
а)дегидрирования, гомогенная, каталитическая
б)гидратации, гомогенная, каталитическая
в)гидрирования, гетерогенная, каталитическая
г)дегидратации, гомогенная, каталитическая
5.При повышении температуры на 10градусов (температурный коэф = 2) скорость хим.реакции А+2В=С возрастет
6)Условие при котором химическое равновесие обратимого процесса СO2(г)+С(т) 2CO(г)-Q смещается в сторону продуктов реакции
в)повышение концентрации оксида углерода (2)
Химические реакции
Контрольная работа по химии для 11 класса по теме «Химические реакции»
Просмотр содержимого документа
«Химические реакции»
Контрольная работа №2 «Химические реакции»
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
А2. Какая масса угля вступает в реакцию, термохимическое уравнение которой С+О2 = СО2 + 402 кДж, если при этом выделилось 1608 кДж теплоты?
1) 4,8 г 2) 48 г 3) 120 г 4) 240 г
А3. Химическая реакция, уравнение которой:
1) Дегидрирования 2) Изомеризации 3) Полимеризации 3) Присоединения
1) N 0 2) H 0 3) H +1 4) N –3
А5. При повышении температуры на 30 °С (температурный коэффициент равен 3) скорость увеличится
1) в 3 раза 2) в 9 раз 3) в 27 раз 4) в 81 раз
А6. Факторы, позволяющие сместить химическое равновесие, для реакции CaO(т)+CO2(г)↔CaCO3(т)+Q, в сторону продуктов реакции:
1) Повышение температуры и понижение давления 2) Понижение температуры и давления
3) Понижение температуры и повышение давления 4) Повышение температуры и давления
А7. Щелочную среду имеет водный раствор соли, формула которой:
А8. Наиболее сильной кислотой из перечисленных является:
А9. Осадок образуется при взаимодействии хлорида калия с:
А10. Гидролизу не подвергается:
В1. Установите соответствие между схемой ОВР и коэффициентом перед формулой восстановителя:
http://znanija.site/himiya/2303615.html
http://multiurok.ru/files/khimicheskie-reaktsii-1.html