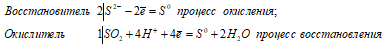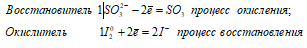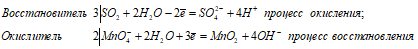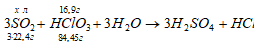Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df178c3fffb977f • Your IP : 85.95.188.35 • Performance & security by Cloudflare
2H2S + 3O2 = 2H2O + 2SO2 , ΔH= — 561,1кДж
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,293
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,176
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Характеристика окислительно-восстановительных свойств диоксида серы и сернистой кислоты
Задача 859.
Дать характеристику окислительно-восстановительных свойств диоксида серы и сернистой кислоты. Ответ подтвердить примерами.
Решение:
Сера в SO2 и H2SO3 находится в своей промежуточной степени окисления +4, поэтому SO2 и H2SO3 могут проявлять как восстановительные, так и окислительные
свойства.
а) Сера как восстановитель
Здесь степень окисления серы повышается от +4 до +6.
б) Сера как окислитель
Здесь степень окисления серы понижается от +4 до 0.
Задача 860.
Закончить уравнения реакций:
а) H2S + SO2 ↔ ;
б) H2SO3 + I2 ↔ ;
в) KMnO4 + SO2 + H2O ↔ ;
г) HIO3 + H2SO3 ↔ .
Указать, какие свойства проявляют в каждой из этих реакций диоксид серы или сернистая кислота.
Решение:
а) H2S + SO2 ↔ 3S↓ + 2H2O
Уравнения ионно-молекулярного баланса:
2S 2- + SO2 + 4H + = 3S 0 + 2H2O
Таким образом, диоксид серы проявляет свойства окислителя, а сероводород — восстановителя.
Таким образом, сернистая кислота проявляет свойства восстановителя.
3SO2 + 2MnO4 — + 10H2O = 3SO4 2- + 2MnO2 + 12H + + 8OH —
Таким образом, диоксид серы проявляет свойства восстановителя.
Восстановитель 3|6|SO3 2- + H2O — 2e = SO4 2- + 2H + процесс окисления
Окислитель 1|2|IO3 — + 6H + + 6e = I — + 3H2O процесс восстановления
3SO3 2- + IO3 — + 3H2O + 6H + ↔ 3SO4 2- + I — + 6H + + 3H2O
Таким образом, сернистая кислота проявляет свойства восстановителя.
Задача 861.
Какие из перечисленных осушителей можно использовать для удаления влаги из SO2: Н2SO4(конц.), КОН(к.), Р2O5(к.), К2CO3(к.)?
Решение:
а) Н2SO4(конц.) бурно реагирует с водой с образованием гидратов, в основном моногидратов:
б) SO2 как кислотный оксид реагирует с кристаллическим КОН с образованием кислой соли:
в) SO2 как кислотный оксид реагирует с кристаллическим К2СО3 с образованием соли сернистой кислоты и диоксида углерода:
г) Р2О5 бурно реагирует с водой с образованием фосфорной кислоты:
Таким образом, Н2SO4(конц.) и Р2О5 можно применить для осушения SO2.
Задача 862.
Сколько литров SO2, взятого при нормальных условиях, надо пропустить через раствор НСIО3, чтобы восстановить 16,9 г ее до НСI?
Решение:
Уравнение реакции имеет вид:
Рассчитаем объем SO2, необходимый для восстановления HCO3 из пропорции:
84,45 : (3 . 22,4) = 16,9 : x; x = [16,9 . (3 . 22,4)]/84,45 = 13,45 л.
Ответ: V(SO2) = 13,45 л.
http://www.soloby.ru/1095210/%D0%BD%D0%B0%D0%BF%D0%B8%D1%81%D0%B0%D1%82%D1%8C-%D0%BA%D0%BE%D0%BD%D1%81%D1%82%D0%B0%D0%BD%D1%82%D1%83-%D1%80%D0%B0%D0%B2%D0%BD%D0%BE%D0%B2%D0%B5%D1%81%D0%B8%D1%8F-%D1%81%D0%BC%D0%B5%D1%81%D1%82%D0%B8%D1%82%D1%81%D1%8F-%D1%80%D0%B0%D0%B2%D0%BD%D0%BE%D0%B2%D0%B5%D1%81%D0%B8%D0%B5-%D0%BE%D0%B1%D1%80%D0%B0%D1%82%D0%BD%D0%BE%D0%B9
http://buzani.ru/zadachi/khimiya-glinka/1281-dioksid-sery-i-sernistaya-kislota-zadachi-859-862