Бензойная кислота
| Бензойная кислота | |
|---|---|
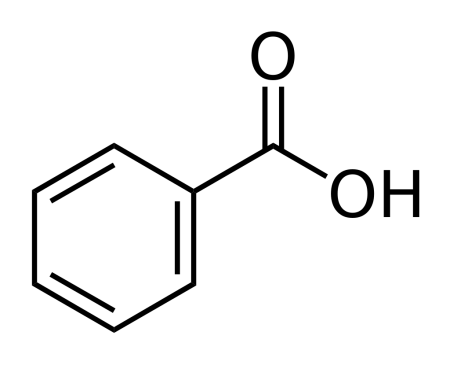 | |
| Систематическое наименование | бензойная кислота |
| Традиционные названия | бензойная кислота |
| Хим. формула | C6H5COOH |
| Рац. формула | C7H6O2 |
| Состояние | твёрдая, кисловато-горький вкус |
| Молярная масса | 122.12 г/моль |
| Плотность | 1.32 г/см³ |
| Т. плав. | 122.4 °C |
| Т. кип. | 249.2 °C |
| Т. разл. | 370 °C |
| Т. всп. | 121 °C |
| Т. свспл. | 570 °C |
| Удельная теплота испарения | 527 Дж/кг |
| Удельная теплота плавления | 18 Дж/кг |
| pKa | 4.20 |
| Растворимость в воде | 0,29 г/100 мл |
| Показатель преломления | 1,504 |
| Дипольный момент | 1.72 Д |
| ГОСТ | ГОСТ 10521-78 ГОСТ 6413-77 |
| Рег. номер CAS | 65-85-0 |
| PubChem | 243 |
| Рег. номер EINECS | 200-618-2 |
| SMILES | |
| Кодекс Алиментариус | E210 |
| RTECS | DG0875000 |
| ChEBI | 30746 |
| ChemSpider | 238 |
| Токсичность | LD50 500 mg·kg−1 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
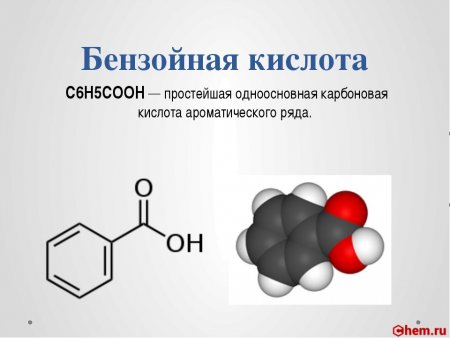
Бензойная кислота C6H5COOH — простейшая одноосновная карбоновая кислота ароматического ряда.
Содержание
- 1 История
- 2 Физические свойства
- 3 Получение
- 4 Лабораторный синтез и очистка
- 4.1 Гидролиз
- 4.2 Реакция Канниццаро
- 4.3 Реакция Гриньяра
- 4.4 Окисление
- 5 История получения
- 6 Применение
- 6.1 Калориметрия
- 6.2 Сырьё
- 6.3 Консервант
- 6.4 Медицина
- 6.5 Другие применения
- 7 Биологическое действие и влияние на здоровье человека
- 7.1 Бензольное кольцо
- 7.2 Карбоксильная группа
- 8 Производные
- 8.1 Соли
История
Впервые выделена возгонкой в 16 веке из бензойной смолы (росного ладана), отсюда и получила своё название. Этот процесс был описан у Нострадамуса (1556), а затем у Жироламо Рушелли (1560, под псевдонимом Alexius Pedemontanus) и у Блеза де Виженера (1596).
В 1832 году немецкий химик Юстус фон Либих определил структуру бензойной кислоты. Он также исследовал, как она связана с гиппуровой кислотой.
В 1875 немецкий физиолог Эрнст Леопольд Зальковский исследовал противогрибковые свойства бензойной кислоты, которая долгое время использовалась в консервировании фруктов.
Физические свойства
Бензойная кислота — белые кристаллы, плохо растворимые в воде, хорошо — в этаноле, хлороформе и диэтиловом эфире. Бензойная кислота является, подобно большинству других органических кислот, слабой кислотой (pKa 4,21).
Чистая кислота имеет температуру плавления 122,4 °C, температуру кипения 249 °C.
Легко возгоняется; перегоняется с водяным паром, поэтому неэффективно повышать концентрацию водных растворов бензойной кислоты упариванием раствора.
Получение
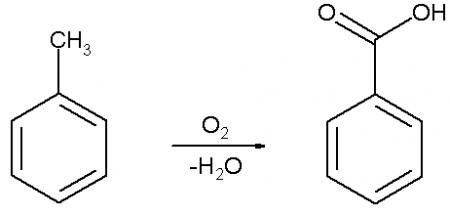
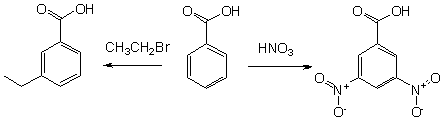
Бензойную кислоту можно получить окислением толуола сильными окислителями, такими, например, как перманганат калия, оксид хрома (VI), азотная или хромовая кислота, а также декарбоксилированием фталевой кислоты.
В промышленных масштабах бензойную кислоту получают окислением толуола кислородом на катализаторе (нафтената марганца или кобальта).
Лабораторный синтез и очистка
Химический продукт — бензойная кислота — дешёв и легкодоступен. Поэтому к лабораторному синтезу профессиональные химики прибегают редко.
Демонстрационный синтез осуществляется в учебных целях.
Очистку бензойной кислоты удобно проводить перекристаллизацией из растворителя, обычно, из воды. Другие растворители пригодные для перекристаллизации: уксусная кислота (ледяная и водный раствор), бензол, ацетон, петролейный эфир и смесь этанола с водой.
Гидролиз
Бензамид и бензонитрил гидролизуются в воде в присутствии кислоты или основания до бензойной кислоты.
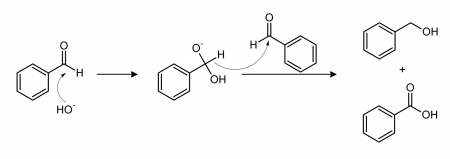
Реакция Канниццаро
Бензальдегид в основной среде претерпевает преобразование по реакции Канниццаро. В итоге получается бензойная кислота и бензиловый спирт.
Реакция Гриньяра
Из бромбензола по реакции карбоксилирования фенилмагнийбромида.
Окисление
Толуол или бензиловый спирт могут быть окислены подкисленным раствором перманганата калия до бензойной кислоты:
История получения
Первый производственный процесс включал в себя гидролиз бензолтрихлорида под действием гидроксида кальция в воде в присутствии железа или его солей в качестве катализатора. Образующийся бензоат кальция переводили в бензойную кислоту обработкой соляной кислотой. Продукт содержал значительное количество хлорпроизводных бензойной кислоты, поэтому не использовался в качестве пищевой добавки. В настоящее время в пищу используется бензойная кислота, получаемая синтетически.
Применение
Калориметрия
Бензойная кислота используется как вещество в качестве теплового стандарта для калибровки калориметров по температуре и теплоёмкости, так как теплота кристаллизации и плавления хорошо известны и воспроизводимы.
Сырьё
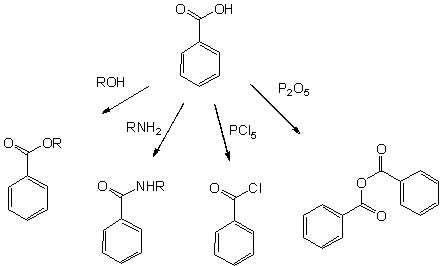
Бензойная кислота служит для получения многих реактивов, наиболее значимые из них:
- Бензоилхлорид, C6H5C(O)Cl, получается обработкой бензойной кислоты тионилхлоридом, фосгеном или хлоридами фосфора PCl3 и PCl5. C6H5C(O)Cl — важное исходное вещество для некоторых производных бензойной кислоты, таких как бензилбензоат, используемый как искусственный ароматизатор и репеллент.
- Бензоатные пластификаторы, такие как гликоль-, диэтиленгликоль- и триэтиленгликолевые эфиры, получаемые переэтерефикацией метилбензоата с соответствующим диолом. Альтернативно эти вещества получаются действием бензоилхлорида на соответствующий диол. Эти пластификаторы используются с соответствующими эфирами терефталевой кислоты.
- Фенол, C6H5OH, получаемый окислительным декарбоксилированием при 300—400 °C. Необходимая температура, может быть понижена до 200 °C добавлением каталитических количеств солей меди (II). Далее фенол может быть конвертирован в циклогексанол, который служит исходным веществом в синтезе нейлона.
Консервант
Бензойную кислоту и её соли используют при консервировании пищевых продуктов (пищевые добавки E210, E211, E212, E213).
Бензойная кислота, блокируя ферменты, замедляет обмен веществ во многих одноклеточных микроорганизмах и грибках. Она подавляет рост плесени, дрожжей и некоторых бактерий.
В пищевые продукты её добавляют в чистом виде или в виде натриевой, калиевой или кальциевой соли.
Губительное действие на микрофлору начинается с абсорбции бензойной кислоты липидной стенкой клетки.
Поскольку через стенку клетки может проникнуть только недиссоциированная кислота, бензойная кислота проявляет антимикробное действие только в кислых пищевых продуктах.
Если внутриклеточный pH 5 или меньше, анаэробная ферментация глюкозы через фосфорфруктокиназу уменьшается на 95 %. Эффективность бензойной кислоты и бензоатов зависит от кислотности (pH) пищи.
Кислая пища, напитки, такие, как фруктовые соки, (содержащие лимонную кислоту), газированные напитки, содержащие в растворе (углекислый газ), безалкогольные напитки с (фосфорной кислотой), соленья (молочная кислота) и другие кислые пищевые продукты консервируются бензойной кислотой и её солями.
Принятые и оптимальные концентрации бензойной кислоты при консервации пищи 0,05—0,1 %.
Медицина
Бензойную кислоту применяют в медицине при кожных заболеваниях, как наружное антисептическое (противомикробное) и фунгицидное (противогрибковое) средства, при трихофитиях и микозах, а её натриевую соль, — бензоат натрия — как отхаркивающее средство.
Другие применения
Эфиры бензойной кислоты (со спиртами от метилового до амилового) обладают сильным и приятным запахом и применяются в парфюмерной промышленности.
Некоторые другие производные бензойной кислоты, такие как, например, хлор- и нитробензойные кислоты, широко применяются для синтеза красителей.
Биологическое действие и влияние на здоровье человека
Бензойная кислота в свободном виде и виде сложных эфиров встречается в составе многих растений и животных. Значительное количество бензойной кислоты находится в ягодах (около 0,05 %). Зрелые плоды некоторых видов вакциниума содержат большое количество свободной бензойной кислоты. Например, в бруснике — до 0,20 % в спелых ягодах, и в клюкве — до 0,063 %. Бензойная кислота также образуется в яблоках после заражения грибком Nectria galligena. Среди животных, бензойная кислота обнаружена в основном во всеядных или фитофагных видах, например, во внутренних органах и мускулах тундряной куропатки (Lagopus muta), также как и в выделениях самцов овцебыка или азиатского слона.
Бензойная смола содержит до 20 % бензойной кислоты и 40 % бензойных эфиров.
Бензойная кислота присутствует, как часть гиппуровой кислоты (N-бензоилглицин) в моче млекопитающих, особенно травоядных животных. Бензойная кислота хорошо всасывается, через коэнзим А связывается с аминокислотой глицином в гиппуровую кислоту и в таком виде выводится через почки. Человек выделяет около 0,44 г/л гиппуровой кислоты в день в моче и больше, если находится в контакте с толуолом или бензойной кислотой. Для человека считается безопасным потребление 5 мг/кг массы тела в день. Кошки имеют гораздо более низкую толерантность к бензойной кислоте, чем мыши и крысы. Летальная доза для кошек — 300 мг/кг массы тела. Оральная ЛД50 для крыс 3040 мг/кг, для мышей 1940—2260 мг/кг.
Бензольное кольцо
Электрофильное ароматическое присоединение происходит по 3-му положению из-за электроноакцепторных свойств карбоксильной группы. Второе замещение происходит сложнее (правая часть) благодаря деактивации нитрогруппой. Наоборот, при введении электронодонорного заместителя (например, алкила), второе замещение происходит легче.
Карбоксильная группа
Все реакции, характерные для карбоксильной группы, возможны с бензойной кислотой:
- Эфиры бензойной кислоты — продукты кислотнокатализируемой реакции со спиртами
- Амиды бензойной кислоты легко доступны, используя для их синтеза активированные производные(такие как бензоилхлорид), или сочетающие реагенты используемые в пептидном синтезе такие как ДЦГК и ДМАП.
- Более активный бензойный ангидрид образуется при дегидратации уксусным ангидридом или оксидом фосфора
- Высокоактивные галогенангидриды легко получаются действием хлоридом фосфора(V) или тионилхлорида
- Ортоэфиры могут быть получены в сухих условиях реакцией бензонитрила в кислой среде со спиртами
- Восстановление до бензальдегида или бензилового спирта возможно при использовании LiAlH4 или борогидрида натрия
- Декарбоксилирование серебряной соли может быть проведено при нагревании, бензойная кислота может быть декарбоксилирована при нагревании с сухими щёлочами или гидроксидом кальция.
- Бензойная кислота образует соли
Производные
- 2,3-дигидроксибензойная кислота (пирокатехиновая кислота)
- 2,4-дигидроксибензойная кислота (бета-резорциловая кислота)
- 2,5-дигидроксибензойная кислота (гентизиновая кислота)
- 2,6-дигидроксибензойная кислота (гамма-резорциловая кислота)
- 3,4-дигидроксибензойная кислота (протокатехиновая кислота)
- 3,5-дигидроксибензойная кислота (альфа-резорциловая кислота)
- 3-нитробензойная кислота
- 3,5-динитробензойная кислота
- Толуиловые кислоты
Соли бензойной кислоты называются бензоатами, например:
- Бензоат аммония
- Бензоат лития
- Бензоат натрия
- Бензоат магния
- Бензоат марганца
- Бензоат меди(II)
- Бензоат ртути(II)
- Бензоат свинца(II)
- Бензоат серебра
Бензойная кислота
Бензойная кислота — органическое соединение, самая ароматическая одноосновная карбоновая кислота состава С 6 Н 5 СООН. При обычных условиях кислота представляет собой бесцветные кристаллы, хорошо растворимые в эфире, спиртах, хлороформе, мало растворимыми в воде. Кислота образует ряд солей — бензоат.
Срок бензойная кислота соединения происходит от названия бензойной смолы, которую выделяли из деревьев стиракс в Юго-Восточной Азии. Впервые кислота была выделена в чистом виде и описана французским алхимиком Блезом где Виженер в 16 веке — путем дистилляции бензоина. В 1832 году Фридрих Велер и Либих синтезировали бензойную кислоту с бензальдегида и установили ее формулу.
Бензойная кислота и ее производные широко распространены в природе. Так, смола бензоин содержит 12-18% бензойной кислоты, а также значительное количество ее эфиров. Также эти соединения содержатся в коре, листьях, плодах вишни и чернослива.
Физические свойства
Бензойная кислота являются прозрачными, игловидными кристаллами. Имеет температуру кипения 249,2 ° C, но кристаллы могут сублимироваться уже при 100 ° C.
Кислота слабо растворяется в воде, и хорошо — в органических растворителях.
| Ацетон | 55,60 |
| Бензол | 12,17 |
| Тетрахлорметан | 4,14 |
| Этанол | 58,40 |
| Гексан | 0,94 (при 17 ° C) |
| Метанол | 71,50 (при 23 ° C) |
| Толуол | 10,60 |
Получение
Промышленный метод
Почти вся получаемая в промышленных масштабах бензойная кислота синтезируется путем каталитического окисления толуола:
Ее разработали на немецком предприятии IG Farbenindustrie в годы Второй мировой войны. Реакцию проводят при следующих условиях:
- давление в реакторе — 200-700 кПа (
2-7 атм)
К исходному сырью предъявляются требования высокой чистоты — примеси серы, азота, фенолов и олефинов могут замедлять ход окисления. Катализатором зачастую являются соли кобальта: нафтенат, ацетат, октоат. В качестве сокатализатор также применяются добавки марганца, однако в таком случае равновесие реакции будет нарушена и станет значительным образования побочного продукта — бензальдегида. Использование бромидов (например, бромид кобальта) позволяет существенно увеличить эффективность окислительных процессов в системе, но такие добавки вызывают высокую коррозионную действие и требуют установки дорогостоящего оборудования из титана.
Степень превращения толуола составляет 50%, из которых 80% являются бензойной кислотой.
Ежегодный объем производства бензойной кислоты составляет 750 тыс. Тонн.
Лабораторные методы
При обработке бензальдегида водно-спиртовым раствором щелочи (например, 50% KOH), он диспропорционирует с образованием бензойной кислоты и бензилового спирта:
Бензойную кислоту можно получить карбоксилирования магний- или литийорганичних соединений, например, фенилвмисного реактива Гриньяра C 6 H 5 MgBr (в эфире):

Кислота образуется при гидролизе бензоилхлорида:
Другим методом является синтез кислоты с бензола — путем ацилирования его фосгеном в присутствии хлорида алюминия (реакция Фриделя — Крафтса):
Химические свойства
Бензойная кислота проявляет все свойства карбоновых кислот: образование эфиров при взаимодействии со спиртами, образования амидов и тому подобное.
Бензойная кислота устойчива к действию многих окислителей: воздух, перманганат, гипохлоритов. Однако, при нагревании свыше 220 ° C она взаимодействует с солями меди (II), образуя фенол и его производные. В результате взаимодействия кислоты с аммиаком образуется анилин.
Нагрев бензойную кислоту до 370 ° C в присутствии катализатора (медный или кадмиевый порошки), происходит декарбоксилирование, что ведет к бензола на незначительных количеств фенола.
При участии катализатора оксида циркония бензойную кислота может гидруватися к бензальдегида с количественным выходом. А гидрирования в присутствии благородных металлов ведет к образованию циклогексанкарбоновои кислоты (гексагидробензойнои).
Хлорирование соединения дает продуктом преимущественно 3-хлоробензойну кислоту. Нитрования и сульфирования происходит аналогично по третьему положением.
Токсичность
Бензойная кислота является веществом средней токсичности. Ежедневные дозы кислоты до 5-10 мг / кг не имеют влияния на здоровье.
Вещество может подразюваты слизистые оболочки человека, поэтому при работе с кислотой необходимо пользоваться для защиты органов дыхания.
Применение
Основная часть получаемой бензойной кислоты применяется в производстве капролактама и вискозы; некоторые предприятия, синтезирующих данные речовны имеют собственные мощности для получения бензойной кислоты. Также значительным является использование кислоты в производстве ее солей — бензоат: бензоата калия, натрия, кальция и тому подобное. Данные соединения нашли широкое применение в качестве пищевых и косметических консервантов, ингибиторов коррозии.
С 1909 бензойную кислоту разрешено использовать в продуктах питания, где она выполняет функции консерванта в концентрации не более 0,1%. В реестре пищевых добавок Европейского Союза бензойная кислота имеет код E210.
Бензойная кислота является сырьем для производства красителей, например, анилинового синего и некоторых антрахиноновых красителей.
Также незначительным является применение бензойной кислоты в медицине: кислота используется в изготовлении противомикробным и фунгицидным препаратов.
Бензойная кислота: история открытия, свойства, получение, применение реактива
Самым обширным классом химических соединений считаются органические вещества. Их многообразие связано с уникальной способностью углерода создавать атомные цепочки, обладающие высокой стабильностью. Одним из представителей органических соединений, имеющих в составе бензольное кольцо, является бензойная кислота. Интересная история открытия, широкий спектр применения, способы получения, польза и вред вещества для человека будут описаны в данной статье.
Описание, физические свойства соединения
При комнатной температуре бензойная кислота выглядит как белый порошок. Если рассмотреть его под микроскопом, вы увидите, что кристаллы имеют форму игл или чешуек (табличек). Соединение обладает резким специфическим запахом. Химическая формула этой карбоновой (органической) кислоты – C6H5COOH или C7H6O2. При нагревании до 122,4 ⁰C она начинает плавиться, а при 249 ⁰C — кипеть, дальнейшее повышение температуры до 370 ⁰C приведёт к термическому разложению. Нетрудно подсчитать молярную массу соединения, она составляет 122,12 грамм/моль. Реагент очень плохо растворяется в воде, а в этаноле и эфирах — хорошо. Реактив C6H5COOH является слабой кислотой, константа её диссоциации составляет 4,202.
Возгонка
Реактив легко поддаётся возгонке. При этом кристаллы сублимируются из паров, минуя жидкую фазу. Такой переход легко проследить при помощи опыта «зима в стакане» или «искусственный снег». Для этого в термостойкую химическую посуду помещают небольшое количество реагента и еловую веточку. Сверху располагают круглодонную колбу с водой, она послужит холодильником и крышкой. Конструкцию устанавливают на штатив и подвергают нагреванию. При этом реактив начинает возгоняться. Пары, достигая колбы с холодной водой, кристаллизуются и превращаются в «снег». Они оседают на еловой ветке и стенках стакана в виде тоненьких иголочек. Потрясающее зрелище! У него есть и практическое применение – сублимацию используют для получения и бензойной кислоты.
История открытия
Своё название бензойная кислота получила благодаря природному соединению, из которого впервые была выделена, – росному ладану. Этот процесс описан Нострадамусом в 1556 году, а чуть позже французским алхимиком Блезом де Виженером. Бензойная смола долгое время считалась единственным источником синтеза карбоновой кислоты, за что её и прозвали росноладанной. Большой вклад в исследование структуры и состава соединения внесли Ю. Либих и А. Кольбе. В 1875 году были изучены антисептические и антимикотические свойства бензойной кислоты. Открытие принадлежит немецкому физиологу Э. Л. Зальковскому. Это позволило применять реактив в медицине.
Характерные химические реакции
Бензойная кислота, химические свойства которой напрямую зависят от присутствия ароматического кольца, вступает в реакции электрофильного замещения. Причём более подвержен им третий атом углерода, расположенный в равном удалении от карбоксильной группы. Гораздо медленнее протекает замещение в —COOH. Для C6H5COOH характерны те же взаимодействия, что и для карбоновых кислот. При реакции этерификации (со спиртами) образуются эфиры, имеющие приятный аромат. Как и все органические соединения, бензойная кислота сгорает с выделением CO2 и воды. Взаимодействия с основаниями и металлами протекают по карбоксильной группе с образованием солей – бензоатов. Дегидрирование приводит к получению циклоалканов. Характерной химической реакцией (качественной) на C6H5COOH является выделение бензоата железа (III). Он выпадает в виде желтовато-розового осадка вследствие взаимодействия бензойной кислоты с FeCl3.
Получение и очистка
Как уже было описано выше, впервые бензойную кислоту выделили из росного ладана. Это природное соединение представляет собой смолу стираксового дерева. Для этого измельчённое сырье прогревали на песчаной бане и собирали сублимирующиеся кристаллы в небольшом ящичке, оклеенном бумагой. Полученный продукт имел приятный аромат из-за присутствия эфирных масел в росном ладане – коричного и ванильного.
Также использовался метод взаимодействия гиппуровой кислоты с соляной при сильном нагревании. Первую получали путём упаривания мочи травоядных, затем очищали кристаллизацией до исчезновения характерного запаха. А как же протекает современный синтез такого вещества как бензойная кислота? Получение её очень дешёво, просто и экологично. Его проводят при помощи промышленного оксидирования метилбензола KMnO4, либо частичным взаимодействием исходного реагента с O2. Очистка сырья основана на физических свойствах реактива — низкой растворимости бензойной кислоты в холодной воде и высокой — в горячей, и называется перекристаллизацией.
Незаменимый консервант
Рассматривая этикетки пищевых продуктов, вы часто сталкиваетесь с компонентами, закодированными буквой Е. Под этой маркировкой кроются различные красители, ароматизаторы, эмульгаторы, консерванты и усилители вкуса. Бензойную кислоту можно встретить под кодом Е210. Эта пищевая добавка является натуральным консервантом, который вырабатывается в кисломолочных продуктах естественным путём. В природе соединение можно встретить в различных частях растений, смолах, бобровой струе. Используют Е210 при изготовлении пищевых продуктов – соусов, супов, желе, консерваций, напитков. Поскольку компонент мало растворим в воде, чаще берут соли бензойной кислоты, например, бензоат натрия с кодом Е211.
Влияние соединения на организм человека
Консервант Е210, попадая в организм человека, реагирует с белками, образуя гиппуровую кислоту, которая выводится почками. Этот компонент одобрен ассоциацией ВОЗ, но только в концентрации не более 5 мг/кг суточного потребления. В больших дозах бензойная кислота может вызвать поражение печени и почек. Кроме того, стоит остерегаться продуктов, в которых консервант присутствует вкупе с витамином C. Взаимодействие этих компонентов приводит к образованию свободного бензола, являющегося сильнейшим канцерогеном.
Применение
Бензойная кислота нашла применение не только в пищевой промышленности. Её используют в медицине в качестве обеззараживающего и противогрибкового средства, добавляют в отхаркивающие препараты и мази от кожных заболеваний. Реагент является сырьём для химического синтеза фенола, пластификаторов и красителей. Большое значение для парфюмерии имеют эфиры бензойной кислоты. Они применяются как фиксаторы ароматов. Чтобы не получить отравление, следует использовать средства защиты кожи и лёгких, ведь попадание реактива в организм ведёт к ожогам, раздражениям слизистых, тошноте.
http://info-farm.ru/alphabet_index/b/benzojjnaya-kislota.html
http://www.syl.ru/article/312783/benzoynaya-kislota-istoriya-otkryitiya-svoystva-poluchenie-primenenie-reaktiva