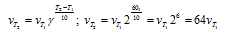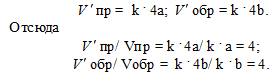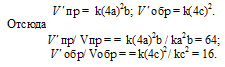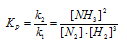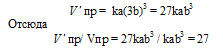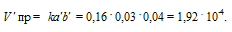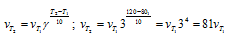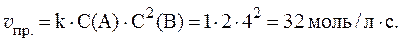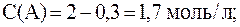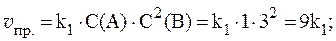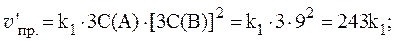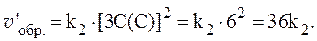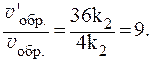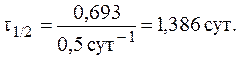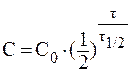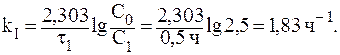Вычисление концентрации веществ и скорости реакции
Скорость реакции
Задание 127.
Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60 °С, если температурный коэффициент скорости данной реакции 2?
Решение:
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
Следовательно, скорость реакции 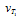
Задание 121.
Окисление серы и ее диоксида протекает по уравнениям:
а) S (к) + O2 = SO2 (г); б) 2SO2 (г) + O2 = 2SO3 (г).
Как изменится скорость этих реакций, если объемы каждой из систем уменьшить в четыре раза?
Решение:
а) S (к) + O2 = SO2 (г)
Обозначим концентрации газообразных реагирующих веществ: [O2] = a, [SO2] = b. Согласно закону действующих масс, скорости прямой и обратной реакций до изменения объёма соответственно равны:
Vпр = k . a; Vобр = k . b.
После уменьшения объёма гетерогенной системы в четыре раза концентрация газообразных веществ увеличится в четыре раза: [O2] = 4a, [SO2] = 4b. При новых концентрациях скорости прямой и обратной реакций будут равны
Следовательно, после уменьшения объёма в системе скорости прямой и обратной реакций увеличились в четыре раза. Равновесие системы не сместилось.
Обозначим концентрации реагирующих веществ: [O2] = a, [SO2] = b, [SO3] = с. Согласно закону действующих масс, скорости прямой и обратной реакций до изменения объёма соответственно равны:
Vпр = ka 2 b; Vо б р = kc 2 .
После уменьшения объёма гомогенной системы в четыре раза концентрация реагирующих веществ увеличится в четыре раза: [O2] = 4a, [SO2] = 4b, [SO3] = 4с При новых концентрациях скорости прямой и обратной реакций будут равны:
Следовательно, после уменьшения объёма в системе скорость прямой реакции возросла в 64 раза, а обратной – в 16. Равновесие системы при этом сместилось вправо, в строну уменьшения образования газообразных веществ.
Константы равновесия гомогенной системы
Задание 122.
Напишите выражение для константы равновесия гомогенной системы:
N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если увеличить концентрацию водорода в три раза?
Решение:
Уравнение реакции:
Выражение константы равновесия данной реакции имеет вид:
Обозначим концентрации газообразных реагирующих веществ: [N2] = a, [H2] = b. Согласно закону действующих масс, скорость прямой реакций до увеличения концентрации водорода равна: Vпр = kab 3 . После увеличения концентрации водорода в три раза концентрации исходных веществ будут равны: [N2] = a, [H2] = 3b. При новых концентрациях скорости прямой реакций будет равна:
Следовательно, после увеличения концентрации водорода в три раза скорость реакции возросла в 27 раз. Равновесие, согласно принципу Ле Шателье, сместилось в сторону уменьшения концентрации водорода, т. е. вправо.
Задание 123.
Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были [N2] = 0,049 моль/л, [O2] = 0,01 моль/л. Вычислите концентрацию этих веществ, когда [NO] = 0,005 моль/л. Ответ: [N2] 0,0465 моль/л; [O2] = 0,0075 моль/л.
Решение:
Уравнение реакции имеет вид:
Из уравнения реакции следует, что на образование 2 моль NO расходуется по 1 моль N2 и О2, т. е. на образование NO требуется в два раза меньше N2 и О2. Исходя из сказанного, можно предположить, что на образование 0,005 моль NO затрачивается по 0,0025 моль N2 и О2. Тогда конечные концентрации исходных веществ будут равны:
[N2]конечн. = [N2]исх. – 0,0025 = 0,049 – 0,0025 = 0,0465 моль/л;
[O2]конечн. = [O2]исх. — 0,0025 = 0,01 – 0,0025 = 0,0075 моль/л.
Ответ: [N2]конечн. = 0,0465 моль/л; [O2]конечн. = 0,0075 моль/л.
Задание 124.
Реакция идет по уравнению N2 + ЗН2 = 2NH3. Концентрации участвующих в ней веществ (моль/л): [N2] = 0,80; [H2] = 1,5; [NH3] = 0,10. Вычислите концентрацию водорода и аммиака [N2] = 0,5 моль/л. Ответ: [NH3] = 0,70 моль/л; [Н2) = =0,60 моль/л.
Решение:
Уравнение реакции имеет вид:
Из уравнения следует, что из 1 моль N2 Образуется 2 моль NH3 и расходуется 3 моль Н2. Таким образом, при участии в реакции определённого количества азота образуется в два раза большее количество аммиака и прореагирует в три раза больше водорода. Рассчитаем количество азота, которое прореагировало: 0,80 – 0,50 = 0,30 моль. Рассчитаем количество аммиака, которое образовалось: 0,3 . 2 = 0,6 моль. Рассчитаем количество прореагировавшего водорода: 0,3 . 3 = 0,9 моль. Теперь рассчитаем конечные концентрации реагирующих веществ:
[NH3]конечн. = 0,10 + 0,60 = 0,70 моль;
[Н2]конечн. = 1,5 — 0,90 = 0,60 моль;
[N2]конечн. = 0,80 — 0,50 = 0,30 моль.
Ответ: [NH3] = 0,70 моль/л; [Н2) = =0,60 моль/л.
Скорость, температурный коэффициент скорости реакции
Задание 125.
Реакция идет по уравнению Н2 + I2 = 2НI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ (моль/л): [Н2] = 0,04:
[I2] = 0,05. Вsчислите начальную скорость реакции и ее скорость при [H2] = 0,03 моль/л. Ответ: 3,2 . 10 -4 , 1,92 . 10 -4
Решение:
Уравнение реакции имеет вид:
При исходных концентрациях реагирующих веществ, согласно закону действующих масс, скорость реакции будет равна при обозначении концентраций исходных веществ: [Н2] = a, [I2] = b.
Vпр = kab = 0,16 . 0,04 . 0,05 = 3,2 . 10 -4 .
Рассчитаем количество водорода, которое вступило в реакцию, если концентрация его изменилась и стала 0,03 моль/л, получим: 0,04 — 0,03 = 0,01 моль. Из уравнения реакции следует, что водород и йод реагируют друг с другом в отношении 1 : 1, значит в реакцию вступило тоже 0,01 моль йода. Отсюда, конечная концентрация йода равна: 0,05 -0,01 = 0,04 моль. При новых концентрациях скорость прямой реакции будет равна:
Ответ: 3,2 . 10 -4 , 1,92 . 10 -4 .
Задание 126.
Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80 °С. Температурный коэффициент скорости реакции З.
Решение:
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
Следовательно, скорость реакции 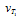
Реакция в газовой фазе протекает по уравнению
Химическим равновесием называется такое состояние обратимой химической реакции
при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия:
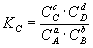
где Ci – концентрации компонентов в равновесной идеальной смеси.
Константа равновесия может быть выражена также через равновесные мольные доли Xi компонентов:
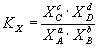
Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления Pi компонентов:
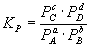
Константа равновесия связана с rG o химической реакции:
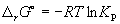
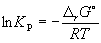
Изменение rG или rF в химической реакции при заданных (не обязательно равновесных) парциальных давлениях Pi или концентрациях Ci компонентов можно рассчитать по уравнению изотермы химической реакции (изотермы Вант-Гоффа):
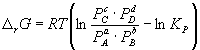
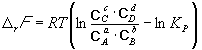
Согласно принципу Ле Шателье, если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты.
Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобары Вант-Гоффа)
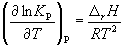
и изохоры химической реакции (изохоры Вант-Гоффа)
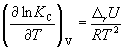
Интегрирование уравнения (9.9) в предположении, что rH реакции не зависит от температуры (что справедливо в узких интервалах температур), дает:
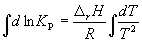
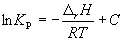
где C – константа интегрирования. Таким образом, зависимость ln KP от 1/Т должна быть линейной, а наклон прямой равен – rH /R.
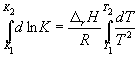
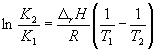
По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать rH реакции. Соответственно, зная rH реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.
ПРИМЕРЫ
Пример 9-1. Рассчитать константу равновесия для реакции
при 500 K. fG o для CO(г) и CH3OH(г) при 500 К равны –155.41 кДж . моль –1 и –134.20 кДж . моль –1 соответственно.
Решение. G o реакции:
rG o = fG o (CH3OH) – fG o (CO) = –134.20 – (–155.41) = 21.21 кДж . моль –1 .
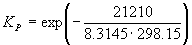
Пример 9-2. Константа равновесия реакции
равна KP = 1.64 10 –4 при 400 o C. Какое общее давление необходимо приложить к эквимолярной смеси N2 и H2, чтобы 10% N2 превратилось в NH3? Газы считать идеальными.
Решение. Пусть прореагировало моль N2. Тогда
| N2(г) | + | 3H2(г) | = | 2NH3(г) |
| Исходное количество | 1 | 1 | ||
| Равновесное количество | 1– | 1–3 | 2 (Всего: 2–2 ) | |
| Равновесная мольная доля: | 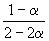 | 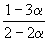 | 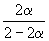 |
Следовательно, KX = 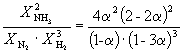
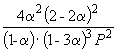
Подставляя = 0.1 в полученную формулу, имеем
1.64 10 –4 =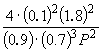
Пример 9-3. Константа равновесия реакции
при 500 K равна KP = 6.09 10 –3 . Реакционная смесь, состоящая из 1 моль CO, 2 моль H2 и 1 моль инертного газа (N2) нагрета до 500 K и общего давления 100 атм. Рассчитать состав равновесной смеси.
Решение. Пусть прореагировало моль CO. Тогда
| CO(г) | + | 2H2(г) | = | CH3OH(г) | |
| Исходное количество: | 1 | 2 | 0 | ||
| Равновесное количество: | 1– | 2–2 | |||
| Всего в равновесной смеси: | 3–2 моль компонентов + 1 моль N2 = 4–2 моль | ||||
| Равновесная мольная доля | 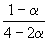 | 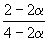 | 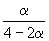 | ||
Следовательно, KX = 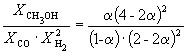
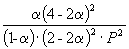
Таким образом, 6.09 10 –3 = 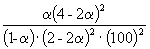
Решая это уравнение, получаем = 0.732. Соответственно, мольные доли веществ в равновесной смеси равны: 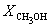
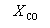
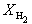
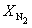
Пример 9-4. Для реакции
при 298 К KP = 6.0 10 5 , а fH o (NH3) = –46.1 кДж . моль –1 . Оценить значение константы равновесия при 500 К.
Решение. Стандартная мольная энтальпия реакции равна
rH o = 2 fH o (NH3) = –92.2 кДж . моль –1 .
Согласно уравнению (9.14), 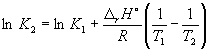
= ln (6.0 10 5 ) + 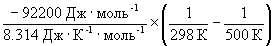
Отметим, что константа равновесия экзотермической реакции уменьшается с ростом температуры, что соответствует принципу Ле Шателье.
ЗАДАЧИ
Указание: во всех задачах считать газы идеальными.
- При 1273 К и общем давлении 30 атм в равновесной смеси
содержится 17% (по объему) CO2. Сколько процентов CO2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO2?
При 2000 o C и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитать константу равновесия реакции
Константа равновесия реакции
при 500 o C равна Kp = 5.5. Смесь, состоящая из 1 моль CO и 5 моль H2O, нагрели до этой температуры. Рассчитать мольную долю H2O в равновесной смеси.
Константа равновесия реакции
при 25 o C равна Kp = 0.143. Рассчитать давление, которое установится в сосуде объемом 1 л, в который поместили 1 г N2O4 при этой температуре.
Сосуд объемом 3 л, содержащий 1.79 10 –2 моль I2, нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
при 250 o C rG o = –2508 Дж . моль –1 . При каком общем давлении степень превращения PCl5 в PCl3 и Cl2 при 250 o C составит 30%?
константа равновесия KP = 1.83 10 –2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I2 и 0.2 г H2 в трехлитровом сосуде? Чему равны парциальные давления H2, I2 и HI?
Сосуд объемом 1 л, содержащий 0.341 моль PCl5 и 0.233 моль N2, нагрели до 250 o C. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитать константу равновесия при 250 o C для протекающей в сосуде реакции
Константа равновесия реакции
при 500 K равна KP = 6.09 10 –3 . Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H2 взяты в соотношении 1: 2.
находится в равновесии при 500 K и 10 бар. Если газы идеальные, как повлияют на выход метанола следующие факторы: а) повышение T; б) повышение P; в) добавление инертного газа при V = const; г) добавление инертного газа при P = const; д) добавление H2 при P = const?
устанавливается при 227 o C и общем давлении 1.0 бар, когда парциальное давление NOCl равно 0.64 бар (изначально присутствовал только NOCl). Рассчитать rG o для реакции. При каком общем давлении парциальное давление Cl2 будет равно 0.10 бар?
Рассчитать общее давление, которое необходимо приложить к смеси 3 частей H2 и 1 части N2, чтобы получить равновесную смесь, содержащую 10% NH3 по объему при 400 o C. Константа равновесия для реакции
при 400 o C равна K = 1.60 10 –4 .
При 250 o C и общем давлении 1 атм PCl5 диссоциирован на 80% по реакции
Чему будет равна степень диссоциации PCl5, если в систему добавить N2, чтобы парциальное давление азота было равно 0.9 атм? Общее давление поддерживается равным 1 атм.
При 2000 o C для реакции
Kp = 2.5 10 –3 . В равновесной смеси N2, O2, NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N2 и 16% O2. Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
а) увеличивается в 2 раза, б) уменьшается в 2 раза при изменении температуры от 298 К до 308 К.
При 420 o C давление газов равно 5.16 10 4 Па, а при 450 o C 10.8 10 4 Па. Рассчитать константы равновесия при этих температурах и энтальпию диссоциации на моль HgO.
получены следующие данные по зависимости константы равновесия от температуры:
3.98 10 –4
1.41 10 –2
1.86 10 –1
Определить стандартную энтальпию реакции в этом температурном интервале.
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Рассчитать rG o , rH o и rS o реакции при 400 К.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Эталоны решения задач
1. В сосуде смешали газ А количеством вещества 4,5 моль и газ В количеством вещества 3 моль. Газы А и В реагируют в соответствии с уравнением А + В = С. Через некоторое время в системе образовался газ С количеством вещества 2 моль. Какие количества непрореагировавших газов А и В остались в системе?
Из уравнения реакции следует, что:
Dn(A) = Dn(B) = Dn(C) = 2 моль,
где Dn ‑ изменение количества вещества в ходе реакции.
Следовательно, в сосуде осталось:
2. Реакция протекает по уравнению: 2A + B ⇄ C и имеет второй порядок по веществу А и первый по веществу B. В начальный момент времени скорость реакции равна 15 моль/л×с. Рассчитать константу скорости и скорость прямой реакции в тот момент, когда прореагирует 50% вещества B, если начальные концентрации равны: С(A) = 10 моль/л; С(B) = 5 моль/л. Как изменится скорость химической реакции?
Согласно закону действующих масс:

С(B), вступившего в реакцию, равна:
С(B) = 0,5·5 = 2,5 моль/л.
Соответственно С(A), вступившего в реакцию, равна:
2 моль/л A — 1 моль/л B
С(A) и С(B) после протекания реакции:
С(A) = 10 — 5 = 5 моль/л,
С(B) = 5 — 2,5 = 2,5 моль/л.
Скорость прямой реакции будет равна:
Скорость химической реакции изменится:
т. е. уменьшится в 8 раз.
3. Реакция между веществами А и В выражается уравнением: А + 2В = С и имеет первый порядок по веществу А и второй по веществу B. Начальные концентрации веществ равны: С(А) = 2 моль/л; С(В) = 4 моль/л; константа скорости равна 1,0. Найти начальную скорость реакции и скорость по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,3 моль/л.
Согласно закону действующих масс:
Если концентрация вещества А уменьшится на 0,3 моль/л, то концентрация вещества В уменьшится на 0,3×2 = 0,6 моль/л. После протекания реакции концентрации равны:
4. Скорости прямой и обратной газофазных реакций, протекающих в замкнутом сосуде, выражаются уравнениями:
Рассчитать, как изменятся скорости прямой и обратной реакций при увеличении давления в системе в 3 раза, если исходные концентрации веществ равны: С0(A) = 1 моль/л; С0(B) = 3 моль/л; С0(C) = 2 моль/л.
Согласно закону действующих масс, скорости прямой и обратной реакций при начальных условиях равны:
Увеличение давления в 3 раза для газообразных систем приводит к уменьшению объема газовой смеси в 3 раза, во столько же раз увеличатся концентрации всех трех газов, и скорости обеих реакций станут соответственно равны:
Отношения скоростей реакций составляют:
Таким образом, скорость прямой реакции увеличится в 27 раз, обратной — в 9.
5. Реакция при температуре 50 0 С протекает за 2 мин 15 с. За какое время закончится эта реакция при температуре 70 0 С, если в данном температурном интервале температурный коэффициент скорости gравен 3?
При увеличении температуры от 50 до 70 0 С скорость реакции в соответствии с правилом Вант-Гоффа возрастает:
где 
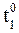


т.е. скорость реакции увеличивается в 9 раз.
В соответствии с определением, время реакции обратно пропорционально скорости протекания реакции, следовательно:
где 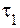

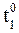

Учитывая, что 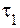

6. Во сколько раз увеличится скорость химической реакции при повышении температуры от 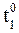

Из правила Вант-Гоффа:
Скорость реакции увеличится в 128 раз.
7. При изучении кинетики выведения лекарственного препарата из организма больного было установлено, что за 3 часа в организме пациента осталось 50% от исходного количества лекарственного средства. Определить период полувыведения и константу скорости реакции выведения препарата из организма человека, если известно, что это реакция первого порядка.
Так как за данный промежуток времени из организма было выведено 50% препарата, то t1/2 = 3 часа. Константу скорости реакции рассчитаем из уравнения:
8. При лабораторных исследованиях водных растворов лекарственного средства было установлено, что вследствие гидролиза концентрация препарата за сутки уменьшилась от 0,05 моль/л до 0,03 моль/л. Вычислить период полупревращения реакции гидролиза препарата.
Так как реакции гидролиза обычно протекают при значительном избытке воды, то ее концентрацию можно постоянной. Следовательно, в ходе реакции изменяется только концентрация препарата и реакцию гидролиза можно считать реакцией первого порядка.
Значение константы скорости реакции найдем из уравнения:
9. Период полувыведения препарата из организма больного (реакция первого порядка) равен 5 часам. Определить время, за которое из организма будет выведено 75% препарата.
При выведении из организма 75% препарата отношение С/С0 составит 0,25. В данном случае удобно воспользоваться формулой:
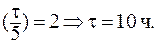
10. Константа скорости реакции гидролиза сахарозы равна 2,31×10 — 3 ч — 1 . Рассчитать:
1) период полупревращения реакции;
2) время, за которое гидролизу подвергнется 20% сахарозы;
3) какая часть глюкозы подвергнется гидролизу через 5 суток.
1. Период полупревращения равен:
2. После того, как гидролизу подвергнется 20% сахарозы, отношение С/С0 составит 0,8. Следовательно:
3. Через 5 суток (120 часов) отношение С/С0 составит:
Следовательно, гидролизу подверглось 24% глюкозы.
11. В ходе некоторой реакции первого порядка за 30 мин превращению подвергается 60% исходного количества вещества. Определить, какая часть вещества останется через 1 час.
1. Через 30 минут количество оставшегося вещества составит:
2. Найдем константу скорости реакции:
3. Количество вещества С2, оставшееся через 1 час, определим по формуле:
Таким образом, через 1 час останется 16% от исходного вещества.
Вопросы для самоконтроля
1. Что называется скоростью химической реакции?
2. Что называется истинной скоростью гомогенной реакции?
3. Какова размерность скорости гомогенной реакции?
4. Что называется скоростью гетерогенной реакции?
5. Какова размерность скорости гетерогенной реакции?
6. Перечислите факторы, влияющие на скорость реакции.
7. Сформулируйте закон действующих масс.
8. Каков физический смысл константы скорости реакции? От чего зависит и от чего не зависит константа скорости реакции?
9. Что называется порядком реакции? Приведите примеры уравнений реакций нулевого, первого, второго и третьего порядков.
10. Зависит ли размерность константы скорости реакции от порядка реакции?
11. Что называется молекулярностью реакции?
12. По какой формуле можно рассчитать период полупревращения реакции первого порядка?
13. Дайте определение простым и сложным реакциям. Приведите классификацию сложных реакций.
14. Сформулируйте правило Вант-Гоффа. Приведите математическое выражение правила Вант-Гоффа.
15. Как скорость реакции зависит от энергии активации? Напишите уравнение Аррениуса.
16. Что такое активированный комплекс? Почему протекание реакций протекает через стадии образования активированных комплексов?
17. Что называется катализатором? Гомогенный и гетерогенный катализ. Почему в присутствии катализаторов реакции протекают быстрее?
18. Что такое ферментативный катализ? Напишите уравнение Михаэлиса-Ментен.
Варианты задач для самостоятельного решения
Вариант № 1
1. Реакция между веществами А и В выражается уравнением 2А + В = С и имеет второй порядок по веществу А и первый по веществу B. Начальные концентрации веществ равны: С0(А) = 0,4 моль/л; С0(В) = 0,8 моль/л; k = 0,6. Найти начальную скорость реакции и скорость по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,2 моль/л.
2. На сколько градусов необходимо повысить температуру, чтобы скорость реакции увеличилась в 64 раза? Температурный коэффициент скорости реакции gравен 2.
3. Как изменятся скорости прямой и обратной реакций, протекающих в газовой фазе и подчиняющихся уравнениям:
а) при увеличении давления в системе в 2 раза?
б) при увеличении объемов газов в 2 раза?
Вариант №2
1. Реакция протекает по уравнению: A + B = C и имеет первый порядок по веществу А и по веществу B. Концентрацию A увеличили с 2 до 8 моль/л, а концентрацию B с 3 до 9 моль/л. Во сколько раз возросла скорость прямой реакции?
2. При 150 0 С реакция заканчивается за 10 минут. Принимая температурный коэффициент gравным 2, рассчитайте, через сколько минут закончилась бы реакция при 170 0 C.
3. Скорость реакции выражается уравнением: 
Вариант №3
1. Реакция выражается уравнением: A + B = C и имеет первый порядок по веществу А и по веществу B. При начальных концентрациях С0(A) = 3 моль/л и С0(B) = 5 моль/л скорость прямой реакции равна 0,3 моль/л×с. Определить константу скорости и скорость реакции через некоторое время, когда концентрация A уменьшится на 2 моль/л.
2. Во сколько раз увеличится скорость химической реакции при повышении температуры от 10 до 70 0 С, если температурный коэффициент скорости gравен 2?
3. Скорость реакции A(тв) + 2B(газ) = C(тв) выражается уравнением: 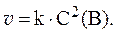
1. Реакция протекает по уравнению: 2A + B = 2C и имеет второй порядок по веществу А и первый по веществу B. Рассчитать скорость прямой реакции в тот момент, когда прореагирует 40% вещества B, если начальные концентрации равны: С0(А) = 8 моль/л; С0(B) = 4 моль/л; k = 0,4.
2. Некоторая реакция при 100 0 С заканчивается за 5 мин. За какое время она закончится при 80 0 С, если температурный коэффициент скорости g равен 3?
3. Скорость реакции 3A + B = C выражается уравнением: 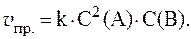
а) при увеличении концентрации вещества A в 2 раза?
б) при одновременном уменьшении концентрации исходных веществ в 2 раза?
Вариант №5
1. Скорость некоторой реакции при повышении температуры с 40 до 70 0 С увеличилась в 8 раз. Определить величину g.
2. Реакция протекает по уравнению: A + 3B = 2C и имеет первый порядок по веществу А и второй по веществу B. Начальные концентрации веществ равны: С0(A) = 2 моль/л; С0(B) = 6 моль/л; k = 1. Рассчитать начальную скорость прямой реакции и скорость в тот момент, когда концентрация вещества A уменьшилась на 1 моль/л. Как изменится скорость химической реакции?
3. Как изменятся скорости прямой и обратной реакций, протекающих в газовой фазе и подчиняющихся уравнениям:
при изотермическом увеличении давления в 2 раза?
Вариант №6
1. В закрытом сосуде находится смесь газов, состоящая из 1 моль A и 3 моль B, которая реагирует по уравнению: A + 3B = 2C. Скорость прямой реакции описывается уравнением 
2. На сколько градусов надо увеличить температуру, чтобы скорость реакции возросла в 9 раз, если температурный коэффициент скорости g равен 3?
3. Как изменится скорость прямой газофазной реакции: 2A = B, порядок которой оценивается как 0,5, при изотермическом уменьшении давления в системе в 3 раза?
Вариант №7
1. Реакция между веществами А и В протекает по уравнению: A + 2B = C и имеет первый порядок по веществу А и по веществу В. Начальные концентрации реагирующих веществ составили: С0(A) = 1,5 моль/л; С0(B) = 3 моль/л; k = 0,4. Вычислить скорость химической реакции в начальный момент времени и по истечении некоторого времени, когда прореагирует 75% А.
2. Чему равен температурный коэффициент скорости g, если при увеличении температуры на 30 0 С скорость реакции возрастает в 27 раз?
3. Как изменятся скорости прямой и обратной реакций, протекающих в газовой фазе и подчиняющихся уравнениям:
при изотермическом увеличении давления в 2 раза?
Вариант №8
1. В растворе объемом 1 л, содержащем 1 моль вещества A и 2 моль вещества B, протекает реакция: A + 3B = 2C + D. Прямая реакция имеет первый порядок по веществу А и второй по веществу B. Во сколько раз уменьшится скорость прямой реакции после того, как прореагируют 0,65 моль вещества A?
2. При повышении температуры от -5 до +5 0 С скорость бактериального гидролиза (ферментативный процесс) увеличивается в 4 раза. Найти значение температурного коэффициента скорости реакции g.
3. Во сколько раз следует увеличить концентрацию вещества A в системе 2A(газ) = B(газ) + C(тв.), чтобы скорость прямой реакции, которая является реакцией второго порядка, увеличилась в 4 раза?
Вариант №9
1. Реакция протекает по уравнению: 2A + B = 2C и имеет второй порядок по веществу А и первый по веществу B. Скорость прямой реакции равна 8 моль/л×с. Рассчитать константу скорости и скорость прямой реакции в тот момент, когда прореагирует 30% вещества B, если начальные концентрации равны: С0(A) = 2 моль/л; С0(B) = 1 моль/л. Как изменится скорость химической реакции?
2. При увеличении температуры от 10 до 50 0 С скорость реакции увеличилась в 16 раз. Определить температурный коэффициент скорости g.
3. Реакция протекает по уравнению: A + B = C + D + E и имеет первый порядок по веществу А и нулевой по веществу B. Как изменится скорость прямой реакции после разбавления реагирующей смеси в 3 раза?
Вариант №10
1. Реакция протекает по уравнению: A + 2B = AB2 и имеет первый порядок по веществу А и второй по веществу B. Константа скорости реакции равна 0,01. Рассчитать скорость реакции при начальных концентрациях: С0(A) = 0,8 моль/л; С0(B) = 0,8 моль/л и скорость реакции к моменту образования 0,2 моль/л вещества АВ2.
2. Во сколько раз увеличится скорость химической реакции при повышении температуры от 30 до 60 0 С, если температурный коэффициент скорости g равен 3?
3. Период полувыведения препарата из организма больного (реакция первого порядка) равен 6 часам. Определить, за какое время содержание препарата в организме человека уменьшится в 8 раз.
Вариант №11
1. Реакция протекает по уравнению: A + B = 2C и имеет первый порядок по веществу А и по веществу B. Начальные концентрации веществ равны: С0(A) = 0,3 моль/л; С0(B) = 0,5 моль/л; k = 0,1. Найти начальную скорость реакции и скорость реакции по истечении некоторого времени, когда концентрация А уменьшится на 0,1 моль/л.
2. При 100 0 С некоторая реакция заканчивается за 16 минут. Принимая температурный коэффициент скорости g равным 2, рассчитать, через сколько минут закончилась бы эта же реакция при 140 0 С?
3. Период полувыведения препарата из организма больного (реакция первого порядка) равен 2 часам. Определить время, за которое из организма будет выведено 99% препарата.
Вариант №12
1. Реакция протекает по уравнению: A + 2B = C и имеет первый порядок по веществу А и второй по веществу B. Начальные концентрации веществ равны: С0(A) = 0,9 моль/л; С0(B) = 1,5 моль/л; k = 0,6. Найти начальную скорость реакции и скорость по истечении некоторого времени, когда израсходуется 50% вещества A.
2. Чему равен температурный коэффициент скорости химической реакции g, если при увеличении температуры на 30 0 С скорость возрастает в 27 раз?
3. Период полупревращения некоторой реакции первого порядка равен 30 мин. Рассчитать, какая часть от исходного количества останется через 1 час.
Вариант №13
1. Реакция протекает по уравнению: 2A + B = 2C и имеет второй порядок по веществу А и первый по веществу B. Константа скорости реакции равна 5×10 — 2 . Рассчитать скорость реакции при начальных концентрациях С0(A) = 0,4 моль/л; С0(B) = 0,9 моль/л и скорость реакции к моменту образования 0,1 моль вещества С.
2. При температуре 10 0 С реакция протекает за 80 минут. При какой температуре реакция закончится за 20 минут, если температурный коэффициент скорости gравен 2?
3. В ходе лабораторных исследований было установлено, что за сутки концентрация препарата в организме больного снизилась от 0,1 моль/л до 0,02 моль/л. Вычислить период полуэлиминации препарата, считая, что данная реакция первого порядка.
Вариант №14
1. В закрытом сосуде объемом 1 л находится смесь газов, состоящая из 1 моль газа A и 3 моль газа B, которая реагирует по уравнению: A + 3B = 2C. Прямая реакция имеет первый порядок по веществу А и второй по веществу B. Как изменится скорость прямой реакции после того, как прореагирует 0,5 моль газа A?
2. При увеличении температуры системы от 10 до 50 0 С скорость химической реакции увеличилась в 16 раз. Определить температурный коэффициент скорости реакции g.
3. Во время аварии на Чернобыльской АЭС (1986 г.) произошел выброс радионуклида Cs-137, период полураспада которого составляет 30 лет. Рассчитать, какая часть попавшего в организм радионуклида осталась в настоящее время.
Вариант № 15
1. Реакция протекает по уравнению: A + B = C имеет первый порядок по веществу А и по веществу B. При начальных концентрациях веществ С0(A) = 0,6 моль/л; С0(B) = 0,8 моль/л скорость реакции равна 0,03 моль/л×с. Определить константу скорости и скорость реакции через некоторое время, когда концентрация вещества A уменьшится на 0,3 моль/л.
2. Скорость реакции при 0 0 С равна 1 моль/л×с. Вычислить скорость этой реакции при 30 0 С, если температурный коэффициент скорости реакции равен 3.
3. Константа скорости гидролиза пестицида при 25 0 С равна 0,32 с — 1 . Исходная концентрация пестицида в пробе составила 2,5 моль/л. Рассчитать, за какое время концентрация пестицида снизится до 0,01 моль/л.
Вариант №16
1. Реакция разложения протекает по уравнению: 2A = 2B + C и имеет второй порядок по веществу А. Константа скорости данной реакции при 200 0 С равна 0,05. Начальная концентрация С(A) = 2 моль/л. Определить скорость реакции при указанной температуре в начальный момент и в тот момент, когда разложится 80% вещества A.
2. Как изменится скорость прямой реакции: 2A(тв) + 3B(газ) = 2С(тв), которая имеет нулевой порядок по веществу А и третий по веществу B, если давление в системе увеличить в 3 раза?
3. В ходе некоторой реакции первого порядка за 45 мин превращению подвергается 20% исходного количества вещества. Определить, какая часть вещества останется через 1,5 часа.
Вариант №17
1. Взаимодействие газов протекает по уравнению: A + 2B = 2C и имеет первый порядок по веществу А и второй по веществу B. Начальные концентрации газов равны: С0(A) = 2 моль/л; С0(B) = 4 моль/л; k = 0,02. Вычислить скорость прямой реакции в начальный момент времени и по истечении некоторого времени, когда прореагирует 50%вещества A.
2. При 20 0 С реакция протекает за 2 мин. За какое время будет протекать эта же реакция при 0 0 С, если g = 2?
3. Муравьиная кислота разлагается на оксид углерода (IV) и водород на поверхности золота. Константа скорости этой реакции при 140 0 С равна 5,5×10 — 4 мин –1 , а при 185 0 С составляет 9,2×10 — 3 мин –1 . Определить энергию активации данной реакции.
Вариант №18
1. Реакция протекает по уравнению: 2A + B = 2C и имеет первый порядок по веществу А и по веществу B. Скорость реакции 0,5 моль/л×с. Начальные концентрации веществ равны: С(A) = 6 моль/л; С(B) = 3 моль/л. Определить константу скорости данной реакции и скорость реакции через некоторое время, когда концентрация вещества B уменьшится на 1 моль/л.
2. При 20 0 С реакция протекает за 2 мин. За сколько времени будет протекать эта же реакция при 50 0 С, если g = 2?
3. Константа скорости реакции инверсии тростникового сахара при 25 0 С равна 9,67×10 — 3 мин — 1 , а при 40 0 С составляет 73,4×10 — 3 мин –1 . Определить энергию активации данной реакции в указанном интервале температур.
http://www.chem.msu.su/rus/teaching/eremin1/2-9.html
http://mydocx.ru/12-66543.html