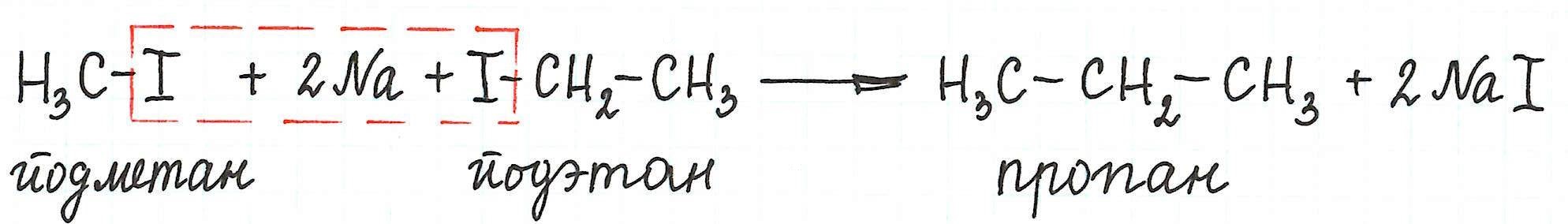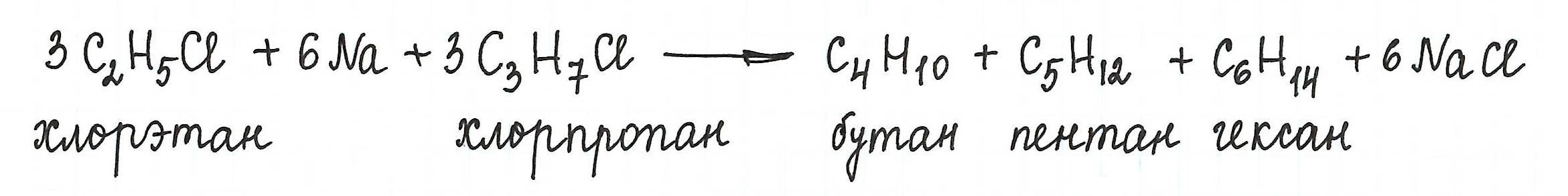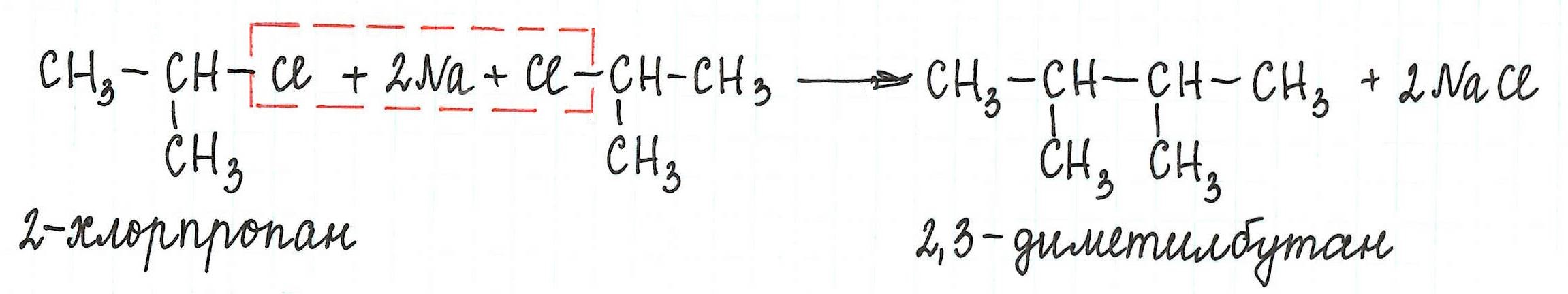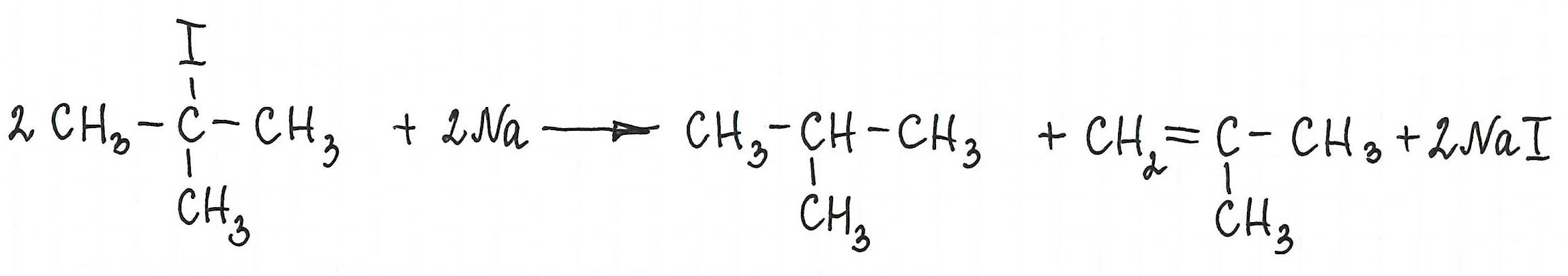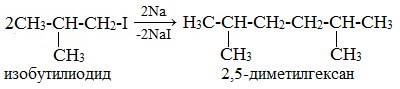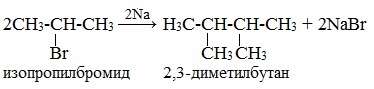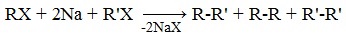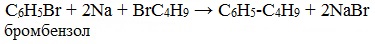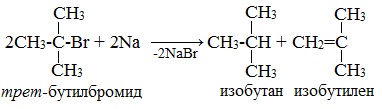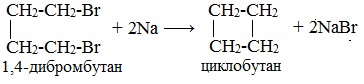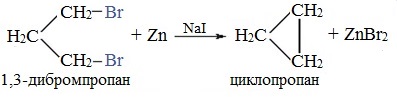РЕАКЦИЯ ВЮРЦА
Примеры реакции Вюрца очень популярны в задачах на цепочки превращений веществ.
Вюрц, Шарль Адольф (1817 – 1884), Франция.
Химик-органик, был у истоков создания органического синтеза.
1855г – открыл метод получения предельных углеводородов действием металлического натрия (или калия) на галогеналканы.
Этот метод носит имя ученого. Он известен под названием «реакция Вюрца» (или «синтез Вюрца»).
Подробнее об ученом здесь
Примеры межмолекулярной реакции Вюрца
* Реакцией Вюрца обычно получают алканы с четным числом атомов углерода в цепи. Причем количество углеродных атомов удваивается по сравнению с исходным веществом.
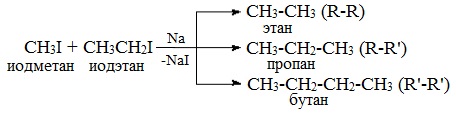
* Однако, при взаимодействии разных галогеналканов можно получить предельный углеводород с нечетным количеством атомов углерода в цепи:
* А вот взаимодействие галогеналканов с более длинной углеродной цепью приводит к образованию смеси алканов:
Отметим, что подобную смесь чрезвычайно трудно разделить на отдельные вещества.
* В результате взаимодействия галогеналканов с галогеном у вторичного атома углерода можно получить предельный углеводород разветвленного строения (однако, такие реакции используют редко):
* Примеры реакции Вюрца, в которой участвуют галогенопроизводные с галогеном у третичного атома углерода, привести не возможно: таковая не существует. В результате их взаимодействия с металлическим натрием (или калием) образуются алкан и алкен с изначальной углеродной структурой :
Примеры внутримолекулярной реакции Вюрца
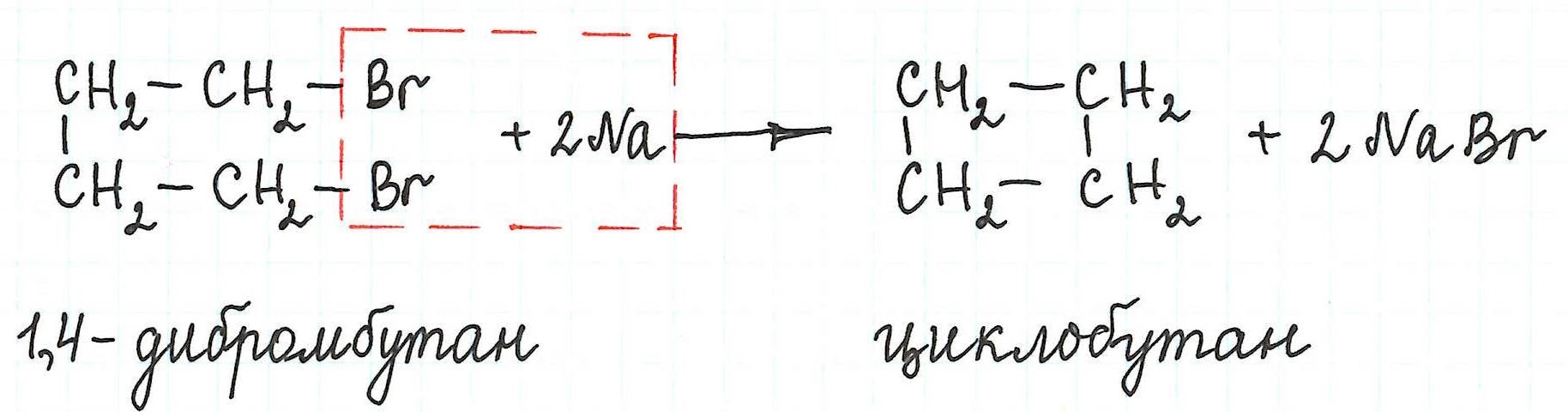
Внутримолекулярная реакция Вюрца приводит к образованию циклоалканов :
Реакция Вюрца обычно проходит при невысоких температурах и в среде эфира (например, диэтилового). Лучше, если в качестве галогеналкана будет вещество, содержащее бром или йод. Галогеналкан, в составе которого присутствует хлор, хуже вступает в подобные взаимодействия.
Реакция вюрца соответствует следующему химическому уравнению
Реакция Вюрца — конденсация алкилгалогенидов под действием Na (реже — Li или К) с образованием предельных углеводородов.
Реакция Вюрца — метод синтеза симметричных насыщенных углеводородов действием металлического натрия на алкилгалогениды (галогеналканы).
Легче реакция происходит с алкилиодидами и алкилбромидами, труднее – с алкилхлоридами.
В результате образуется алкан с более сложной углеродной цепью.
Реакцию обычно проводят в диэтиловом эфире.
В процессе реакции Вюрца происходит удвоение углеводородного скелета молекулы и образуется насыщенный углеводород (алкан). Эта реакция находит ограниченное применение, поскольку таким путем можно получать только симметричные алканы.
В основном с ее помощью получают предельные углеводороды с длинной углеродной цепью, особенно она полезна при получении индивидуальных углеводородов большой молекулярной массы (например, гептаконтана C70H142).
Реакцию используют для получения углеводородов с четным числом С-атомов. Если ввести в реакцию два различных галогеналкана, то образуется смесь трех продуктов.
Например, при взаимодействии метил- и этилиодидов с натрием наряду с пропаном образуется этан и бутан:
Эта реакция была открыта французким химиком Ш. Вюрцем в 1855 г. при попытке получения этилнатрия из хлористого этила и металлического натрия.
В 1864г. немецкий химик Р. Фиттиг предложил реакцию, подобную реакции Вюрца, для синтеза жирноароматических углеводородов (реакция Вюрца-Фиттига).
Реакция Вюрца используется для первичных алкилгалогенидов. Для вторичных алкилгалогенидов не имеет практического значения, т.к выход целевого продукта составляет всего 10-15%.
Реакцию Вюрца невозможно использовать для третичных алкилгалогенидов, т.к. вместо алкана с удвоенным числом атомов углерода образуется смесь алкана и алкена с исходным углеродным скелетом.
Внутримолекулярная реакция Вюрца
Реакция Вюрца успешно применяется для внутримолекулярных конденсаций. Этим путем можно получать циклоалканы заданного строения.
При взаимодействии 1,4-дибромбутана с металлическим натрием можно получить циклобутан:
Из 1,3-дибромпропана под действием металлического цинка и йодида натрия, как активатора, может быть получен циклопропан:
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://himija-online.ru/imennye-reakcii/reakciya-vyurca.html http://acetyl.ru/f/r141.php |