Метан: способы получения и свойства
Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
Гомологический ряд метана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение метана
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp 3 :
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода |
Изомерия метана
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Химические свойства метана
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
Например. При нитровании метана образуется преимущественно нитрометан:2. Реакции разложения метана (д егидрирование, пиролиз)При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ: Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен: Пиролиз метана – промышленный способ получения ацетилена. 3. Окисление метанаАлканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеАлканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С. Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода: Эта реакция используется для получения сажи. 3.2. Каталитическое окисление
Продукт реакции – так называемый «синтез-газ». Получение метана1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя. 2. Водный или кислотный гидролиз карбида алюминияЭтот способ получения используется в лаборатории для получения метана. 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия: 4. Синтез Фишера-ТропшаИз синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды: Это промышленный процесс получения алканов. Синтезом Фишера-Тропша можно получить метан: 5. Получение метана в промышленностиВ промышленности метан получают из нефти, каменного угля, природного и попутного газа . При переработке нефти используют ректификацию, крекинг и другие способы. Реакция замещения в химии — как определить, признаки, примеры уравненийПерераспределение электронов и ядер, при котором образуется новое вещество, называется химической реакцией. Это физико-химическое взаимодействие, приводящее к образованию нового соединения. Если атомы простого реагента занимают места химических элементов в сложном, то этот процесс называют реакцией замещения. При этом может образовываться не одно, а сразу два вещества. Общие сведенияВсе вещества принято разделять на два вида. Химические тела, образованные атомами одного химического реагента, называют простыми. Например, железо, в состав которого входят молекулы, образованные атомами Fe. Тела, состоящие из атомов разных элементов, относят к сложному виду — например, серная кислота. Состоит H2SO4 из молекул, образующихся атомами водорода, серы и кислорода. В процессе химических взаимодействий новые вещества получаются только из тех атомов, которые имелись в исходном состоянии. Для того чтобы понять, по каким признакам происходит классификация химических реакций, следует рассмотреть несколько уравнений. Медь, взаимодействуя с кислородом, образует оксид меди два: 2Cu + O2 — 2CuO. При смешении сульфата меди и гидроксида натрия образуется синий гидроксид меди и сульфат натрия: CuSO4 + 2NaOH — Cu (OH)2 + Na2SO4. Оксид гидраргиума распадается на двухвалентный кислород и ртуть: 2HgO — 2Hg + O2. Кальций, соединяясь с углекислым газом, образует карбонат: CaO +CO2 — CaCO3. Цинк при смешении с серной кислотой вытесняется ею: Zn + H2SO4 — ZnSO4 + H2, гидроксид железа распадается на трёхвалентное железо и воду: 2Fe (OH) — Fe2O3 + 3H2O. Таким образом, различные реакции можно объединить в группы по количеству, составу и качеству исходных веществ и продуктов. Всего их существует четыре вида:
Механизмы взаимодействияПротекание реакций замещения в органической химии описывают механизмами. Под ними понимают процесс детального изучения всех стадий и промежуточных веществ, а также природы взаимодействия реагентов между собой. Ими описывают характер разрыва связей и изменение энергии при переходе из начального состояния в конечное. Механизмы замещения характеризуют по наиболее часто используемой классификации Ингольда, основоположником многих понятий органической химии. По его таблице, реакцию замещения (S) разделяют по составу частиц входящих во взаимодействия. Она бывает:
Это удобная классификация, хотя они и не учитывает молекулярность соединений. Её альтернативной является разделение по Июпаку. Оно реже используется и основано на описании базовых актов создания и уничтожения связей. Предложена классификация была в 1988 году. Июпак утверждал, что использование классификации Ингольда вызывает двусмысленные ситуации, когда одно объяснение может использоваться для разного замещения, например, одностадийного ароматического замещения и двустадийной реакции алифатического атома углерода. В его описании используются символы A и D, пишущиеся слитно при отщеплении и разделенные плюсом, если стадии происходят отдельно. Нижние индексы обозначают тип реакции. Такое описание обычно громоздкое, поэтому в учебной литературе редко когда приводится. Электрофильные и нуклеофильные Самое важное, что нужно знать об электрофильных реакциях, это то, что существует два варианта разрыва связи: монополярная и гетерополярная. В первом случае электронная пара разрушающегося соединения не разрывает связь с атомом углерода. Например, вещество, для которого характерна реакция замещения, метан: H3CH — H3C +H, то есть из предельного углеводорода образуется отрицательно заряженный карбанион, а электронная пара остаётся у атома углерода. Карбанионы могут быть разной гибридизации sp2 и sp3. Чем больше их устойчивость, тем у них ниже способность к реакциям. Определяется она степенью делокализации заряда у атома углерода. Устойчивость уменьшается в ряду: фенил — винил — циклопропил — метил. Самая слабая у вторичного и третичного карбаниона (разделение происходит по количеству связей углерода). Образование новой связи происходит путём обобщения освободившейся свободной пары углерода с реагентом. При этом последний должен иметь положительный заряд или секстет электронов. Элемент в этом случае является электрофильной химической частичкой. Например, к таким реакциям замещения относится взаимодействие брома с углеродом. Формула такой записи, следующая: H3C: Br+: Br- — H3CBr + Br. Электрофильные реагенты бывают:
Нуклеофильная реакция будет протекать при разрушении углеродной связи. В этом случае электронная пара отсоединяется. Образуется углеродный ион с положительным зарядом. Формула записи будет соответствовать виду: H3C: Cl — H3C+: Cl-. Образуемый элемент носит название карбкатион. Электронная пара теряет атом углерода. Положительный заряд находится в sp2-гибридизации, то есть, меняет своё валентное состояние на более энергетически выгодное. Устойчивость карбкатионов определяется степенью делокализации. Она увеличивается в ряду метил — катион — первичный — вторичный — третичный. При нуклеофильной реакции происходит обобщение электронной пары, которую представляет реагент. Субстрат обладает дефицитом электронов (+), а реагент (-). Например, H3C+ + K+OH- — H3COH + K+. Есть закономерность, что все гетерополярные реакции проходят легче с полярными соединениями и поляризующимися связями. Радикальные реакцииРадикалами называют отдельные атомы или их группы с неспаренным электроном. Алкильные обозначаются латинской буквой R с рядом стоящей точкой. Свободный электрон находится на p -орбитали, находящийся на перпендикулярной плоскости С. На геометрию радикала сильное влияние оказывают заместители. Существуют такие атомы короткое время и их количество незначительно. Затормозить свободнорадикальные реакции можно ингибиторами или инициаторами, так как они очень реакционноспособные частицы. В качестве ингибиторов выступает кислород, йод, полифенол, амин и другие соединения. Есть два способа появления радикалов:
Устойчивое состояние определяется делокализацией свободной частицы, пространственным и конформационным фактором. К первичным радикалам относят: метилы, этилы, пропилы и изобутилы. К вторичным — изопропилы, втор-бутилы, а к третичным — трет-бутилы. Стабилизация возрастает от первичных к третичным. Наиболее типичным механизмом является реакция замещения хлорирования метана: CH 4 + Cl 2 — CH3Cl + HCl. При радикальном замещении происходит следующее:
К более серьёзным реакциям относится взаимодействие брома с пропаном в результате термолиза: CH3CH2CH3 + Br2 — CY3CHCH3: Br + HBr. При обрыве цепи, после взаимодействия двух радикалов, образуется молекула брома. Реакция радикала с изопропилом приводит к появлению двух бром пропан, а также образованию соединение «два, три диметилбутан».
Типичное замещениеРазличные задания на определение типа реакций начинают решать в восьмом классе. Для того чтобы решать задачи, необходимо не только правильно знать, как записать процесс, но и определить невозможный тип, а также различать вид термического процесса. Ведь протекание любой химической реакции невозможно без поглощения или выделения тепла. Такие процессы соответственно называются экзотермическими и эндотермическими. К особенностям элементов, способных участвовать в реакции, относят:
Примеры и онлайн-решенияРеакции замещения в своём большинстве являются окислительно-восстановительными. Примеры процессов, в которых не наблюдается изменение степени окисления, немногочисленны. Из распространённых реакций, можно привести следующие:
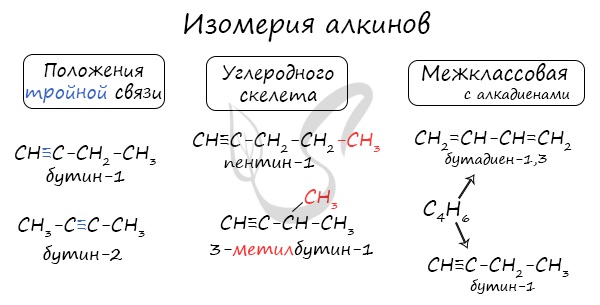
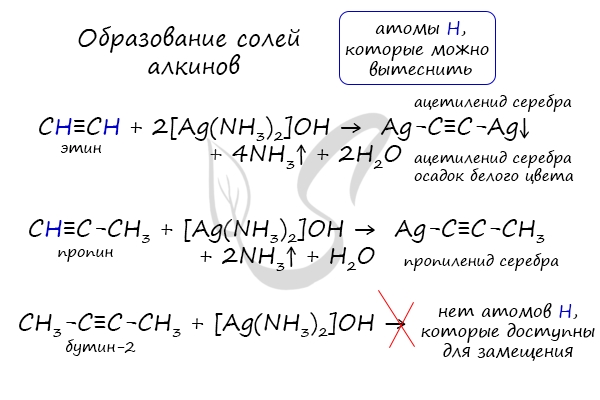
Для проверки своих знаний существуют интернет-сервисы, позволяющие быстро решить любое химическое уравнение онлайн, например, chemequations.com. Пользоваться им сможет любой, даже тот, кто не умеет правильно указать обозначения химических элементов. Для работы с сайтом необходимо написать части соединения (система будет сама предлагать правильное их обозначение) и нажать «Поиск». Правильное решение будет рассчитано автоматически. АлкиныАлкины — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну тройную связь С≡С. Каждая такая связь содержит одну сигма-связь (σ-связь) и две пи-связи (π-связи). Алкины также называют ацетиленовыми углеводородами. Первый член гомологического ряда — этин — CH≡CH (ацетилен). Общая формула их гомологического ряда — CnH2n-2. Номенклатура и изомерия алкиновНазвания алкинов формируются путем добавления суффикса «ин» к названию алкана с соответствующим числом: этин, пропин, бутин и т.д. При составлении названия алкина важно учесть, что главная цепь атомов углерода должна обязательно содержать тройную связь. Нумерация атомов углерода в ней начинается с того края, к которому ближе тройная связь. В конце названия указывают атом углерода у которых начинается тройная связь. Для алкинов характерна изомерия углеродного скелета, положения тройной связи, межклассовая изомерия с алкадиенами. Пространственная геометрическая изомерия для них невозможна, ввиду того, что каждый атом углерода, прилежащий к тройной связи, соединен только с одним единственным заместителем. Некоторые данные, касающиеся алкинов, надо выучить:
Получение алкиновАцетилен получают несколькими способами:
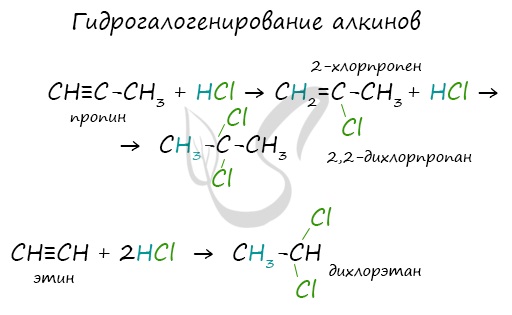
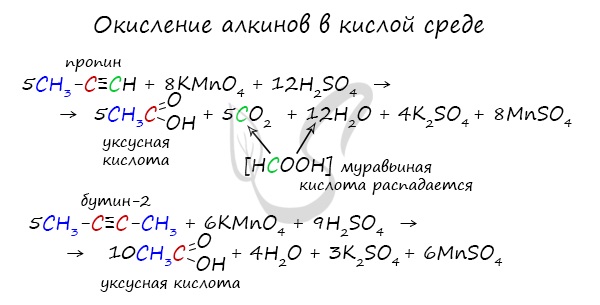
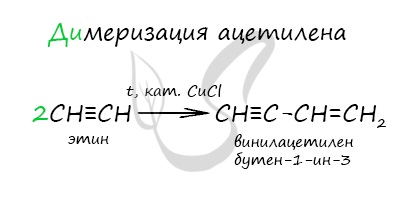
При нагревании метана до 1200-1500 °C происходит димеризация молекул метана, в ходе чего отщепляется водород. Осуществляется напрямую, из простых веществ. Протекает на вольтовой (электрической) дуге, в атмосфере водорода. 2C + H2 → (t, вольтова дуга) CH≡CH Разложение карбида кальция В результате разложения карбида кальция образуется ацетилен и гидроксид кальция II. Получение гомологов ацетилена возможно в реакциях дегидрогалогенирования дигалогеналканов, в которых атомы галогена расположены у одного атома углерода или у двух соседних атомов. Химические свойства алкиновАлкины — ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны. Водород присоединяется к атомам углерода, образующим тройную связь. Пи-связи (π-связи) рвутся, остается единичная сигма-связь (σ-связь). CH≡C-CH3 + H2 → (t, Ni) CH2=CH-CH3 (в реакции участвует 1 моль водорода) CH≡CH + 2H2 → (t, Ni) CH3-CH3 (в реакции участвует 2 моль водорода) Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу. Алкины вступают в реакции гидрогалогенирования, протекающие по типу присоединения. Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода. Реакцией Кучерова называют гидратацию ацетиленовых соединений с образованием карбонильных соединений. Открыта русским химиком М.Г. Кучеровым в 1881 году. Катализатор — соли ртути Hg 2+ . Только в реакции с ацетиленом образуется уксусный альдегид. Во всех остальных реакциях (с гомологами ацетилена) образуются кетоны. При горении алкины, как и все органические соединения, сгорают с образование углекислого газа и воды — полное окисление. Сильные окислители (особенно в подкисленной среде) способны разрывать молекулы алкинов в самом слабом месте — в месте тройной связи. Так, при окислении пропина, образуется уксусная кислота и муравьиная кислота, окисляющаяся до угольной кислоты, которая распадается на углекислый газ и воду. Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород — бензол. Димеризация ацетилена происходит при наличии катализатора — солей меди I. В результате реакции две молекулы ацетилена соединяются, образуя винилацетилен. В случае если тройная связь прилежит к краевому атому углерода, то имеющийся у данного атома водород может быть замещен атомом металла. Если тройная связь спрятана внутри молекулы, то образование солей невозможно. Реакция аммиачного раствора серебра и ацетилена — качественная реакция, в ходе которой выпадает осадок ацетиленида серебра. © Беллевич Юрий Сергеевич 2018-2022 Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию. источники: http://sprint-olympic.ru/uroki/himija/97935-reakciia-zamesheniia-v-himii-kak-opredelit-priznaki-primery-yravnenii.html http://studarium.ru/article/185 |