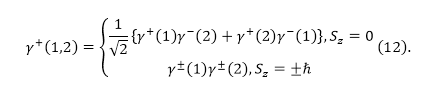Основное состояние атома гелия
Вы будете перенаправлены на Автор24
Самым простым, после атома водорода является атом гелия. Его атомная оболочка содержит два электрона. Попытки описать данный атом используя квантовую теорию Бора стали несостоятельными.
- Теория Бора не дает возможность учесть обменную энергию, которая играет значимую роль в многоэлектронных атомах.
- Данная теория не учитывает существование спина у электрона.
Уравнение Шредингера для атома гелия
Перемещение частицы в потенциальном поле можно описать при помощи уравнения Шредингера:
где гамильтониан частицы имеет вид:
Подробная запись уравнения (1) для одного электрона принимает вид:
Атом гелия имеет два электрона. Полная энергия системы сложится из:
кинетических энергий электронов в атоме:
потенциальных энергий 2 электронов в одном поле ядра атома гелия: $E_
энергии взаимодействия электронов:
где $r_<12>=\left|<\overrightarrow
При этом волновая функция зависит от шести переменных (координат 2 электронов). Так, уравнение (3) предстанет в виде:
Выражение вида $<\left|\Psi(<\overrightarrow
Цель задачи в нахождении собственных значений и собственных функций уравнения (7). При этом требования, которые накладываются на собственную функцию остаются такими же, как и для одного электрона. Точное решение данного уравнения крайне сложная задача. Самым часто используемым приближением при решении уравнения (7) является представление волновой функции в виде произведения функций для каждого электрона в отдельности, которая изменяет знак при одновременной перестановке координат и спиновых переменных. Так для нерелятивистского случая волновую функцию для двух электронов записывают как:
Готовые работы на аналогичную тему
где $\Psi_a\left(1\right)$— волновая функция первого электрона, который находится в состоянии$\ a$ (при этом считают, что $E_a(1)$ — энергия первого электрона в состоянии $a$, $\Psi_b\left(2\right)$ — волновая функция второго электрона в состоянии $b$.
Если $<\varphi >_a\left(<\overrightarrow
где $\gamma $ — спиновая функция электрона. Функцию для двух электронов запишем как:
Знаки $\pm $ соответствуют симметричной (или антисимметричной функциям). Они выбираются согласованно. Антисимметричная спиновая функция соответствует состоянию, при котором полный спин равен нулю $(S=0)$ (синглет). Ее можно выразить через одночастичные ортонормированные спиновые функции, которые определяют состояние одного электрона:
Для триплетного состояния (при $S=1$) ортонормированные спиновые функции можно представить как:
Для координатной функции можно записать:
здесь индексы $1$ и $2$ определяют одночастичные состояния электронов.
В основном состоянии атома гелия координатная волновая функция должна быть симметричной по отношению к перестановке. Координатные волновые функции, для отдельных электронов в основном состоянии атома гелия, из-за высокой симметрии состояния, выбирают одинаковыми и самыми простыми, это означает, что ограничиваются $s-$ состоянием. Радиальные функции выбирают так, чтобы они не были равны нулю при конечных расстояниях. Основное состояние атома гелия описывается электронной конфигурацией: $1s^2.$
Задание: Найдите в нулевом приближении энергию полной ионизации, если атом гелия находится в основном состоянии.
Решение:
Искомая энергия ионизации равна работе по удалению на бесконечность $2$ электронов атома гелия.
Сложность задачи об атоме гелия вызвана присутствием в уравнении (7) члена $E_
Так, работа по удалению электрона в бесконечность из атома водорода, который находится в основном состоянии, равна:
Для ионизированного один раз атома гелия такая работа будет в $Z^2$ раз больше. Если удаляют два электрона, то энергию ионизации в нулевом приближении для атома гелия находящегося в основном состоянии, можно найти как:
Ответ: $
Задание: Объясните, почему в нулевом приближении разница между вычисленным значением энергии полной ионизации атома гелия в основном состоянии и экспериментальным значением для той же величины ошибка составляет около $40\%$. Согласно экспериментальным данным энергия полной ионизации атома гелия составляет $78,98$ эВ.
Решение:
Разница в энергии ионизации возникает, так как в нулевом приближении не учитывается взаимодействие электронов. Зная волновую функцию в нулевом приближении ($\Psi^0$) можно применить формулу:
где $<\hat
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 22 06 2021
Лекция №1. Квантов0механическ0е обоснование теории строения молекул и химической связи. Строение атома (стр. 3 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 |
Решения, близкие к истинным, получают с помощью современных ЭВМ, используя чаще всего метод самосогласованного поля (ССП-метод), предложенный Хартри и развитый Фоком.
В ССП-методе межэлектронным отталкиванием не пренебрегают. В этом методе действие полей всех остальных электронов на данный электрон заменяют усредненным полем, эффект которого приближенно равен суммарному действию остальных электронов и зависит от координаты только данного электрона ri. Это делает возможным разделение переменных в уравнении Шредингера. Тогда волновая функция атома с. n электронами примет вид
Усреднение, как и всякое усреднение в квантовой механике, выполняется при помощи волновых функций электронов. В нулевом приближении 



Эта процедура поиска лучшей функции X называется самосогласованием. Самосогласованная волновая функция атома в методе Хартри представляет собой произведение самосогласованных одноэлектронных волновых функций — атомных орбиталей Хартри. Поэтому и приближение Хартри — Фока называют орбитальным или одноэлектронным приближением. Как показал Фок, с учетом спина электронов и принципа Паули волновая функция атома имеет вид определителя. Для атома гелия, например,

где 1 и 2 — координаты электронов; α и β символы квантовых состояний, определяемых набором квантовых чисел. В орбитальном приближении энергия атома Е равна сумме одноэлектронных энергий Ei.
Метод Хартри — Фока используется для расчета распределения электронной плотности, орбитальных энергий и других физических характеристик в атомах и молекулах. В орбитальном приближении часто вместо сложно выражаемых АО Хартри — Фока применяют простые и хорошо аппроксимирующие их АО Слейтера.
Наглядную картину многоэлектронного атома можно нарисовать на основе обобщения результатов квантовомеханических расчетов. Мысленно можно выделить в N-электронном атоме один рассматриваемый электрон. Остальные N — 1 электронов вместе с ядром составят атомный остов Реальный потенциал, действующий на данный электрон, можно заменить суммой потенциала ядра и усредненного потенциала остальных N — 1 электронов. Эффективный заряд, действующий на электроны (Zэфф), можно рассчитать, например, по правилам Слейтера. Эффективные заряды ядер атомов, по Слейтеру, приведены ниже.
Атом Н Не Li Be В С N О F Ne Na
Zэфф 1 1,70 1,30 2,05 2,60 3,25 3,90 4,55 5,20 5,85 2,20
Поле, создаваемое атомным остовом, хотя и не кулоновское, имеет центральную симметрию, как и поле ядра в водородоподобном атоме, вследствие чего и здесь квантовые числа n и ℓ сохраняют свое значение. Однако в отличие от водородоподобного атома энергия электрона зависит не только от n, но и от ℓ, вырождение по ℓ снимается: электрон движется в поле не одного ядра, но остова, и энергия электрона зависит от того, как он поляризует остов (нарушает его центральную симметрию) и как он проникает внутрь остова. Поляризация же и проникновение зависят от типа орбитали, т. е. от квантового числа ℓ.
Одним из основных постулатов квантовой механики является принцип тождественности элементарных частиц: одинаковые частицы тождественны и неразличимы. В атоме или молекуле никакими физическими методами нельзя «пометить» один из электронов, чтобы отличить его от других.
Вследствие этого описание многоэлектронных систем и систем из других частиц имеет свои особенности.
Так, волновая функция системы из двух электронов (например, в атоме гелия) может быть записана в нулевом приближении как

где 


В соответствии с принципом суперпозиции общее решение уравнения Шредингера является линейной комбинацией частных решений:

Выбор знака зависит от симметрии волновой функции, т. е. от внутренних свойств микрочастиц для которых решается уравнение Шрёдингера.
Функция со знаком (+) симметрична по отношению к перестановке координат электронов, т. е. она не изменяет знака при такой перестановке. Системы частиц, описываемые симметричными функциями, подчиняются квантовой статистике (Бозе — Эйнштейна); функция со знаком (-) антисимметрична, она меняет знак при перестановке электронов.
Антисимметричные функции описывают системы частиц, подчиняющиеся статистике Ферми — Дирака. В зависимости от статистики частицы называются бозонами и фермионами.
К бозонам относятся частицы с целочисленным спином (s=0,1. ), например, фотоны. Электроны, как и другие частицы с полуцелым спином(s=1/2), являются фермионами и описываются антисимметричными полными волновыми функциями. Это важнейшее положение называют принципом реализации симметрии волновой функции или принципом Паули. Для двухэлектронной системы функцию
можно записать в виде определителя [см. 4.3]
Для системы из N-электронов определитель имеет вид:
X= 
Из того фундаментального факта, что системы электронов описываются антисимметричными волновыми функциями, следует принцип запрета Паули: в многоэлектронной системе (в атоме, молекуле, кристалле) не может быть двух электронов в одинаковом квантовом состоянии, т. е. двух электронов, у которых все четыре квантовых числа совпадают.
В самом деле, если наборы квантовых чисел α и β одинаковы, в определителе первая и вторая строка совпадают, и он будет равен нулю, т. е. описываемая им система не существует. Из принципа запрета Паули следует, что на одной атомной орбитали может находиться не более двух электронов с условием, что их спины антипараллельны (ms = 1/2 и ms = — 1/2). Таким образом, на одной АО электроны могут иметь одни и те же значения квантовых чисел n, ℓ и mℓ; но вследствие принципа запрета Паули должны различаться квантовым числом ms.
Электроны в атоме можно разделить на квантовые слои (оболочки). Квантовый слой, или оболочка, совокупность электронов с данным главным квантовым числом n. Внутри слоя электроны разделяются по энергии на подоболочки s, p d, f и т. д. в соответствии с квантовым числом ℓ.
Наиболее «проникающими» в данном квантовом слое являются s-орбитали, так как их максимумы лежат ближе всего к ядру; в ряду s-, р-, d — и f-подуровней проникновение уменьшается (рис. 3.9). Поэтому в данном слое сильнее всего связаны с ядром s-электроны, затем р-электроны и т. д. Различие в энергии между ними растет с увеличением заряда ядра.
 |
На основании изучения спектров атомов и квантовомеханических расчетов установлена следующая последовательность энергетических уровней в многоэлектронных атомах:
1s ℓ2, возможны следующие значения L: ℓ1 + ℓ2, ℓ1 + ℓ2 – 1, ℓ1 — ℓ2.Так, для атома углерода ℓ1 = ℓ2 = 1, L = 2, 1 и 0. Векторы спинов также складываются, давая вектор атомного спинового момента 

где S — спиновое квантовое число атома, определяемое через спиновые квантовые числа электронов. Например, для атома с двумя электронами 

Описание состояния атома с помощью квантовых чисел L и S называют схемой Рассела — Саундерса. Одной и той же конфигурации могут отвечать состояния (атомные термы) с различными значениями L и различными значениями S. Атомные термы с различными значениями L сильно отличаются по энергии, поэтому для них введены специальные обозначения:
Квантовое число L
Заметное влияние на энергию терма оказывает спин-орбитальное взаимодействие. Орбитальный и спиновый моменты атома L и S складываются, образуя вектор полного момента импульса тома
Модуль вектора 
В результате спин-орбитального взаимодействия терм с данными L и S разделяется на 2S + 1 близлежащих уровней, называемых компонентами мультиплета и отличающихся значением квантового числа J. Число 2S+1 называют мультиплетностью терма. Термы с числом 2S + 1, равным 1, 2, 3 и т. д., называют соответственно синглетными, дублетными, триплетными и т. д.
Во внешнем слабом магнитном поле происходит пространственное квантование вектора J; он ориентируется в поле 2J+1 способами. Вследствие взаимодействия с полем терм с данным значением J в магнитном поле расщепляется на 2J + 1 подуровней. В отсутствие поля все подуровни сливаются в один, т. е. у терма с данным J существуют 2J+1 состояния с разной энергией. Число 2J + 1 называют статистическим весом терма. Оно используется при вычислении электронной составляющей термодинамических функций атомарных газов и интерпретации атомных спектров. Для термов с J = 3/2 и 1/2 статистический вес равен соответственно 4 и 2, т. е. первое состояние осуществляется вдвое чаще, чем второе при прочих равных условиях.
Таким образом, данной конфигурации может отвечать несколько термов, различающихся по энергии. Терм с низшей энергией называют основным и принимают за нуль отсчета энергии. В полном символе атомного терма отражены все три квантовых числа: L, S и J, от которых зависит энергия терма 2S+1Lj. Терм атома с заполненными оболочками s2, p6, d10 или f14 всегда 1S0 ) так как у заполненных оболочек L = 0 и S = 0. В табл. 4.2 приведены возможные термы для атомов с эквивалентными S— и P— электронами.
Таблица 5.2. Атомные термы, допустимые для конфигураций с эквивалентными электронами
Как видно, основным в соответствии с первым правилом Хунда является терм с высшей мультиплетностью (с высшим значением спина).
Энергии термов находят по известным атомным спектрам. Последние возникают, когда атом, поглощая или испуская квант энергии, переходит из одного стационарного состояния в другое. Частота линии в спектре определяется из условия частот Бора:.
где Е» и Е’ — энергии верхнего и нижнего уровней соответственно.
Как правило, оптические спектры атома связаны с переходом одного из электронов внешнего слоя. Допустимы переходы, для которых выполняются условия, называемые правилами отбора



Энергия ионизации и сродство к электрону. Важнейшими характеристиками электронной конфигурации атома являются энергия ионизации (ЭИ) или потенциал ионизации (ПИ) и сродство атома к электрону (СЭ). Энергией ионизации называют изменение энергии в процессе отрыва электрона от свободного атома при 0 К: А → 
При этом подразумевается, что электрон отрывается с высшей занятой атомной орбитали (ВЗАО), удаляясь на бесконечное расстояние, и что атом А и образовавшийся ион А+ находятся в основных состояниях. Такую ЭИ называют также первой энергией ионизации ЭИ1 Энергии ионизации высших порядков ЭИ2, ЭИ3 и т. д. отвечают дальнейшему последовательному отрыву электронов от образовавшегося иона А+, затем А++ и т. д. с В иона. Там, где специально не оговорен порядок, под ЭИ понимают первую энергию ионизации. Для атома с n электронами ЭИn > ЭИn-1 > ЭИ2 > ЭИ1. Сумма всех последовательных ЭИ составляет полную электронную энергию атома 
Для большинства атомов ЭИ измерены с высокой точностью спектроскопическим методом, основанным на определении предела схождения линий в атомных спектрах.
В последние годы методами фотоэлектронной и рентгеноэлектронной спектроскопии удалось измерить первые ЭИ не только с ВЗАО, но и с других, в том числе глубинных атомных орбиталей (орбитальные ЭИ). Например, для атома углерода при одной и той же конфигурации 1s22s22p2 первые ЭИ с 2р-В глубинной 2s-AO равны соответственно 11,26 и 20 эВ.
Согласно теореме Купманса, орбитальная ЭИ приближенно равна энергии электрона на данной АО. ЭИ служат мерой прочности связи электрона с атомным остовом в атоме, их зависимость от порядкового номера Z элемента имеет ярко выраженный периодический характер. В связи с этим изменение энергии ионизации коррелирует с изменением многих свойств элементов и их соединений, что используется для предсказания этих свойств по значениям ЭИ.
Сродством атома к электрону называют изменение энергии в процессе присоединения электрона к свободному атому с образованием отрицательного иона при 0 К: А + e = А — (атом и ион находятся в своих основных состояниях). При этом электрон занимает низшую свободную атомную орбиталь (НСАО), если В двумя электронами. Если В и занята не полностью, то присоединяемый электрон заселяет ее с соблюдением первого правила Хунда.
Уравнение Шрёдингера
Дуальная корпускулярно-волновая природа квантовых частиц описывается дифференциальным уравнением.
Согласно фольклору, столь распространенному среди физиков, случилось это так: в 1926 году физик-теоретик по имени Эрвин Шрёдингер выступал на научном семинаре в Цюрихском университете. Он рассказывал о странных новых идеях, витающих в воздухе, о том, что объекты микромира часто ведут себя скорее как волны, нежели как частицы. Тут слова попросил пожилой преподаватель и сказал: «Шрёдингер, вы что, не видите, что всё это чушь? Или мы тут все не знаем, что волны — они на то и волны, чтобы описываться волновыми уравнениями?» Шрёдингер воспринял это как личную обиду и задался целью разработать волновое уравнение для описания частиц в рамках квантовой механики — и с блеском справился с этой задачей.
Тут необходимо сделать пояснение. В нашем обыденном мире энергия переносится двумя способами: материей при движении с места на место (например, едущим локомотивом или ветром) — в такой передаче энергии участвуют частицы — или волнами (например, радиоволнами, которые передаются мощными передатчиками и ловятся антеннами наших телевизоров). То есть в макромире, где живём мы с вами, все носители энергии строго подразделяются на два типа — корпускулярные (состоящие из материальных частиц) или волновые. При этом любая волна описывается особым типом уравнений — волновыми уравнениями. Все без исключения волны — волны океана, сейсмические волны горных пород, радиоволны из далеких галактик — описываются однотипными волновыми уравнениями. Это пояснение нужно для того, чтобы было понятно, что если мы хотим представить явления субатомного мира в терминах волн распределения вероятности (см. Квантовая механика), эти волны также должны описываться соответствующим волновым уравнением.
Шрёдингер применил к понятию волн вероятности классическое дифференциальное уравнение волновой функции и получил знаменитое уравнение, носящее его имя. Подобно тому как обычное уравнение волновой функции описывает распространение, например, ряби по поверхности воды, уравнение Шрёдингера описывает распространение волны вероятности нахождения частицы в заданной точке пространства. Пики этой волны (точки максимальной вероятности) показывают, в каком месте пространства скорее всего окажется частица. Хотя уравнение Шрёдингера относится к области высшей математики, оно настолько важно для понимания современной физики, что я его все-таки здесь приведу — в самой простой форме (так называемое «одномерное стационарное уравнение Шрёдингера»). Вышеупомянутая волновая функция распределения вероятности, обозначаемая греческой буквой ψ («пси»), является решением следующего дифференциального уравнения (ничего страшного, если оно вам не понятно; главное — примите на веру, что это уравнение свидетельствует о том, что вероятность ведёт себя как волна):
где x — расстояние, h — постоянная Планка, а m, E и U — соответственно масса, полная энергия и потенциальная энергия частицы.
Картина квантовых событий, которую дает нам уравнение Шрёдингера, заключается в том, что электроны и другие элементарные частицы ведут себя подобно волнам на поверхности океана. С течением времени пик волны (соответствующий месту, в котором скорее всего будет находиться электрон) смещается в пространстве в соответствии с описывающим эту волну уравнением. То есть то, что мы традиционно считали частицей, в квантовом мире ведёт себя во многом подобно волне.
Когда Шрёдингер впервые опубликовал свои результаты, в мире теоретической физики разразилась буря в стакане воды. Дело в том, что практически в то же время появилась работа современника Шрёдингера — Вернера Гейзенберга (см. Принцип неопределенности Гейзенберга), в которой автор выдвинул концепцию «матричной механики», где те же задачи квантовой механики решались в другой, более сложной с математической точки зрения матричной форме. Переполох был вызван тем, что ученые попросту испугались, не противоречат ли друг другу два в равной мере убедительных подхода к описанию микромира. Волнения были напрасны. Сам Шрёдингер в том же году доказал полную эквивалентность двух теорий — то есть из волнового уравнения следует матричное, и наоборот; результаты же получаются идентичными. Сегодня используется в основном версия Шрёдингера (иногда его теорию называют «волновой механикой»), так как его уравнение менее громоздкое и его легче преподавать.
Однако представить себе и принять, что нечто вроде электрона ведёт себя как волна, не так-то просто. В повседневной жизни мы сталкиваемся либо с частицей, либо с волной. Мяч — это частица, звук — это волна, и всё тут. В мире квантовой механики всё не так однозначно. На самом деле — и эксперименты это вскоре показали — в квантовом мире сущности отличаются от привычных нам объектов и обладают другими свойствами. Свет, который мы привыкли считать волной, иногда ведёт себя как частица (которая называется фотон), а частицы вроде электрона и протона могут вести себя как волны (см. Принцип дополнительности).
Эту проблему обычно называют двойственной или дуальной корпускулярно-волновой природой квантовых частиц, причем свойственна она, судя по всему, всем объектам субатомного мира (см. Теорема Белла). Мы должны понять, что в микромире наши обыденные интуитивные представления о том, какие формы может принимать материя и как она себя может вести, просто неприменимы. Сам факт, что мы используем волновое уравнение для описания движения того, что привыкли считать частицами, — яркое тому доказательство. Как уже отмечалось во Введении, в этом нет особого противоречия. Ведь у нас нет никаких веских оснований полагать, будто то, что мы наблюдаем в макромире, должно с точностью воспроизводиться на уровне микромира. И тем не менее дуальная природа элементарных частиц остается одним из самых непонятных и тревожащих аспектов квантовой механики для многих людей, и не будет преувеличением сказать, что все беды начались с Эрвина Шрёдингера.
http://pandia.ru/text/78/418/15321-3.php
http://elementy.ru/trefil/21/Uravnenie_Shryodingera