Ван дер Ваальса закон калькулятор
| Решите для | Уравнения |
|---|---|
| P | 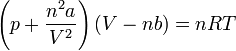 |
| T | 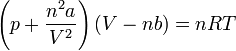 |
| n | 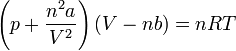 |
| V | 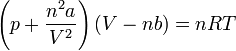 |
Ван дер Ваальса закон калькулятор представляет собой мощный онлайновый инструмент для решения задач с использованием Ван дер Ваальса закона уравнением. Выберите количество, чтобы решить для и одна из Ван дер Ваальса закона уравнениями в использовании. Форма для ввода всех известных газа и агрегатов будет представлена. Введите значение и нажмите вычисления, чтобы увидеть шаг за шагом Ван дер Ваальса закона раствором.
Feel free to ask for help with your Ван дер Ваальса закона problem in chemistry forum.
Van der Waals Calculator
Easily calculate the pressure, volume, temperature or quantity in moles of a gas using this Van der Waals equation calculator. Supports a variety of input metrics such as Celsius, Fahrenheit, Kelvin, Pascals, bars, atmospheres, and volume in both metric and imperial units cubed.
Related calculators
This is a gas law calculator which incorporates the van der Waals equation into one easy to use tool you can use as a:
- gas pressure calculator
- gas volume calculator
- gas quantity calculator
- gas temperature calculator
The van der Waals equation is a better approximation to a real gas than the ideal gas law (see «Applicability» below). To use the Van der Waals calculator, enter the three known measures and the two substance-specific constants to calculate the fourth measure. The calculator uses the combined gas law formula discussed below to perform the computations. The Van der Waals equation calculator also supports both imperial and metric units for volume and pressure and 5 different temperature scales: Kelvin, Celsius, Fahrenheit, Rankine and Reamur, both as input and as output.
The units supported by the gas law calculator for volume are: mm 3 , cm 3 , m 3 , ml, L (litre), gallons, fluid ounces, cubic inches, cubic feet and cubic yards. Units supported for pressure are Pascals, kiloPascals, MegaPascals, GigaPascals, milibars, bars, atmospheres, millimeters of Hg liquid, millimeters of H2O liquid, and pound-force per squared inches (psi).
The Van der Waals equation is an expansion of the ideal gas law formula used for ideal gas law calculation which accounts for the volume of real gas molecules and for the molecular attraction forces which make real gases more compressible than an ideal gas. This first is achieved by replacing V with (Vm — b) in the ideal gas formula where b is the volume occupied by one mole of the particular molecule (a.k.a. repulsion parameter) and Vm is the molar volume. The second is achieved by adding to the observed pressure a a / Vm 2 term in which a is a constant which depends on the particular gas and is sometimes referred to as an «attraction parameter».
The above substitutions in the PV = nRT formula lead to the formula (P + a / Vm 2 )(Vm — b) = RT which through simple transformation can be expressed in the more familiar form of the Van der Waals equation:
where P is the pressure in Pascals, V is the volume in m 3 , n is the quantity in moles, T is the absolute temperature in Kelvins and finally R is the universal gas constant, a is the aforementioned substance-specific constant. R is equivalent to the Boltzmann constant, but expressed in units of energy per temperature increment per mole (the pressure–volume product). In SI based units it is 8.3144598(48) kg⋅m 2 ⋅mol −1 ⋅K −1 ⋅s −2 . A mole is the amount of substance which contains as many elementary entities as there are atoms in 12 g of carbon-12.
This is the formula used in our Van de Waals equation calculator, so make sure you understand all inputs correctly.
Understanding the applicability of the formula will help you determine when using a Van der Waals calculator is appropriate. The van der Waals equation is considered reasonable for liquid and low-pressure gaseous states below the critical temperature of the gas or liquid in question. It is an even more significant improvement over the ideal gas law for temperatures above the critical (The critical temperature of a substance is such that at and above it vapor of the substance cannot be liquefied, regardless of the amount of pressure being applied).
The equation diverges from experimental behavior when the liquid phase and a gas phase would be in equilibrium (vapor–liquid equilibrium). Such «metastable» states are qualitatively (though likely not quantitatively) predicted by the van der Waals equation of state. Empirically-based corrections can be used such as the Maxwell’s correction, at the cost of simplicity. The van der Waals equation is still used in textbooks as a pedagogic tool for understanding vapor–liquid behavior and equations of state. Some other, more accurate equations of state such as the Redlich–Kwong and Peng–Robinson equation of state are simply modifications of the van der Waals equation.
[1] NIST Special Publication 330 (2008) — «The International System of Units (SI)», edited by Barry N.Taylor and Ambler Thompson, p. 52
[2] «The International System of Units» (SI) (2006, 8th ed.). Bureau international des poids et mesures pp. 142–143. ISBN 92-822-2213-6
Уравнение Ван-дер-Ваальса
Вы будете перенаправлены на Автор24
Что такое реальный газ
Реальным газом называют газ, между молекулами которого существуют заметные силы взаимодействия. В неидеальных, газах под высоким давлением, газах с большой плотностью взаимодействие молекул велико и его необходимо учитывать. Силы притяжения играют наиболее существенную роль на больших расстояниях между молекулами. Расстояние уменьшается, силы притяжения растут, но до определенного предела, затем они начинают уменьшаться и переходят в силы отталкивания. Притяжение и отталкивание молекул можно разделить и рассматривать и учитывать отдельно друг от друга.
Уравнение Ван-дер-Ваальса
Уравнение Ван-дер-Ваальса, описывающее состояние 1 моля реального газа, имеет вид:
где d- диаметр молекулы,
величина a вычисляется по формуле:
где $W_p\left(r\right)$- потенциальная энергия притяжения двух молекул. Необходимо заметить, что газовая постоянная имеет индивидуальное значение для каждого вещества. Она отличается от молярной газовой постоянной, причем она меньше, что говорит об объединении молекул вещества в комплексы около критического состояния. Вдали от критических состояний можно использовать универсальную газовую постоянную.
С увеличением объема роль поправок в уравнении (1) становится менее существенной. И в пределе уравнение (1) переходит в уравнение состояния идеального газа для 1 моля (4):
Уравнение (4) — уравнение Менделеева — Клайперона, где m- масса газа, $R=8,31\ \frac<Дж><моль\cdot К>$- универсальная газовая постоянная.
Это согласуется с тем фактом, что при уменьшении плотности реальные газы по своим свойствам приближаются к идеальным.
Уравнение (1) может быть записано в вириальной форме:
Для анализа изотерм уравнение (1) удобнее представить в виде:
Рассматриваемое уравнение может описывать и свойства жидкости, например плохую ее сжимаемость.
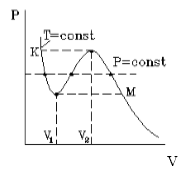
На рис.1 изображена изотерма Ван-дер-Ваальса для некоторого постоянного значения температуры T, построенная из соответствующего уравнения.
Такая зависимость на практике невозможна. Опыт показывает, что график должен иметь вид рис.2 то есть существуют области, в которых при изменении объема давление неизменно. В некоторых отрезках график изотермы параллелен оси V (рис 2). Это область фазового перехода. Жидкость и газ существую одновременно.
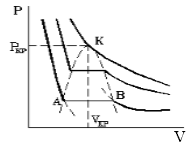
По мере увеличения температуры участок, отражающий состояние нахождения газа одновременно в двух фазах на графиках p(V), сужается и превращается в точку (рис. 2). Это особая точка К, в которой пропадает различие между жидкостью и паром. Это так называемая критическая точка.
Готовые работы на аналогичную тему
Итак, уравнение Ван-дер-Ваальса описывает поведение газов близких к реальным. Их можно применить к газообразной и жидкой фазам вещества. Эти уравнения отражают существование фазового перехода газ — жидкость. Показывают наличие критической точки перехода. Однако абсолютно точных количественных результатов расчеты, в которых используются вышеназванные уравнения, не дают.
Задание: Газ в количестве 1 моль находится в сосуде объемом V л при температуре $T_1$ давление газа $p_1$, а при $T_2$ давление газа $p_2$. Найти постоянные Ван-дер-Ваальса.
Запишем уравнение Ван-дер-Ваальса для одного моля реального газа для состояний 1 и 2:
Раскроем скобки в (1.1):
Вычтем $\left(1.4\right).\ из\ \left(1.3\right):$
Выразим a из (1.1):
Задание: Для реального газа, используя уравнение Ван-дер-Ваальса, получите уравнение адиабаты в параметрах V и T.
\[\delta Q=dU+\partial A=0\ \left(\ 2.1\right)\]
Так как процесс адиабатный, то он идет теплообмена. Перепишем уравнение (2.1) для ван-дер-ваальсовского газа, зная, что:
Из уравнения Ван-дер-Ваальса:
Подставим (2.5) в (2.4), разделим переменные:
Ответ: Уравнение адиабаты для заданного случая имеет вид: $<\left(V-b\right)>^<\frac<2>\nu >T=const.$
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 15 01 2022
http://www.gigacalculator.com/calculators/van-der-waals-equation-calculator.php
http://spravochnick.ru/fizika/molekulyarnaya_fizika/uravnenie_van-der-vaalsa/