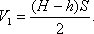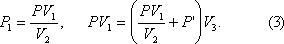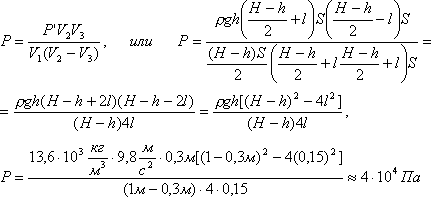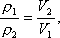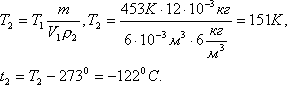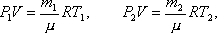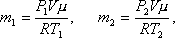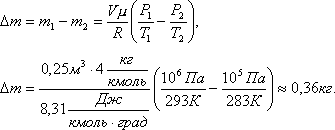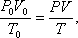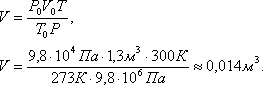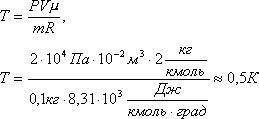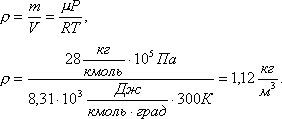Решение задач на уравнение клапейрона 10 класс
Репетитор
по физике
Репетитор
по алгебре
\( P \) — Давление газа (Паскали)
\( \nu \) — Количество вещества
\( R \) — Универсальная газовая посиоянная
\( T \) — Температура в Кельвинах
В баллоне находится газ под давлением \(P= 8,31 \cdot 10^6 \; Па \), температура газа \(T=300 К \).
Количество вещества газа \( \nu=100 Моль \).
Найти объем баллона
Универсальная газовая постоянная \( R=8,31 \frac<Дж> <Моль \cdot K>\)
Дать ответ в литрах.
Показать ответ Показать решение Видеорешение
Запишем уравнение Менделеева-Клапейрона :
Решение задач на уравнение клапейрона 10 класс
Если при сжатии объём идеального газа уменьшился в 2 раза, а давление газа увеличилось в 2 раза, то во сколько раз изменилась при этом абсолютная температура газа?
Согласно уравнению Клапейрона — Менделеева, давление, объём и абсолютная температура идеального газа связаны соотношением
Следовательно, при уменьшении объёма газа в 2 раза и увеличении его давления в 2 раза абсолютная температура не изменится.
Во сколько раз изменяется давление идеального газа при уменьшении объёма идеального газа в 2 раза и увеличении его абсолютной температуры в 4 раза?
Согласно уравнению Клапейрона — Менделеева, давление, объем и абсолютная температура идеального газа связаны соотношением
Следовательно, при уменьшении объёма газа в 2 раза и увеличении его абсолютной температуры в 4 раза давление газа увеличится в 8 раз.
а при решении можно было использовать формулу pV/T=const?
Да, можно и так сказать. Все газовые законы — следствия уравнения Клапейрона-Менделеева, написанный Вами закон выполняется для фиксированного количества вещества. Поскольку в задаче количество газа не изменяется, для решения можно использовать и это соотношение.
А почему в 8 раз, а не в 2?
Запишем уравнение состояние для обоих случаев: ,
.
Согласно условию, ,
.
При температуре и давлении
один моль идеального газа занимает объем
Во сколько раз больше объём двух молей газа при том же давлении
и температуре
?
Идеальный газ подчиняется уравнению состояния Клапейрона — Менделеева:
Таким образом, искомый объем V равен
Урок решения задач по теме «Уравнение Менделеева — Клапейрона»
Данный урок по физике для учащихся 10 класса по теме «Уравнение Менделеева — Клапейрона»
Просмотр содержимого документа
«Урок решения задач по теме «Уравнение Менделеева — Клапейрона»»
Тема урока: Решение задач на уравнение Менделеева-Клапейрона
Цели урока: продолжить формирование умения решать качественные, вычислительные и графические задачи на применение уравнения Менделеева-Клапейрона и газовых законов;
развить познавательный интерес к физике;
воспитывать активность и целеустремленность при решении задач.
Тип урока: закрепление материала
Форма урока: Урок – тренинг.
Актуализация знаний учащихся
1. Сформулируйте и экспериментально обоснуйте:
А) закон Бойля – Мариотта;
Б) закон Гей – Люссака
2. Постройте изотерму в осях координат: (P,V), (P, T), (V,T).
3, Постройте изобару в осях координат: (V,T); (P, T); (P, V)
4 Постройте изохору в осях координат: (P, T); (V, T); (V, P).
3. Решите качественные задачи.
А) Почему пузырьки воздуха, поднимаясь в воде вверх, увеличиваются в объеме?
Б) Плавательный пузырь выходит через рот наружу, если глубоководную рыбу вынуть из воды. Почему это происходит?
Г) Почему с горящих поленьев с треском слетают искры?
Д) Почему из стеклянной бутылки вылетает пробка, если в нее налить газированную воду, а потом поставить в теплое место?
4. Вычислительные задачи.
Задача 1. При сжатии газа его объем уменьшился на 2 л, а давление увеличилось в 2 раза. Найти первоначальный объем газа V1.
Обозначим ΔV изменение объема газа, P1 и P2 – давления газа до и после сжатия.
Решение. Судя по условию задачи, здесь процесс изотермический. Правда следовало бы добавить, что процесс сжатия происходит медленно, потому что, если бы он происходил быстро, то это был уже адиабатный процесс, при котором температура газа тоже меняется. Но, как правило, при условии задач на газовые процессы об этом упомянуть забывают, поэтому мы и обратили на этот момент внимание.
Произведем вычисления V1= 2·2л=4л
Задача 2. В узкой откачанной и запаянной с двух концов горизонтальной трубке посредине находится столбик ртути длиной 0,3 м. Если трубку поставить вертикально, столбик ртути сместится на 15 см. Определить давление в трубке до того как из нее откачали воздух, если ее длина 1м, а плотность ртути13,6·10 3 кг/м 3 .
Решение. По условию задачи температура газа остается постоянной, поэтому при решении задачи можно применить закон Бойля-Мариотта. Состояние воздуха в трубке в горизонтальном положении определялось параметрами: объемом V1 и давлением P. Выразим объем через поперечное сечение трубки S и высоту воздушного столбика 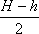
При вертикальном положении трубки состояние газа в верхней части трубки определялось параметрами: объемом 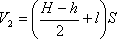
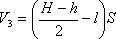
Запишем закон Бойля-Мариотта для состояния газа в верхней части трубки
и для нижней части трубки
Выражение P1, полученное из (1), подставим в (2)
В равенство (3) подставим значения
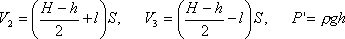
Задача 3. Газ массой 12·10 -3 кг занимает объем 6·10 -3 м 3 при температуре 180 0 С. При какой температуре плотность этого газа будет равна 6 кг/м 3 .
Решение: Плотность газа при постоянном давлении и массе обратно пропорциональна объему, то есть
но при постоянном давлении объем прямо пропорционален абсолютной температуре 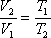

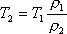
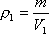
Задача 4. Определить на сколько изменилась масса гелия, находящегося в баллоне объемом 0,25 м 3 под давлением 10 6 Па при температуре 20 0 С, если из баллона была выпущена часть массы газа, после чего давление понизилось до 10 5 Па, а температура уменьшилась до 10 0 С.
Решение. До того как часть газа была выпущена из баллона его состояние определялось такими параметрами: давление Р1, объем V, масса m1, температура Т1. После того как часть газа была выпущена из баллона, состояние газа стало определяться параметрами: Р2, V, m2, T2.Запишем уравнение Менделеева-Клапейрона для первого и второго состояния газа
где V – объем газа, который по условию задачи остается неизменным; μ – молекулярный вес гелия. Выразим из этих уравнений m1 и m2 и найдем их разность Δm
Задача 5. Определить объем баллона со сжатым углекислым газом, находящимся под давлением в 100 атмосфер при температуре 27 0 С, если при нормальных условиях то же количество углекислого газа занимает объем 1,3 м 3 .
Решение. При нормальных условиях состояние газа определяется параметрами: Т0, P0, V0. При данных условиях – параметрами Т, P, V. Так как масса газа не изменялась, то для решения задачи можно воспользоваться уравнением объединенного газового закона:
Задача 6. При какой температуре находилось 100 г водорода в баллоне объемом 10 л, если давление при этом было 2 . 10 4 Па?
Решение. Из уравнения Менделеева-Клапейрона PV= m /µ·RT находим температуру:
Задача 7. Со дна водоема всплывает пузырек воздуха. На глубине 6 м он имел объем 10 мм³. Найти чему будет равен объем пузырька около поверхности воды.
Решение. P₁ V₁ = P₂ V₂; P₁ = ρ·g·h + P₀; P₂ = P₀; где Р₀ – атмосферное давление.
(ρ g h + P₀)V₁ = P₀V₂; V₂ = (ρ g h + P₀) V₁/ P₀; V₂ = 16 (мм³)
Задача 1. Определить плотность азота при температуре 27 0 С и давлении 760 мм рт. ст.
Решение. Из уравнения Менделеева-Клапейрона найдем плотность азота PV= m /µ·RT откуда
Ответ: 1,12 кг/м 3 .
Задача 2.. Найдите первоначальный объем, если давление газа увеличилось в 1,5 раза, а объем его уменьшился при этом на 30 мм.
Решение. P₁V₁ = P₂V₂; ΔV = V₁ – V₂; V₂ = V₁ – ΔV; P ₁V₁ = P₂(V₁ – ΔV); V₁ (P₂ – P₁) = P₂·ΔV;
http://phys-ege.sdamgia.ru/test?theme=353
http://multiurok.ru/files/urok-rieshieniia-zadach-po-tiemie-uravnieniie-mien.html