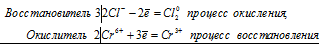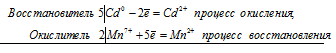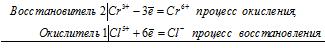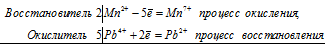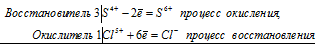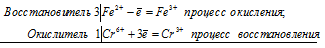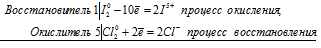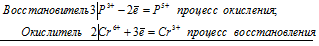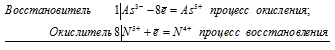Как решать задачи С1 (30) на ЕГЭ по химии.
Задача №30 на ЕГЭ по химии посвящена теме «Окислительно — восстановительные реакции». Ранее задание этого типа входило в вариант ЕГЭ под номером С1.
Смысл задания 30: необходимо расставить коэффициенты в уравнении реакции методом электронного баланса. С 2018 года само уравнение не приводится в условии задачи. Дается лишь список веществ, которые могли бы участвовать в окислительно-восстановительной реакции. Необходимо выбрать нужные соединения, самостоятельно составить уравнение ОВР и расставить коэффициенты методом электронного баланса.
Полное решение задачи оценивается в 2 балла.
Первый шаг : вспоминаем степени окисления
Мы должны начать с понятия степени окисления элемента . Если вы еще незнакомы с этим термином, обратитесь к разделу «Степень окисления» в справочнике по химии. Вы должны научиться уверенно определять степени окисления всех элементов в неорганических соединениях и даже в простейших органических веществах. Без 100%-ного понимания данной темы двигаться дальше бессмысленно.
Шаг второй : окислители и восстановители. Окислительно — восстановительные реакции
Хочу напомнить, что все химические реакции в природе можно разделить на два типа: окислительно — восстановительные и протекающие без изменения степеней окисления.
В ходе ОВР (именно такое сокращение мы будем использовать далее для окислительно — восстановительных реакций) некоторые элементы меняют свои степени окисления.
Пример 1 . Рассмотрим реакцию серы с фтором:
Расставьте самостоятельно степени окисления всех элементов. Мы видим, что степень окисления серы повышается (от 0 до +6), а степень окисления фтора понижается (от 0 до -1). Вывод: S — восстановитель, F 2 — окислитель. В ходе процесса сера окисляется, а фтор — восстанавливается.
Пример 2 . Обсудим реакцию оксида марганца (IV) с соляной кислотой:
MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O.
В ходе реакции степень окисления марганца понижается (от +4 до +2), а степень окисления хлора повышается (от -1 до 0). Вывод: марганец (в составе MnO 2 ) — окислитель, хлор (в составе HCl — восстановитель). Хлор окисляется, марганец восстанавливается.
Обратите внимание: в последнем примере не все атомы хлора поменяли степень окисления. Это никак не повлияло на наши выводы.
Пример 3 . Термическое разложение бихромата аммония:
(NH 4 ) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 4H 2 O.
Мы видим, что и окислитель, и восстановитель находятся в составе одной «молекулы»: хром меняет степень окисления от +6 до +3 (т. е., является окислителем), а азот — от -3 до 0 (следовательно, азот — восстановитель).
Пример 4 . Взаимодействие диоксида азота с водным раствором щелочи:
2NO 2 + 2NaOH = NaNO 3 + NaNO 2 + H 2 O.
Расставив степени окисления (надеюсь, вы делаете это без труда!), мы обнаруживаем странную картину: меняется степень окисления лишь одного элемента — азота. Часть атомов N повышают свою степень окисления (от +4 до +5), часть — понижают (от +4 до +3). В действительности, ничего странного в этом нет! В данном процессе N(+4) является одновременно и окислителем, и восстановителем.
Поговорим немного о классификации окислительно-восстановительных реакций. Напомню, что все ОВР делятся на три типа:
- 1) межмолекулярные ОВР (окислитель и восстановитель находятся в составе разных молекул);
- 2) внутримолекулярные ОВР (окислитель и восстановитель находятся в одной молекуле);
- 3) реакции диспропорционирования (окислитель и восстановитель — это атомы одного элемента с одинаковой начальной степенью окисления в составе одной молекулы).
Думаю, что, опираясь на эти определения, вы без труда поймете, что реакции из примеров 1 и 2 относятся к межмолекулярным ОВР, разложение бихромата аммония — пример внутримолекулярной ОВР, а взаимодействие NO 2 со щелочью — пример реакции диспропорционирования.
Шаг третий : начинаем осваивать метод электронного баланса
Чтобы проверить, насколько хорошо вы усвоили предыдущий материал, задам вам простой вопрос: «Можно ли привести пример реакции, в которой происходит окисление, но нет восстановления, или, наоборот, присутствует окисление, но нет восстановления?»
Правильный ответ: «Нет, нельзя!»
Действительно, пусть в ходе реакции степень окисления элемента Х повышается. Это означает, что Х отдает электроны . Но кому? Ведь электроны не могут просто испариться, исчезнуть без следа! Есть какой-то другой элемент Y, атомы которого будут принимать эти электроны. Электроны имеют отрицательный заряд, следовательно, степень окисления Y будет понижаться.
Вывод: если есть восстановитель Х, то обязательно будет и окислитель Y! Более того, число электронов, отданных одним элементом, будет в точности равно числу электронов, принятых другим элементом.
Именно на этом факте и основан метод электронного баланса , используемый в задаче С1.
Начнем осваивать этот метод на примерах.
Пример 4 . Расставьте коэффициенты в уравнении реакции
С + HNO 3 = CO 2 + NO 2 + H 2 O
методом электронного баланса.
Решение . Начнем с определения степеней окисления (сделайте это самостоятельно!). Видим, что в ходе процесса два элемента меняют степени окисления: С (от 0 до +4) и N (от +5 до +4).
Очевидно, что углерод является восстановителем (окисляется), а азот (+5) (в составе азотной кислоты) является окислителем (восстанавливается). Кстати, если вы правильно определили окислитель и в-тель, вам уже гарантирован 1 балл за задачу N 30!
Теперь начинается самое интересное. Напишем т. н. полуреакции окисления и восстановления:
| C(0) — 4e | = | C(+4) | (процесс окисления, отдача 4 электронов) |
| N(+5) + 1e | = | N(+4) | (процесс восстановления, присоединение 1 электрона) |
Атом углерода расстается с 4 электронами, атом азота — принимает 1 е. Число отданных электронов не равно числу принятых. Это плохо! Необходимо исправить ситуацию.
«Домножим» первую полуреакицию на 1, а вторую — на 4.
| C(0) — 4e | = | C(+4) | (1) |
| N(+5) + 1e | = | N(+4) | (4) |
Вот теперь все отлично: на один атом углерода (отдающий 4 е) приходится 4 атома азота (каждый из которых принимает по одному е). Число отданных электронов равно числу принятых!
То, что мы сейчас написали, собственно, и называется электронным балансом . Если на реальном ЕГЭ по химии вы напишите этот баланс правильно, вам гарантирован еще 1 балл за задачу С1.
Последний этап: осталось перенести полученные коэффициенты в уравнение реакции. Перед формулами С и СО 2 ничего не меняем (т. к. коэффициент 1 в уравнении не ставится), перед формулами HNO 3 и NO 2 ставим четверку (т. к. число атомов азота в левой и правой частях уравнения должно быть равно 4):
С + 4HNO 3 = CO 2 + 4NO 2 + H 2 O.
Осталось сделать последнюю проверку: мы видим, что число атомов азота одинаково слева и справа, то же касается атомов С, а вот с водородом и кислородом пока проблемы. Но все легко исправить: ставим коэффициент 2 перед формулой Н 2 О и получаем окончательный ответ:
С + 4HNO 3 = CO 2 + 4NO 2 + 2H 2 O.
Вот и все! Задача решена, коэффициенты расставлены, а мы получили еще один балл за правильное уравнение. Итог: 3 балла за идеально решенную задачу 30. С чем вас и поздравляю!
Пример 5 . Расставьте коэффициенты в уравнении реакции
NaI + H 2 SO 4 = Na 2 SO 4 + H 2 S + I 2 + H 2 O
методом электронного баланса.
Решение . Расставьте самостоятельно степени окисления всех элементов. Видим, что в ходе процесса два элемента меняют степени окисления: S (от +6 до -2) и I (от -1 до 0).
Сера (+6) (в составе серной кислоты) является окислителем, а йод (-1) в составе NaI — восстановителем. В ходе реакции I(-1) окисляется, S(+6) — восстанавливается.
Записываем полуреакции окисления и восстановления:
| 2I(-1) — 2e | = | I 2 (0) | (процесс окисления, отдача 2 электронов) |
| S(+6) + 8e | = | S(-2) | (процесс восстановления, присоединение 8 электронов) |
Обратите внимание на важный момент: в молекуле иода два атома. В реакции не может участвовать «половина» молекулы, поэтому в соответствующем уравнении мы пишем не I, а именно I 2 .
«Домножим» первую полуреакицию на 4, а вторую — на 1.
| 2I(-1) — 2e | = | I 2 (0) | (4) |
| S(+6) + 8e | = | S(-2) | (1) |
Баланс построен, на 8 отданных электронов приходится 8 принятых.
Переносим коэффициенты в уравнение реакции. Перед формулой I 2 ставим 4, перед формулой H 2 S — подразумеваем коэффициент 1 — это, думаю, очевидно.
NaI + H 2 SO 4 = Na 2 SO 4 + H 2 S + 4I 2 + H 2 O
А вот дальше могут возникнуть вопросы. Во-первых, неверно будет ставить четверку перед формулой NaI. Ведь уже в самой полуреакции окисления перед символом I стоит коэффициент 2. Следовательно, в левую часть уравнения следует записать не 4, а 8!
8NaI + H 2 SO 4 = Na 2 SO 4 + H 2 S + 4I 2 + H 2 O
Во-вторых, часто в такой ситуации выпускники ставят коэффициент 1 перед формулой серной кислоты. Рассуждают так: «В полуреакции восстановления найден коэффициент 1, этот коэффициент относится к S, значит, перед формулой серной кислоты должна стоять единица».
Эти рассуждения ошибочны! Не все атомы серы меняли степень окисления, часть из них (в составе Na 2 SO 4 ) сохранила степень окисления +6. Эти атомы не учтены в электронном балансе и коэффициент 1 не имеет к ним никакого отношения.
Все это, однако, не помешает нам довести решение до конца. Важно лишь понимать, что в дальнейших рассуждениях мы опираемся уже не на электронный баланс, а просто на здравый смысл. Итак, напоминаю, что коэффициенты перед H 2 S, NaI и I 2 «заморожены», их менять нельзя. А вот остальные — можно и нужно.
В левой части уравнения находится 8 атомов натрия (в составе NaI), в правой — пока всего 2 атома. Ставим перед формулой сульфата натрия коэффициент 4:
8NaI + H 2 SO 4 = 4Na 2 SO 4 + H 2 S + 4I 2 + H 2 O.
Только теперь можно уравнивать количество атомов S. Справа их 5 шт, следовательно, перед формулой серной кислоты нужно поставить коэффициент 5:
8NaI + 5H 2 SO 4 = 4Na 2 SO 4 + H 2 S + 4I 2 + H 2 O.
Последняя проблема: водород и кислород. Ну, думаю, вы и сами догадались, что не хватает коэффициента 4 перед формулой воды в правой части:
8NaI + 5H 2 SO 4 = 4Na 2 SO 4 + H 2 S + 4I 2 + 4H 2 O.
Еще раз тщательно все проверяем. Да, все правильно! Задача решена, мы получили свои законные 3 балла.
Итак, в примерах 4 и 5 мы подробно обсудили алгоритм решения задачи C1 (30) . В вашем решении реальной экзаменационной задачи обязательно должны присутствовать следующие моменты:
- 1) степени окисления ВСЕХ элементов;
- 2) указание на окислитель и восстановитель;
- 3) схема электронного баланса;
- 4) окончательное уравнение реакции с коэффициентами.
Несколько комментариев по поводу алгоритма.
1. Должны быть указаны степени окисления всех элементов в левой и правой частях уравнения. Всех, а не только окислителя и восстановителя!
2. Окислитель и восстановитель должны быть обозначены четко и ясно: элемент Х (+. ) в составе . является окислителем, восстанавливается; элемент Y(. ) в составе . является восстановителем, окисляется. Надпись мелким подчерком «ок. в-ся» под формулой серной кислоты не все смогут расшифровать как «сера (+6) в составе серной кислоты — окислитель, восстанавливается».
Не жалейте букв! Вы же не объявление в газету даете: «Сд. комн. со вс. уд.»
3. Схема электронного баланса — это просто схема: две полуреакции и соответствующие коэффициенты.
4. Подробные объяснения, как именно вы расставляли коэффициенты в уравнении, на ЕГЭ никому не нужны. Нужно лишь, чтобы все цифры были верны, а сама запись сделана разборчивым почерком. Обязательно несколько раз проверьте себя!
И еще раз по поводу оценивания задачи C-1 на ЕГЭ по химии:
- 1) выбор правильных веществ из списка, правильное уравнение реакции — 1 балл;
- 2) схема электронного баланса с верными коэффициентами — 1 балл.
Итог: 2 балла за полное решение задачи N 30.
Я уверен, что вы поняли, в чем заключается идея метода электронного баланса. Поняли в основных чертах, как строится решение примера N 30. В принципе, все не так уж и сложно!
К сожалению, на реальном ЕГЭ по химии возникает следующая проблема: само уравнение реакции не приводится. Будет предложен список веществ; вам необходимо выбрать из этого списка соединения, между которыми может протекать ОВР, и самостоятельно составить уравнение реакции.
Это может оказаться весьма сложным. Универсальных рецептов написания уравнений не существует. В следующей части мы обсудим этот вопрос подробнее и рассмотрим более сложные примеры.
Задачи к разделу Окислительно-восстановительные реакции
В данном разделе собраны задачи по теме Окислительно-восстановительные реакции. Приведены примеры задач на составление уравнений реакций, нахождение окислительно-восстановительного потенциал, и константы равновесия ОВР и другие.
Задача 1. Какие соединения и простые вещества могут проявлять только окислительные свойства? Выберите такие вещества из предложенного перечня: NH3, CO, SO2, K2MnO4, Сl2, HNO2. Составьте уравнение электронного баланса, расставьте коэффициенты в уравнении реакции:
Решение.
Простые вещества, атомы которых не могут отдать электрон, а могут только присоединить его в реакциях являются только окислителями. Из простых веществ только окислителем может быть фтор F2, атомы которого имеют наивысшую электроотрицательность. В сложных соединениях – если атом, входящий в состав этого соединения (и меняющий степень окисления) находится в своей наивысшей степени окисления, то данное соединение будет обладать только окислительными свойствами.
Из предложенного списка соединений, нет веществ, которые обладали бы только окислительными свойствами, т.к. все они находятся в промежуточной степени окисления.
Наиболее сильный окислитель из них – Cl2, но в реакциях с более электроотрицательными атомами будет проявлять восстановительные свойства.
Составим электронные уравнения:
N +5 +3e — = N +2 | 8 окислитель
S -2 — 8e — = S +6 | 3 восстановитель
Сложим два уравнения
8N +5 +3S -2 — = 8N +2 + 3S +6
Подставим коэффициенты в молекулярное уравнение:
Задача 2. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? Составьте уравнения реакций HNO2: а) с бромной водой; б) с HI; в) с KMnO4. Какую функцию выполняет азотистая кислота в этих реакциях?
Решение.
HN +3 O2 — Степень окисления азота в азотистой кислоте равна +3 (промежуточная степень окисления). Азот в этой степени окисления может как принимать, так и отдавать электроны, т.е. может являться как окислителем, так восстановителем.
N +3 – 2 e = N +5 | 1 восстановитель
Br2 0 + 2 e = 2Br — | 1 окислитель
N +3 + Br2 = N +5 + 2Br —
б) HNO2 + 2HI = I2 + 2NO + 2H2O
N +3 + e = N +2 | 1 окислитель
2I — — 2 e = I 2 | 1 восстановитель
N +3 + 2I — = N +2 + I2
N +3 – 2 e = N +5 | 5 восстановитель
Mn +7 + 5 e = Mn +2 | 2 окислитель
5N +3 + 2Mn +7 = 5N +5 + 2Mn +2
Задача 3. Определите степени окисления всех компонентов, входящих в состав следующих соединений: HСl, Cl2, HClO2 , HClO3 , Cl2O7 . Какие из веществ являются только окислителями, только восстановителями, и окислителями и восстановителями? Расставьте коэффициенты в уравнении реакции:
КСlO3 → КС1 + КСlO4.
Укажите окислитель и восстановитель.
Решение.
Хлор может проявлять степени окисления от -1 до +7.
Соединения, содержащие хлор в его высшей степени окисления, могут быть только окислителями, т.е. могут только принимать электроны.
Соединения, содержащие хлор в его низшей степени окисления, могут быть только восстановителями, т.е. могут только отдавать электроны.
Соединения, содержащие хлор в его промежуточной степени окисления, могут быть как восстановителями, так и окислителями, т.е. могут отдавать, так и принимать электроны.
H +1 Сl -1 , Cl 0 2, H +1 Cl +3 O2 -2 , H +1 Cl +5 O3 -2 , Cl2 +7 O7 -2
Таким образом, в данном ряду
Только окислитель — Cl2O7
Только восстановитель – HСl
Могут быть как окислителем, так и восстановителем — Cl2, HClO2 , HClO3
КСlO3 → КС1 + КСlO4.
Составим электронные уравнения
Cl +5 +6e — = Cl — | 2 | 1 окислитель
Cl +5 -2e — = Cl +7 | 6 | 3 восстановитель
Расставим коэффициенты
4Cl +5 = Cl — + 3Cl +7
Задача 4. Какие из приведенных реакций являются внутримолекулярными? Расставьте коэффициенты в уравнениях реакций. Укажите восстановитель, окислитель.
Решение.
В реакциях внутримолекулярного окисления-восстановления перемещение электронов происходит внутри одного соединения, т.е. и окислитель и восстановитель входят в состав одного и того же сложного вещества (молекулы)
а) 2KNO3 = 2KNO2 + O2 — внутримолекулярная ОВР
N +5 +2e — = N +3 | 2 окислитель
2 O -2 -4 e — = O2 0 | 1 восстановитель
2N +5 + 2O -2 = 2N +3 + O2 0
б) 3Mq + N2 = Mq3N2 — межмолекулярная ОВР
N2 +6e — = 2N -3 | 2 | 1 окислитель
Mg 0 -2 e — = Mg +2 | 6 | 3 восстановитель
N2 + 3Mg 0 = 2N -3 + 3Mg +2
в) 2KClO3 = 2KCl + 3O2 — внутримолекулярная ОВР
Cl +5 +6e — = Cl — | 4 | 2 окислитель
2 O -2 -4 e — = O2 0 | 6 | 3 восстановитель
2Cl +5 + 6O -2 = 2Cl — + 3O2 0
Задача 5. Какие ОВР относятся к реакциям диспропорционирования? Расставьте коэффициенты в реакциях:
а) Cl2 + KOH = KCl + KClO3 + H2O;
б) KClO3 = KCl + KClO4 .
Решение.
В реакциях диспропорционирования окислителем и восстановителем являются атомы одного и того же элемента в одинаковой степени окисления (обязательно промежуточной). В результате образуются новые соединения, в которых атомы этого элемента обладают различной степенью окисления.
а) 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O;
Cl2 0 +2e — = 2Cl — | 10| 5 окислитель
Cl2 0 -10e — = 2Cl +5 | 2 | 1 восстановитель
5Cl2 0 + Cl2 0 = 10Cl — + 2Cl +5
3Cl2 0 = 5Cl — + Cl +5
б) 4KClO3 = KCl + 3KClO4
Cl +5 +6e — = Cl — | 2 | 1 окислитель
Cl +5 -2 e — = Cl +7 | 6 | 3 восстановитель
4Cl +5 = Cl — + 3Cl +7
Задача 6. Составьте электронные уравнения и подберите коэффициенты ионно-электронным методом в реакции
Решение.
MnO4 — + 8H + +5e — = Mn 2+ + 4H2O | 2 окислитель
NO2 — + H2O — 2e — = NO3 — + 2H + | 5 восстановитель
Сложим две полуреакции, умножив каждую на соответствующий коэффициент:
После сокращения идентичных членов, получаем ионное уравнение:
Подставим коэффициенты в молекулярное уравнение и уравняем его правую и левую части:
Задача 7. Определите методом электронного баланса коэффициенты в уравнениях окислительно-восстановительных реакций:
Решение.
Составим электронные уравнения
Zn 0 – 2 e = Zn 2+ | 8 | 4 | восстановитель
N +5 + 8 e = N 3- | 2 | 1 | окислитель
4Zn 0 + N +5 = 4Zn 2+ + N 3-
Составим электронные уравнения
Zn 0 – 2 e = Zn 2+ | 2 | 1 восстановитель
S +6 + 2 e = S +4 | 2 | 1 окислитель
Zn 0 + S +6 = Zn 2+ + S +4
Задача 8. Можно ли в качестве окислителя в кислой среде использовать K2Cr2O7 в следующих процессах при стандартных условиях:
а) 2F — -2e — = F2, E 0 = 2,85 В
б) 2Сl — -2e — = Cl2, E 0 = 1,36 В
в) 2Br — -2e — = Br2, E 0 = 1,06 В
г) 2I — -2e — = I2, E 0 = 0,54 В
Стандартный окислительно-восстановительный потенциал системы
Cr2O7 2- + 14H + + 6e — = 2Cr 3+ + 7H2O равен E 0 =1,33 В
Решение.
Для определения возможности протекания ОВР в прямом направлении необходимо найти ЭДС гальванического элемента:
ЭДС = Е 0 ок — Е 0 восст
Если найденная величина ЭДС > 0, то данная реакция возможна.
Итак, определим, можно ли K2Cr2O7 использовать в качестве окислителя в следующих гальванических элементах:
Таким образом, в качестве окислителя дихромат калия можно использовать только для процессов:
2Br — -2e — = Br2 и 2I — -2e — = I
Задача 9. Вычислите окислительно-восстановительный потенциал для системы
MnO4 — + 8H + +5e — = Mn 2+ + 4H2O
Если С(MnO4 — )=10 -5 М, С(Mn 2+ )=10 -2 М, С(H + )=0,2 М.
Решение.
Окислительно-восстановительный потенциал рассчитывают по уравнению Нернста:
В приведенной системе в окисленной форме находятся MnO4 — и H + , а в восстановленной форме — Mn 2+ , поэтому:
E = 1,51 + (0,059/5)lg(10 -5 *0,2/10 -2 ) = 1,46 В
Задача 10. Рассчитайте для стандартных условий константу равновесия окислительно-восстановительной реакции:
Решение.
Константа равновесия K окислительно-восстановительной реакции связана с окислительно-восстановительными потенциалами соотношением:
lgK = (E1 0 -E2 0 )n/0,059
Определим, какие ионы в данной реакции являются окислителем и восстановителем:
MnO4 — + 8H + +5e — = Mn 2+ + 4H2O | 2 окислитель
Br — + H2O — 2e — = HBrO + H + | 5 восстановитель
Общее число электронов, принимающих участие в ОВР n = 10
E1 0 (окислителя) = 1,51 В
E2 0 (восстановителя) = 1,33 В
Подставим данные в соотношение для К:
lgK = (1,51 — 1,33 )10/0,059
K = 3,22*10 30
Примеры ОВР с ответами приведены также в разделе тест Окислительно-восстановительные реакции
Правильное составление электронных уравнений реакций
Решение задач на составлении электронных уравнений химических реакций
Задание 236.
Реакции выражаются схемами:
HCl + CrO3 ⇔ Cl2 + CrCl3 + H2O;
Cd + KMnO4 + H2SO4 ⇔ CdSO4 + MnSO4 + K2SO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
а) HCl + CrO 3 ⇔ Cl2 + CrCl 3 + H 2 O
2Cr 6+ + 6Cl — = 2Cr 3+ + 3Cl2 0
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: HCl – восстановитель, CrO3 – окислитель; HCl окисляется до Сl2, CrO3 – восстанавливается до CrCl3.
5Сd 0 + 2Mn 7+ = Cd 2+ + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Cd – восстановитель, KMnO 4 – окислитель; Cd окисляется до CdSO 4, KMnO 4 – восстанавливается до MnSO 4.
Задание 237.
Реакции выражаются схемами:
Cr2O3 + KClO3 + KOH ⇔ K2CrO4 + KCl + H2O;
MnSO4 + PbO2 + HNO3 ⇔ HMnO4 + Pb(NO3)2 + PbSO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Cr 3+ + Cl 5+ = 2Cr 6+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Cr2O3 – восстановитель, KClO3 – окислитель; Cr2O3 окисляется до K2CrO4, KClO3 – восстанавливается до KCl.
5Pb 4+ + 2Mn 2+ = 5Pb 2+ + 2Mn 7+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 2, получаем коэффициент 5 для окислителя и продукта его восстановления, а при делении 10 на 5 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: PbO2 – восстановитель, MnSO4 – окислитель; PbO2 окисляется до Pb(NO3)2, MnSO4 – восстанавливается до HMnO4.
Задание 238.
Реакции выражаются схемами:
H2SO3 + HClO3 ⇔ H2SO4 + HCl;
FeSO4 + K2Cr2O7 + H2SO4 ⇔ Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
3S 4+ + Cl 5+ = 3S 6+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: H2SO3 – восстановитель, HClO3 – окислитель; H2SO3 окисляется до H2SO4, HClO3 – восстанавливается до HCl.
3Fe 2+ + Cr 6+ = 3Fe 3+ + Cr 3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов три. Разделив это число на 3, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 3 на 1 получаем коэффициент 3 для восстановителя и продукта его окисления. Учитывая, что в схеме реакции указаны вещества, содержащие железо и хром с двумя атомами в молекулах Fe2(SO4)3 и Cr2(SO4)3], умножим коэффициенты при окислителе и восстановителе на 2, получим молекулярное уравнение реакции:
Задание 239.
Реакции выражаются схемами:
I2 + Cl2 + H2O ⇔ HClO3 + HCl;
K2Cr2O7 + H3PO3 + H2SO4 ⇔ Cr2(SO4)3 + H3PO4 + K2SO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
I 2 0 + 5Cl2 0 ⇔ 2I — + 10Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 2, получаем коэффициент 5 для окислителя и продукта его восстановления, а при делении 10 на 10 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: I2 – восстановитель, Cl2 – окислитель; I2 окисляется до HIO3, Cl2 – восстанавливается до HCl.
3P 3+ + 2Cr 6+ = 3P 5+ + 2Cr 3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: H 3PO 3 – восстановитель, K 2Cr 2O 7 – окислитель; H 3PO 3 окисляется до H 3PO 4, K 2Cr 2O 7 – восстанавливается до Cr 2(SO 4) 3.
Задание 240.
Могут ли происходить окислительно-восстановительные реакции между веществами: а) РН3 и НВг; б) K2Cr2O7 и Н3PO3; в) HNO3 и Н2S? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
АsH3 + НNO3 ⇔ Н3AsO4 + NO2 + Н2O
Решение:
а) Степень окисления в РH3 n(Р) = -3 (низшая), в HBr n(Br) = -1 (низшая). Так как и фосфор, и бром находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут;
б) в K2Cr2O7 n(Сr) = +6 (высшая); в Н3PO3 n(Р) = +5 (высшая). Так как и хром, и фосфор находятся в своей высшей степени окисления, то оба вещества проявляют только окислительные свойства и взаимодействовать друг с другом не могут;
в) в HNO3 n(N) = +5 (высшая); в H2S n(S) = -2 (низшая). Следовательно, взаимодействие этих веществ возможно, причём HNO3 является окислителем, а H2S – восстановителем.
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
As 3- + 8N 5+ = As 5+ + 8N 4+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 1, получаем коэффициент 8 для окислителя и продукта его восстановления, а при делении 8 на 8 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
http://zadachi-po-khimii.ru/obshaya-himiya/zadachi-k-razdelu-okislitelno-vosstanovitelnye-reakcii.html
http://buzani.ru/zadachi/khimiya-shimanovich/937-sostavlenie-elektronnykh-uravnenij-reaktsij-zadaniya