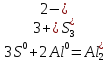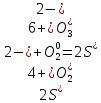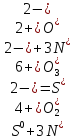Алгоритм решения заданий ОГЭ по химии.
Данный материал могут использовать учителя и учащиеся. В алгоритме указаны номера заданий, соответствующие кодификатору ОГЭ, даны примеры заданий и их полный разбор. Этот материал поможет учителям в организации эффективного повторения и обобщения изученного материала по химии за 8, 9 классы, устранить пробелы в знаниях и умениях обучающихся.
Просмотр содержимого документа
«Алгоритм решения заданий ОГЭ по химии.»
Алгоритм решения ОГЭ (Химия)
№ задания, тема, нужно знать, шпаргалка на экзамене
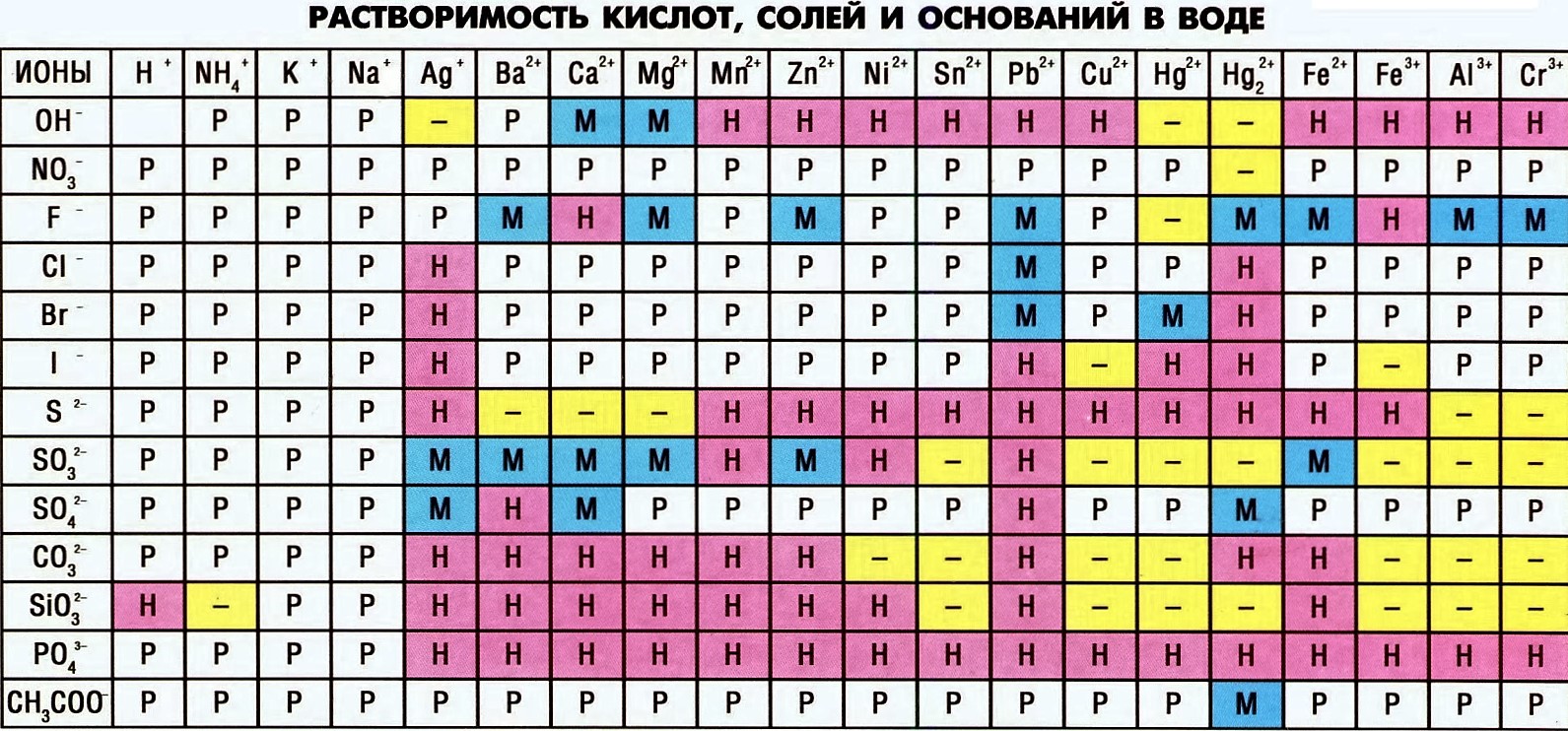
(на экзамене из шпаргалок будут только: таблица Менделеева, таблица растворимости, ряд электрохимических напряжений металлов)
Подробный разбор на примере
(ВНИМАТЕЛЬНО читать задание)
Тема: Строение атома и электронные оболочки
Нужно знать: заряд ядра, знание определений протонов, нейтронов и электронов и как их определить; определение числа энергетических уровней; распределение электронов по энергетическим уровням; электронное строение атома, валентность
Шпаргалка на экзамене: таблица Менделеева
Атомы углерода и кремния имеют одинаковое
1. число нейтронов в ядре атома
2. значение относительной атомной массы
3. число протонов в ядре атома
4. число валентных электронов
Берем таблицу Менделеева
Определяем местоположение атомов углерода и кремния в таблице Углерод – находится в 4 группе, во 2 периоде
Кремний – находится в 4 группе, в 3 периоде
Определяем заряд ядра, число электронов, протонов, нейтронов, относительную атомную массу, количество энергетических уровней, количество валентных электронов и валентность атома
Углерод – заряд ядра +6, 6 электронов, 6 протонов, 16-6=6 нейтронов, атомная масса = 12, 2 энергетических уровня, 4 валентных электрона, валентность 4.
Кремний – заряд ядра +14, 14 электронов, 14 протонов, 28-14=14 нейтронов, атомная масса = 28, 3 энергетических уровня, 4 валентных электрона, валентность 4.
Сравниваем оба элемента по ответам, представленным в задании
У атомов углерода и кремния одинаковое число валентных электронов. Число нейтронов и протонов разные, как и разное значение относительной атомной массы.
Выбираем правильный ответ: 4
Тема: Закономерности в таблице Д.И. Менделеева
Нужно знать: изменение свойств элементов в группе и периоде: электроотрицательность, радиус ядра, металлические и неметаллические свойства, изменение кислотности и основности элементов, изменение валености. Перекликается с заданием №1.
Шпаргалка на экзамене: таблица Менделеева
В ряду химичeских элементов Si – P – S
Увеличивается число валентных электронов в атомах
Уменьшается число валентных электронов в атомах
Уменьшается число протонов в ядрах атомов
Увеличиваются радиусы атомов
Берем таблицу Менделеева
Определяем местоположение атомов кремния, фосфора и серы в таблице
Кремний – находится в 4 группе, в 3 периоде
Фосфор – находится в 5 группе, в 3 периоде
Сера – находится в 6 группе в 3 периоде
Определяем свойства, которые изменяются в представленном ряду
От кремния к сере изменяются: заряд ядра атома – увеличение; электротрицательность – увеличение; неметаллические свойства – увеличиваются; число валентных электронов – увеличиваются; высшая степень окисления – увеличивается; радиус атома – уменьшается; не меняется число электронных слоев
Сравниваем полученный ответ с ответами к заданию
В ряду элементов Si – P – S из представленных ответов увеличивается только число валентных электронов в атомах.
Выбираем номер правильного ответа: 1
Тема: Химическая связь и строение молекул
Нужно знать: строения молекул и химической связи, определения ковалентные связи, метталическая, ионная, металлы, неметаллы
Шпаргалка на экзамене: таблица Менделеева и собственные знания
Какое из указанных веществ имеет ковалентную полярную связь?
Вспоминаем какие связи существуют и их определения
Металлическая – связь между атомами 1 или нескольких металлов
Ионная – связь между атомами металла и неметалла
Ковалентная полярная – связь между атомами двух разных неметаллов
Ковалентная неполярная – связь между атомами одного неметалла
Разбираем каждую молекулу по типам связи
СН4 – два разных атома неметалла – ковалентная полярная
S8 – один атом неметалл – ковалентная неполярная
CuO – атомы металла и неметалла – ионная
Zn – атом металла – металлическая
Выбираем правильный ответ из представленных: 1
Тема: Степень окисления и валентность
Нужно знать: определения степени окисления и валентности, их различия, уметь рассчитать степень окисления атома в молекулах, уметь определять высшие и низшие степени окисления элементов
Шпаргалка на экзамене: таблица Менделеева, таблица растворимости (известные степени окисления) и собственные знания
Степени окисления фосфора в соединениях K3PO4 и Mg3P2 соответственно равны:
Определяем степени окисления известных нам элементов
Степени окисления К и Mg можем определить по таблице растворимости: у К в соединения степень окисления всегда +1, а у Mg — +2
У атома О в соединениях степень окисления всегда равна -2.
Вычисляем по уравнению степень окисления фосфора в каждом из соединений
K3PO4 – суммарная степень окисления самой молекулы равна 0
Mg3P2– суммарная степень окисления самой молекулы равна 0
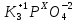
Умножаем индексы атомов на их степени окисления с учетом знаков: +1*3+Х+(-2)*4=0
Решаем уравнение с одним неизвестным: +3+Х-8=0↠Х=+5
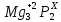
Умножаем индексы атомов на их степени окисления с учетом знаков: +2*3+2*Х=0
Решаем уравнение с одним неизвестным: +6+2Х=0↠Х=-3
Выбираем правильный ответ из представленных: 1
Тема: Классификация веществ
Нужно знать: классы неорганических соединений, определения кислот, оснований, солей, оксидов, амфотерность, кислотность и основность веществ, знать, как записываются формулы неорганических молекул
Шпаргалка на экзамене: собственные знания и таблица растворимости
Гидроксиду натрия соответствует формула
1. Вспоминаем определение оснований/классов неорганических соединений
Оксиды – сложные вещества, состоящие из двух химических элементов, один из которых — кислород.
Основания – это сложные вещества, состоящие из ионов металла и гидроксид-ионов.
Кислоты – это сложные вещества, состоящие из ионов водорода и кислотных остатков.
Соли – это сложные вещества, состоящие из ионов металла и кислотных остатков.
2. Ищем вещество, которое соответствует данному определению
NaH — соединение металла натрия с водородом — такие соединения носят названия гидриды, но не гидроксиды.
NaOH образовано катионом металла — натрия и гидроксо- группой.
NaHCO3 — кислая соль — гидрокарбонат натрия. Она образована остатком угольной кислоты и катионом натрия.
Na2CO3 — средняя соль — карбонат натрия.
3. Выбираем правильный ответ из представленных: 2
Тема: Классификация веществ
Нужно знать: химическая реакция, условия и признаки протекания химических реакций, химические уравнения, сохранение массы веществ при химических реакциях, классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии
Шпаргалка на экзамене: собственные знания и таблица растворимости
Сумма коэффициентов в уравнении реакции между оксидом кальция и водой равна:
1. Составляем уравнение реакции
CaO + H2O = Ca(OH)2
2. Определяем коэффициенты
Всех элементов до реакции и после одинаковое количество Са до реакции был один, после реакции столько же, водород и кислород до реакции по 2 атома, после реакции также по 2 атома. Следует вывод, что коэффициенты перед молекулами равны 1.
1CaO + 1H2O = 1Ca(OH)2
Сумма всех коэффициентов в уравнении равна: 1+1+1=3
3. Выбираем правильный ответ из представленных: 3
Тема: Электролитическая диссоциация
Нужно знать: определение электролитической диссоциации, электролитов и неэлектролитов, знать представителей сильных и слабых электролитов, писать уравнения диссоциации
Шпаргалка на экзамене: собственные знания и таблица растворимости
Одинаковое число молей катионов и анионов образуется при полной диссоциации в водном растворе 1 моль
1. Определяем сильный или слабый электролит
H2SO4 – серная кислота относится к сильным электролитам
(NH4)2S – сильных электролит, т.к. хорошо растворим в воде
BaCl2 – сильный электролит, т.к. хорошо растворим в воде
CuSO4– сильный электролит, т.к. хорошо растворим в воде
2. Пишем уравнения диссоциации электролита
H2SO4 = 2 H + + SO4 2-
(NH4)2S = 2 NH4 + + S 2-
BaCl2 = Ba 2+ + 2Cl —
CuSO4 = Cu 2+ + SO4 2-
3. Согласно условию задачи определяем число молей катионов и анионов
В данном случае необходимо определить ОДИНАКОВОЕ количество молей катионов и анионов, которому соответствует уравнение диссоциации под номером 4
4. Выбираем правильный ответ из представленных: 4
Тема: Реакции ионного обмена
Нужно знать: реакции ионного обмена, условия их осуществления
Шпаргалка на экзамене: таблица растворимости
Газ выделяется при взаимодействии
1.MgCl2 и Ba(NO3)2
2.Na2CO3 и CaCl2
1. Записываем уравнения реакции между веществами/элементами из каждого пункта
MgCl2 + Ba(NO3)2 = Mg(NO3)2 + BaCl2
Na2CO3 + CaCl2 = 2 NaCl + CaCO3
NH4Cl + NaOH = NH4OH + NaCl или NH4Cl + NaOH = NH3 + H2O + NaCl
CuSO4 + 2 KOH = Cu(OH)2 + K2SO4
3. Согласно условию задачи определяем образуется ли газ/осадок (по таблице растворимости) /вода
MgCl2 + Ba(NO3)2 = Mg(NO3)2 + BaCl2 — смотрим в таблицу растворимости: нитрат магния растворим (как и все нитраты), хлорид бария — тоже, поэтому реакция не идет, выделения газа не наблюдается
Na2CO3 + CaCl2 = 2 NaCl + CaCO3 — Карбонат кальция нерастворим, реакция ионного обмена идет, но газа в продуктах в ней нет
NH4Cl + NaOH = NH3 + H2O + NaCl – выделение газа NH3
CuSO4 + 2 KOH = Cu(OH)2 + K2SO4 — Гидроксид меди нерастворим, но газ не выделяется
4. Выбираем правильный ответ из представленных: 3
Тема: Химические свойства металлов и неметаллов
Нужно знать: реакционную способность химических веществ — металлов и неметаллов
Шпаргалка на экзамене: ряд активности металла и собственные знания
С водой при комнатной температуре реагирует
1. По ряду напряжений металлов определяем, что с водой реагируют металлы, стоящие в ряду напряжений до алюминия:
2. Определяем металл, который стоит до алюминия
До алюминия стоит только металл Са, все остальные элементы стоят после водорода
3. Выбираем правильный ответ из представленных: 3
Тема: Химические свойства оксидов
Нужно знать: реакционную способность химических веществ — оксидов.
Шпаргалка на экзамене: ряд активности металла и собственные знания
Оксид цинка реагирует с каждым из двух веществ:
1. Определить какой оксид указан в задании: кислотный/амфотерный/основный
Оксид цинка — амфотерный оксид
2. Вспомнить химические свойства данных оксидов
Т.к. он амфотерный, реагирует как с кислотами, так и с основаниями
3. Определяем, могут ли вещества из вариантов ответов реагировать с указанным в задании оксидом
Na2O (основный оксид) и H2O — Амфотерные оксиды реагируют с основными оксидами, но не реагируют с водой!
SiO2 и Ag — Оксид цинка должен реагировать с оксидом кремния при сплавлении, а с серебром нет — оно менее активно, чем цинк в ряде напряжений металлов
NaOH и HCl — Оксид цинка амфотерен и реагирует как соляной кислотой, так и с гидроксидом натрия. Данный вариант ответа подходит
HNO3 и O2 — С азотной кислотой все в порядке — она реагирует с оксидом цинка, а кислород нет — он уже и так окислил цинк до оксида.
4. Выбираем правильный ответ из представленных: 3
Тема: Химические свойства кислот и оснований
Нужно знать: реакционную способность химических веществ – кислот и оснований, знание всех типов реакций (ионные реакции, овр и т.п.)
Шпаргалка на экзамене: ряд активности металла, таблица растворимости и собственные знания
В реакцию с соляной кислотой вступает:
1. Определить какое вещество указано в условии задания – класс соединений
Соляная кислота – класс соединений «кислоты» с химической формулой HCl
2. Вспомнить химические свойства данного класса
Кислоты реагируют с основными оксидами, амфотерными оксидами, со щелочами, солями, нерастворимыми основаниями, вытеснение слабых кислот из растворов их солей, металлами
3. Определяем, могут ли вещества из вариантов ответов реагировать с указанным в задании кислотой/основанием
1.Соляная кислота и нитрат серебра. Так как нитрат серебра — соль, обменная реакция возможна, если продукт реакции осадок либо газ. В качестве продукта может образоваться азотная кислота (растворима) и хлорид серебра (нерастворим — белый творожистый осадок). Значит, реакция возможна и ответ нам подходит.
2.Нитрат бария и соляная кислота. Продукты данной реакции обмена растворимы (азотная кислота и хлорид бария), поэтому реакция не идет.
3.Серебро стоит в ряду напряжений после водорода, поэтому не реагирует с кислотами-неокислителями.
4.Оксид кремния — кислотный оксид и с кислотами не реагирует.
4. Выбираем правильный ответ из представленных: 1
Тема: Химические свойства солей
Нужно знать: реакционную способность химических веществ – соли, знание всех типов реакций
Шпаргалка на экзамене: ряд активности металла, таблица растворимости и собственные знания
Среди веществ: NaCl, Na2S, Na2SO4 – в реакцию с раствором Cu(NO3)2 вступает(-ют):
1. Берем в качестве шпаргалки таблицу растворимости
2. Пишем уравнения реакции нитрата меди с каждой из соли
3. Определяем протекает реакция или нет
NaCl + Cu(NO3)2 = 2 NaNO3 + Cu(Cl)2 — Хлорид меди растворим, нитрат натрия тоже, значит данная реакция не идёт.
Na2S + Cu(NO3)2 = 2 NaNO3 + CuS — Нитрат натрия растворим, а сульфид меди — осадок, поэтому реакция идет.
Na2SO4 + Cu(NO3)2 = 2 NaNO3 + CuSO4 — Сульфат меди растворим, а значит реакция не идет.
4. Выбираем правильный ответ из представленных: 1
Тема: Чистые вещества и смеси, правила безопасной работы в школьной лаборатории, лабораторная посуда и оборудование
Нужно знать: понятия чистые вещества и смеси, правила работы в школьной лаборатории, правила эксплуатации химической посуды и оборудования
Шпаргалка на экзамене: собственные знания
Верны ли следующие суждения об использовании лабораторного оборудования?
А. Фарфоровая ступка используется для измельчения твердых веществ.
Б. Делительная воронка используется для переливания жидкостей.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
1. Необходимо знать определения «Фарфоровая ступка» и «Делительная воронка»
Фарфоровая ступка — инструмент для толчения и растирания чего-либо, но она довольно хрупкая, поэтому ни в коем случае нельзя бить в ней по веществу, только растирать круговыми движениями с небольшими усилиями
Делительная воронка — сосуд конической формы, применяемый для разделения органической и неорганической фаз несмешивающихся жидкостей (либо для переливания жидкостей)
2. Исходя из определений можем сделать вывод о том, что утверждения об использовании лабораторного оборудования верны
3. Выбираем правильный ответ из представленных: 3
Тема: Степень окисления химических элементов. Окислитель и восстановитель. ОВР.
Нужно знать: об окислении и восстановлении, понятия окислитель и восстановитель, окислительно-восстановительная реакция.
Шпаргалка на экзамене: собственные знания
Сера является окислителем в реакции:
1.H2S + I2 = S + 2HI
2.3S + 2Al = Al2S3
3.2SO2 + О2 = 2SO3
4.S + 3NO2 = SO3 + 3NO
1. Определить степени окисления каждого из элементов во всех молекулах, участвующих в реакции (до и после реакции)
2. В каждой из реакций определить окислителя и восстановителя и реакции окисления и восстановления
H2S + I2 = S + 2HI: 
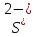
3S + 2Al = Al2S3: 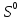
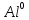
2SO2 + О2 = 2SO3: 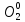

S + 3NO2 = SO3 + 3NO: 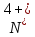
3. Смотрим на условие задачи, что нужно найти
По условию необходимо определить, в какой из реакций сера является окислителем. Окислителем сера является во второй реакции
4. Выбираем правильный ответ из представленных: 2
Тема: Массовая доля химического элемента
Нужно знать: о массовой доли химического элемента в веществе (молекуле) и формулу ее расчета
Шпаргалка на экзамене:

Ar(э) – относительная атомная масса элемента
n – число атомов элемента Э в молекуле вещества
Mr – относительная молекулярная масса вещества
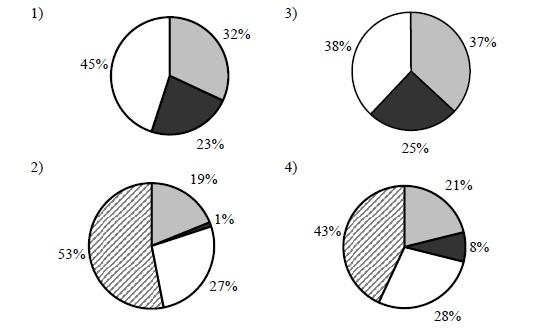
На какой диаграмме распределение массовых долей элементов отвечает количественному составу фосфата аммония?
1. Необходимо точно вычислить массовую долю одного из элементов, затем найти нужное значение на диаграмме и выбрать данный вариант ответа.
2. Найдем массовую долю фосфора в фосфате аммония. Для начала найдем молекулярную массу фосфата аммония:
Mr ((NH4)3PO4) = (14+4) * 3 + 31 + 16 * 4 = 149
3. Найдем массовую долю фосфора
w(P) = 31 / 149 • 100% = 20,8% = 21%, Значение 21% встречается на 4 диаграмме, значит ответ 4.
4.Выбираем правильный ответ из представленных: 4
Тема: Периодический закон Д.И.Менделеева. Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов.
Нужно знать: см. Задание №2
Шпаргалка на экзамене: таблица Менделеева
Общим для магния и кремния является:
1.наличие трёх электронных слоёв в их атомах
2.существование соответствующих им простых веществ в виде двухатомных молекул
3.то, что они относятся к металлам
4.то, что значение их электроотрицательности меньше, чем у фосфора
5.образование ими высших оксидов с общей формулой ЭО2
Берем таблицу Менделеева
Определяем местоположение атомов кремния и магния в таблице
Кремний – находится в 4 группе, в 3 периоде
Магний – находится во 2 группе, в 3 периоде
Определяем свойства, которые изменяются в ряду от Mg к Si
От кремния к сере изменяются: заряд ядра атома – увеличение; электротрицательность – увеличение; неметаллические свойства – увеличиваются; число валентных электронов – увеличиваются; высшая степень окисления – увеличивается; радиус атома – уменьшается; не меняется число электронных слоев
Сравниваем полученный ответ с ответами к заданию
Mg и Si оба имеют 3 электронных уровня и электроотрицательность ниже, чем у фосфора
5. Выбираем номер правильного ответа: 1,4
Тема: Первоначальные сведения об органических веществах: предельных и непредельных углеводородах и кислородсодержащих веществах
Нужно знать: классы органических соединений, химический и физические свойства, строение веществ и классификация ИЮПАК
Шпаргалка на экзамене: органические соединения сгорают до углекислого газа и воды
спирты являются жидкостями и реагируют со щелочными металлами
карбоновые кислоты реагируют с металлами и щелочами
Для этанола верны следующие утверждения:
1.в состав молекулы входит один атом углерода
2.атомы углерода в молекуле соединены двойной связью
3.является жидкостью (н.у.), хорошо растворимой в воде
4.вступает в реакцию со щелочными металлами
5.сгорает с образованием угарного газа и водорода
1. Определить класс органических соединений
Этанол – класс спирты
2. Вспомнить все корни, которым соответствуют число атомов углерода в углеродной цепи
Корень –эт‒, который говорит о том, что в углеродной цепи 2 атома углерода
3. Вспомнить химические и физические свойства данного класса органических соединений
Этанол – прозрачная жидкость, хорошо растворимая в воде
4. Выбираем номер правильного ответа: 3,4
Тема: Определение характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на ионы в растворе.
Нужно знать: знать и распознавать качественные реакции на катионы и анионы, понятие «индикатор»
Шпаргалка на экзамене: собственные знания, таблица растворимости
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
А) Na2CO3 и Na2SiO3
Б) К2CO3 и Li2CO3
В) Na2SO4 и NaOH
Рассматриваем каждый случай по отдельности
Na2CO3 и Na2SiO3
1.с хлоридом меди реакция не идет в обоих случаях, так как карбонат и силикат меди разлагается в водном растворе
2.с соляной кислотой в случае карбоната натрия выделяется газ, а в случае силиката выпадает осадок — это качественная реакция на силикаты
3.с оксидом магния данные вещества не реагируют, и оксид магния не вступает в реакции ионного обмена
4.с фосфатом также нет качественных реакций на натрий
1.с хлоридом меди данные вещества не реагируют (на самом деле выпадает осадок гидроксида меди, но этой реакцией не отличить два реагента)
2.с соляной кислотой оба реагируют с выделением углекислого газа
3.с оксидом магния данные вещества не реагируют, и оксид магния не вступает в реакции ионного обмена
4.с фосфатом выпадает литий в виде фосфата, а калий нет
хлорид меди. С гидроксидом натрия выпадает гидроксид меди, а с сульфатом реакция не идет
Выбираем номер правильного ответа: 241
Тема: Химические свойства простых и сложных веществ Нужно знать: необходимо вспомнить все химические свойства — как простых веществ, так и сложных, качественные реакции на катионы и анионы
Шпаргалка на экзамене: собственные знания, таблица растворимости
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
В) хлорид алюминия
Также рассматриваем каждый случай по отдельности
Сера. Сера как простое вещество не вступает в реакции обмена, поэтому все варианты, где присутствуют растворы, нам не подходят.
Остается последний вариант — концентрированная серная кислота и кислород.
С кислородом сера взаимодействует с образованием оксида серы 4 (SO2), и в серной кислоте окисляется:
2H2SO4(конц.) + S → 3SO2↑ + 2H2O
Оксид цинка — амфотерный оксид, а значит будет реагировать как с кислотами, так и с щелочами. Данный вариант ответа присутствует во втором варианте — это раствор соляной кислоты и гидроксида натрия.
Хлорид алюминия. Осталось два варианта ответа. В первом варианте не подходит и углекислый газ, и раствор сульфата натрия — реакции не идут, разве что гидролиз хлорида алюминия в растворе.
Остается третий вариант. С нитратом серебра выпадает осадок — хлорид серебра — это качественная реакция на хлорид ион. В растворе едкого калия выпадает гидроксид алюминия.
Выбираем номер правильного ответа: 423
Тема: Метод электронного баланса и уравнения химических реакций
Нужно знать: составление уравнения химической реакции методом электронного баланса
Шпаргалка на экзамене: собственные знания
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
HI + H2SO4 → I2 + H2S + H2O
Определите окислитель и восстановитель
1. Вычисляем изменение степени окисления каждого элемента в уравнении химической реакции
2. Выбираем только те элементы, которые поменяли степень окисления
меняют степени окисления сера и йод. Сера находилась в степени окисления +6, а в продуктах — -2. Йод имел степень окисления -1, а стал 0.
3. Для найденных элементов составляем электронный баланс, заключающийся в подсчете количества приобретенных или отданных электронов
S +6 + 8ē → S –2
2I –1 – 2ē → I2
4. Находим наименьшее общее кратное для переданных электронов
Наименьшее общее кратное 8, и дополнительные множители 1 и 4
S +6 + 8ē → S –2 |8 |1
2I –1 – 2ē → I2 |8 |4
5. Полученные значения и есть коэффициенты в уравнении (за редким исключением)
Расставляем коэффициенты в уравнении реакции согласно полученным данным:
8HI + H2SO4 = 4I2 + H2S + 4H2O
6. Определяем окислитель и восстановитель
сера в степени окисления +6 является окислителем, а иод в степени окисления –1 – восстановителем.
Тема: вычисление по химическим
уравнениям массы (объема, количества) исходных веществ и продуктов
Нужно знать: формулы массовой доли вещества, нахождение количества моль вещества, правильное составление условия (дано-найти-решение)
Шпаргалка на экзамене: собственные знания
Через 40 г раствора с массовой долей NaOH 6% пропустили углекислый газ до образования карбоната натрия. Вычислите объем (н.у.), вступившего в реакцию газа.
Как должно выглядеть решение данной задачи
w(NaOH) = 6% или 0,06
1моль =Na2CO3 + H2O
1) Рассчитываем массу и количество вещества NaOH:
а) m(NaOH)=40г × 0,06=2,4г
V(CO2)- ? б) n(NaOH)=2,4г:40г/моль=0,06 моль
2)Определяем объем CO2:
а)по уравнению реакции n(NaOH):n(CO2)=2:1, значит, n(CO2)=0,03 моль
б)V(CO2)=22,4л/моль × 0,03 моль=0,672л
Ответ: V(CO2)=0,672 л
1.Прочитайте задачу и составьте для нее краткое условие.
2.Составьте уравнение происходящей химической реакции и расставляем коэффициенты
2NaOH + CO2 = Na2CO3 + H2O
3.Вычислите молярные массы известного и искомого веществ.
М(NaOH) = 40г/моль; М (CO2) = 44 г/моль
4.Вычислите количество того вещества, которое известно по условию задачи.
Для этого можно воспользоваться следующими формулами:
n = m : M или n =V : Vm
1) Рассчитываем массу и количество вещества NaOH:
а) m(NaOH)=40г × 0,06=2,4г
V(CO2)- ? б) n(NaOH)=2,4г:40г/моль=0,06 моль
5.Под химическим уравнением запишите количественное соотношение
между веществом, заданным по условию задачи, и искомым веществом.
Количественное соотношение определяется по коэффициентам, записанным
перед формулами соответствующих веществ в химическом уравнении.
По количественному соотношению определите количество искомого
2NaOH + CO2 = Na2CO3 + H2O
6. Вычислите массу (или объем) искомого вещества. Для этого можно
использовать следующие формулы: m = n × M или V= n × Vm
2)Определяем объем CO2:
а)по уравнению реакции n(NaOH):n(CO2)=2:1, значит, n(CO2)=0,03 моль
б)V(CO2)=22,4л/моль × 0,03 моль=0,672л
7. запишите правильно ответ:
Ответ: V(CO2)=0,672 л
Тема: практическая работа, составление уравнений химических реакций
Нужно знать: планировать проведение эксперимента на основе предложенных веществ; описывать признаки протекания химических реакций; составлять молекулярные и сокращенные ионные уравнения этих реакций
Шпаргалка на экзамене: собственные знания
Даны вещества: растворы NaOH, ZnSO4, BaCl2 ,NaNO3, ZnCl2. Используя воду и необходимые вещества только из этого списка, получите в две стадии Zn(OH)2. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
1. Составить схему эксперимента, чтобы в конечном итоге получить вещество, указанное в условии: Zn(OH)2
ZnSO4 → ZnCl2 → Zn(OH)2
2. Составить уравнения химических реакций согласно предложенной схеме, определить тип реакции
1) ZnSO4 + BaCl2 = ZnCl2 + BaSO4 ↓ — Реакция ионного обмена
2) ZnCl2 + 2 NaOH = Zn(OH)2 ↓ + 2NaCl — Реакция ионного обмена
3. Описать признаки протеканий реакций для каждой из стадий
Признаки протекания реакций:
1) Для первой реакции – выпадение белого плотного осадка;
2) Для второй реакции – образование белого студенистого осадка.
4. Составить сокращенное ионное уравнение для реакции ионного обмена
Сокращенное ионное уравнение для 2-ой реакции:
Разбор и решение задания №8 ОГЭ по химии
Реакции ионного обмена
Перейдем к рассмотрению реакций ионного обмена в задании №8 ОГЭ по химии, или А8. Тематика задания сформулирована следующим образом:
- реакции ионного обмена
- условия их осуществления
Теория к заданию №8 ОГЭ по химии
Итак, начнем с определений:
Реакция ионного обмена — одна из видов химических реакций, продуктами которой являются вода, газ или осадок.
Иначе говоря, вещества обмениваются ионами только тогда, когда образуется либо газ, покидающий реакционную смесь, либо малорастворимое вещество — осадок или вода. Более профессиональным языком можно сказать, что движущей силой реакции ионного обмена является образование продукта иного агрегатного или фазового состояния в сравнении с реагентами.
На практике чаще всего мы сталкиваемся с реакциями в растворах, в результате которых образуется осадок, либо газ, либо вода. Чаще всего это реакции обмена.
Пример — реакция карбоната натрия и серной кислоты с выделением углекислого газа:
В сокращенном ионном виде:
Для успешного решения задач нам необходимо запомнить следующие правила:
- используем таблицу растворимости: если видим, что продукт (то, что слева в уравнении) нерастворим, то реакция идет.
- если видим в левой части газ (CO2, H2S, SO2 — типичные для ионного обмена), реакция идет.
- если видим воду (H2O), реакция идет.
Разбор типовых вариантов задания №8 ОГЭ по химии
Первый вариант задания
Газ выделяется при взаимодействии
Рассмотрим каждый случай.
MgCl2 + Ba(NO3)2 = Mg(NO3)2 + BaCl2
Смотрим в таблицу растворимости: нитрат магния растворим (кстати, как и все нитраты), хлорид бария — тоже, поэтому реакция не идет. Это во-первых, а во-вторых, нас спрашивают про газ, а газом здесь и не пахнет. 🙂
Na2CO3 + CaCl2 = 2 NaCl + CaCO3
Карбонат кальция нерастворим, реакция ионного обмена идет, но газа в продуктах в ней нет, поэтому этот вариант нам не подходит.
NH4Cl + NaOH = NH4OH + NaCl
NH4OH можно записать как NH3 и H2O, особенно актуально это для щелочной среды, в ней всегда выделяется аммиак!
NH4Cl + NaOH = NH3 + H2O + NaCl
Аммиак — газ, да еще и ядовитый, поэтому этот вариант нам подходит.
CuSO4 + 2 KOH = Cu(OH)2 + K2SO4
Гидроксид меди нерастворим, но газа здесь не наблюдается.
Реакции ионного обмена
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
| Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит. |
| Например, нитрат серебра взаимодействует с бромидом калия |
AgNО3 + КВr = АgВr↓ + КNО3
Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe 3+ + 3OH — = Fe(OH)3
На ионы мы не разбиваем:
- Оксиды; осадки; газы; воду; слабые электролиты (кислоты и основания)
- Анионы кислотных остатков кислых солей слабых кислот (НСО3 — , Н2РО4 — и т.п.) и катионы основных солей слабых оснований Al(OH) 2+
- Комплексные катионы и анионы: [Al(OH)4] —
| Например, взаимодействие сульфида цинка и серной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H + + SO4 2 — = Zn 2+ + SO4 2 — + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H + = Zn 2+ + H2S
| Например, взаимодействие гидрокарбоната натрия и гидроксида натрия |
Составляем уравнение реакции и проверяем растворимость всех веществ:
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na + + НСО3 — + Na + + ОН — = 2Na + + CO3 2- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3 — + ОН — = CO3 2- + H2O
| Например, взаимодействие тетрагидроксоалюмината натрия и соляной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ:
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
Na + + [Al(OH)4] — + 4H + + 4Cl — = Na + + Cl — + Al 3+ + 3Cl — + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4] — + 4H + = Al 3+ + 4H2O
http://spadilo.ru/zadaniye-8-oge-po-ximii/
http://chemege.ru/reakcii-ionnogo-obmena/