Рубидий: способы получения и химические свойства
Рубидий — это щелочной металл. Белый, мягкий, весьма легкоплавкий. Чрезвычайно реакционноспособный. Сильнейший восстановитель.
Относительная молекулярная масса Mr = 85,468; относительная плотность для твердого состояния d(т) = 1,532; относительная плотность для жидкого состояния d(ж) = 1, 472; tпл = 39,3º C; tкип = 696º C.
Способ получения
1. Рубидий получают в промышленности путем разложения гидрида рубидия при температуре выше 200º С, при этом образуются рубидий и водород :
2RbH = 2Rb + H2
2. В результате электролиза жидкого гидроксида рубидия образуются рубидий, кислород и вода :
4RbOH → 4Rb + O2↑ + 2H2O
3. В результате разложения оксида рубидия при 400 — 550º С получается пероксид рубидия и рубидий:
4. Жидкий хлорид рубидия подвергают электролизу, в результате чего на выходе образуется рубидий и хлор:
2RbCl = 2Rb +Cl2↑
Качественная реакция
Качественная реакция на рубидий — окрашивание пламени солями рубидия в фиолетовый цвет .
Химические свойства
1. Рубидий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Рубидий легко реагирует с водородом при 300–350º C и повышенным давлением с образованием гидрида рубидия:
2Rb + H2 = 2RbH
1.2. Рубидий сгорает в кислороде (воздухе) с образованием надпероксида рубидия:
а если сгоранием происходит в холодной среде, то образуется оксид рубидия:
1.3. Рубидий активно реагирует при комнатной температуре с фтором, хлором, бромом и йодом . При этом образуются фторид рубидия, хлорид рубидия, бромид рубидия, йодид рубидия :
2Rb + F2 = 2RbF
2Rb + Cl2 = 2RbCl
2Rb + Br2 = 2RbBr
2Rb + I2 = 2RbI
1.4. С серой рубидий реагирует при температуре 100–130º C с образованием сульфида рубидия:
2Rb + S = Rb2S
2. Рубидий активно взаимодействует со сложными веществами:
2.1. Рубидий реагирует с водой . Взаимодействие рубидия с водой приводит к образованию гидроксида рубидия и газа водорода:
2Rb 0 + 2 H2 O = 2 Rb + OH + H2 0
2.2. Рубидий взаимодействует с кислотами . При этом образуются соль и водород.
2.2.1. Рубидий реагирует с разбавленной соляной кислотой, при этом образуются хлорид рубидия и водород :
2Rb + 2HCl = 2RbCl + H2 ↑
2.2.2. При взаимодействии с разбавленной и холодной с ерной кислотой образуется сульфат рубидия, оксид серы (IV), осадок сера и вода:
2.2.3. Реагируя с разбавленной и холодной азотной кислотой рубидий образует нитрат рубидия, газ оксид азота (II), газ оксид азота (I), газ азот и воду:
2.2.4. В результате реакции насыщенной сероводородной кислоты и рубидия в бензоле образуется осадок гидросульфид рубидия и газ водород:
2Rb + 2H2S = 2RbHS↓ + H2↑
2.3. Рубидий может взаимодействовать с основаниями:
2.3.1. Рубидий взаимодействует с гидроксидом рубидия при температуре 400º С, при этом образуется оксид рубидия и водород:
2Rb + 2RbOH = 2Rb2O + H2
2.4. Рубидий вступает в реакцию с газом аммиаком при 40-60º С. В результате данной реакции образуется амид рубидия и водород:
2.5. Рубидий может вступать в реакцию с оксидами :
2.5.1. В результате взаимодействия рубидия и оксида кремния при температуре выше 300º С образуется силикат рубидия и кремний:
Химический элемент рубидий: характеристики, свойства, соединения
В 1861 году недавно изобретенный физический метод исследования веществ – спектральный анализ – еще раз продемонстрировал свое могущество и надежность, как залог большого будущего в науке и технике. С его помощью был открыт уже второй неизвестный ранее химический элемент – рубидий. Затем, с открытием в 1869 году Д. И. Менделеевым периодического закона, рубидий вместе с другими элементами занял свое место в таблице, которая внесла порядок в химическую науку.
Дальнейшее изучение рубидия показало, что этот элемент обладает целым рядом интересных и ценных свойств. Мы рассмотрим здесь наиболее характерные и важные из них.
Общая характеристика химического элемента

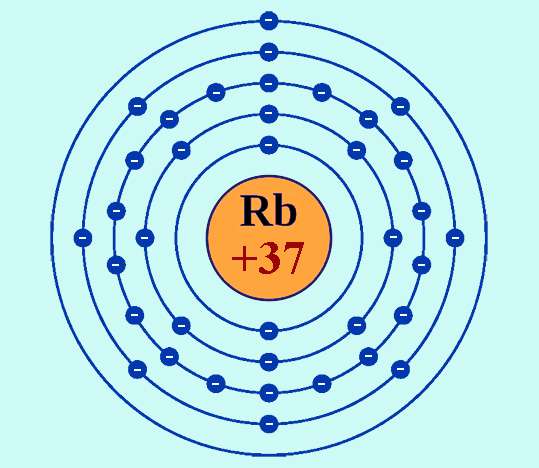
Рубидий имеет атомный номер 37, то есть в атомах его в состав ядер входит именно такое количество положительно заряженных частиц – протонов. Соответственно нейтральный атом обладает 37 электронами.
Символ элемента — Rb. В периодической системе рубидий классифицируется как элемент I группы, период – пятый (в короткопериодном варианте таблицы он относится к главной подгруппе I группы и расположен в шестом ряду). Является щелочным металлом, представляет собой мягкое, очень легкоплавкое кристаллическое вещество серебристо-белого цвета.

История обнаружения
Честь открытия химического элемента рубидий принадлежит двум немецким ученым – химику Роберту Бунзену и физику Густаву Кирхгофу, авторам спектроскопического метода изучения состава вещества. После того, как в 1860 году применение спектрального анализа привело к открытию цезия, ученые продолжили исследования, и уже в следующем году при изучении спектра минерала лепидолита ими были обнаружены две неотождествленные линии темно-красного цвета. Именно благодаря характерному оттенку наиболее сильных спектральных линий, по которым удалось установить существование неизвестного ранее элемента, он и получил свое название: слово rubidus переводится с латыни как «багровый, темно-красный».
В 1863 году Бунзен впервые выделил из воды минерального источника металлический рубидий путем упаривания большого количества раствора, разделения солей калия, цезия и рубидия и, наконец, восстановления металла с использованием сажи. Позднее Н. Бекетов сумел восстановить рубидий из его гидроксида с помощью порошка алюминия.
Физическая характеристика элемента
Рубидий – легкий металл, он имеет плотность 1,53 г/см3 (при нулевой температуре). Образует кристаллы с кубической объемно-центрированной решеткой. Плавится рубидий всего при 39 °C, то есть при комнатной температуре его консистенция уже близка к пастообразной. Металл кипит при 687 °C, пары его имеют зеленовато-синий оттенок.
Рубидий – парамагнетик. По проводимости он более чем в 8 раз превосходит ртуть при 0 °C и почти во столько же раз уступает серебру. Подобно другим щелочным металлам, рубидий отличает очень низкий порог фотоэффекта. Для возбуждения фототока в нем достаточно уже длинноволновых (то есть низкочастотных и несущих меньшую энергию) красных световых лучей. В этом отношении по чувствительности его превосходит лишь цезий.
Изотопы
Рубидий имеет атомный вес 85,468. В природе встречается в виде двух изотопов, различающихся количеством нейтронов в ядре: рубидий-85 составляет наибольшую долю (72,2%), и в значительно меньшем количестве – 27,8% – рубидий-87. Ядра их атомов, помимо 37 протонов, содержат соответственно по 48 и по 50 нейтронов. Более легкий изотоп стабилен, а рубидий-87 имеет огромный по длительности период полураспада – 49 миллиардов лет.
В настоящее время искусственным путем получено несколько десятков радиоактивных изотопов этого химического элемента: от сверхлегкого рубидия-71 до перегруженного нейтронами рубидия-102. Периоды полураспада искусственных изотопов варьируют от нескольких месяцев до 30 наносекунд.
Основные химические свойства
Как было отмечено выше, в ряду химических элементов рубидий (как натрий, калий, литий, цезий и франций) относится к щелочным металлам. Особенность электронной конфигурации их атомов, определяющая химические свойства – это наличие только одного электрона на внешнем энергетическом уровне. Этот электрон легко покидает атом, а ион металла при этом приобретает энергетически выгодную электронную конфигурацию стоящего перед ним в таблице Менделеева инертного элемента. Для рубидия это – конфигурация криптона.
Таким образом, рубидий, как и прочие щелочные металлы, имеет ярко выраженные восстановительные свойства и степень окисления +1. Щелочные свойства сильнее проявляются с увеличением атомного веса, поскольку при этом растет и радиус атома, и, соответственно, ослабляется связь внешнего электрона с ядром, что обусловливает повышение химической активности. Поэтому рубидий активнее лития, натрия и калия, а цезий, в свою очередь, активнее рубидия.
Суммируя все вышесказанное о рубидии, разбор элемента можно произвести, как на иллюстрации, представленной ниже.
Соединения, образуемые рубидием
На воздухе этот металл ввиду своей исключительной реакционной активности окисляется бурно, с воспламенением (пламя имеет фиолетово-розоватый цвет); в ходе реакции образуются надпероксид и пероксид рубидия, проявляющие свойства сильных окислителей:
Оксид образуется в том случае, если доступ кислорода к реакции ограничен:
Это вещество желтого цвета, реагирующее с водой, кислотами и кислотными оксидами. В первом случае образуется одна из наиболее сильных щелочей – гидроксид рубидия, в остальных – соли, например, сульфат рубидия Rb2SO4, большинство которых растворимы.
Еще более бурно, сопровождаясь взрывом (так как мгновенно воспламеняются и рубидий, и освобождаемый водород), протекает реакция металла с водой, в которой образуется гидроксид рубидия, чрезвычайно агрессивное соединение:
Рубидий – химический элемент, способный также непосредственно реагировать со многими неметаллами – с фосфором, водородом, углеродом, кремнием, с галогенами. Галогениды рубидия – RbF, RbCl, RbBr, RbI – хорошо растворимы в воде и в некоторых органических растворителях, например, в этаноле или в муравьиной кислоте. Взаимодействие металла с серой (растирание с серным порошком) происходит взрывообразно и приводит к образованию сульфида.
Существуют и малорастворимые соединения рубидия, такие как перхлорат RbClO4, они находят применение в аналитике для определения этого химического элемента.
Нахождение в природе
Рубидий – элемент, не относящийся к редким. Встречается он практически везде, входит в состав множества минералов и горных пород, а также содержится в океане, в подземных и речных водах. В земной коре содержание рубидия достигает суммарного значения содержания меди, цинка и никеля. Однако, в отличие от многих гораздо более редких металлов, рубидий – чрезвычайно рассеянный элемент, его концентрация в породе очень низка, и он не образует собственных минералов.
В составе полезных ископаемых рубидий повсеместно сопутствует калию. Наибольшей концентрацией рубидия отличаются лепидолиты – минералы, служащие также источником лития и цезия. Так что рубидий в небольших количествах всегда присутствует там, где обнаруживаются другие щелочные металлы.
Немного о применении рубидия
Краткую характеристику хим. элемента рубидия можно дополнить несколькими словами о том, в каких областях используется этот металл и его соединения.
Рубидий находит применение в производстве фотоэлементов, в лазерной технике, входит в состав некоторых специальных сплавов для ракетной техники. В химической промышленности соли рубидия используются благодаря высокой каталитической активности. Один из искусственных изотопов, рубидий-86, применяется в гамма-дефектоскопии и, кроме того, в фармацевтической промышленности для стерилизации лекарственных препаратов.
Еще один изотоп, рубидий-87, используют в геохронологии, где он служит для определения возраста древнейших горных пород благодаря очень большому периоду полураспада (рубидий-стронциевый метод).
Если несколько десятков лет назад считалось, что рубидий – химический элемент, область применения которого едва ли будет расширяться, то в настоящее время для этого металла появляются все новые перспективы, например, в катализе, в высокотемпературных турбоагрегатах, в специальной оптике и в других сферах. Так что в современных технологиях рубидий играет и будет продолжать играть важную роль.
Напишите уравнение реакции взаимодействия рубидия с водой?
Химия | 5 — 9 классы
Напишите уравнение реакции взаимодействия рубидия с водой.
2Rb + 2H₂O = 2RbOH + H₂.
Напишите уравнения реакции взаимодействия : натрия с водой, хлором, серной кислотой?
Напишите уравнения реакции взаимодействия : натрия с водой, хлором, серной кислотой.
Напишите уравнение реакции взаимодействия калия с водой?
Напишите уравнение реакции взаимодействия калия с водой.
Ответ дайте в виде суммы коэффициентов в уравнении реакции.
Напишите уравнение реакции взаимодействия калия и кальция с водой , если при этом образуется водород и соответствующий гидроксид?
Напишите уравнение реакции взаимодействия калия и кальция с водой , если при этом образуется водород и соответствующий гидроксид.
Напишите уравнения возможных реакций взаимодействия лития и цинка с хлором , водой , соляной кислотой?
Напишите уравнения возможных реакций взаимодействия лития и цинка с хлором , водой , соляной кислотой.
Напишите уравнения реакций взаимодействия бутена — 2 с водородом, бромом, хлороводородом, водой?
Напишите уравнения реакций взаимодействия бутена — 2 с водородом, бромом, хлороводородом, водой.
Напишите уравнение реакции взаимодействия хлора с магнием?
Напишите уравнение реакции взаимодействия хлора с магнием.
Напишите уравнения реакций взаимодействия : алюминия с азотом?
Напишите уравнения реакций взаимодействия : алюминия с азотом.
Напишите уравнение реакции взаимодействия 2, 3 диметилбутена — 1 с водой?
Напишите уравнение реакции взаимодействия 2, 3 диметилбутена — 1 с водой.
Напишите пожалуйста 5 уравнений химических реакций взаимодействия оксидов с водой?
Напишите пожалуйста 5 уравнений химических реакций взаимодействия оксидов с водой.
Напишите пожалуйста 5 уравнений химических реакций взаимодействия оксидов с водой?
Напишите пожалуйста 5 уравнений химических реакций взаимодействия оксидов с водой.
Вы находитесь на странице вопроса Напишите уравнение реакции взаимодействия рубидия с водой? из категории Химия. Уровень сложности вопроса рассчитан на учащихся 5 — 9 классов. На странице можно узнать правильный ответ, сверить его со своим вариантом и обсудить возможные версии с другими пользователями сайта посредством обратной связи. Если ответ вызывает сомнения или покажется вам неполным, для проверки найдите ответы на аналогичные вопросы по теме в этой же категории, или создайте новый вопрос, используя ключевые слова: введите вопрос в поисковую строку, нажав кнопку в верхней части страницы.
1) СН3 — СН(ОН) — СН(СН3) — С(СН3)(С2Н5) — СН2 — СН3 2) СН3 — СН(ОН) — СН(С2Н5) — СН(СН3) — СН2 — СН2 — СН3 3) СН3 — СН2 — С(СН3)(СН3) — СОН 4) СН3 — СН2 — СН(С2Н5) — СН2 — СН(С2Н5) — СОН 5) СН3 — СН(СН3) — СН(СН3) — С(СН3)(С2Н5) — СН2 — СООН 6) СН3 ..
В 1 моль ортофосфата натрия содержится 69 г натрия, то 23 г его будет содержаться в 1 / 3 моль данного вещества.
Наверное так) удачи ).
Пожалуйста здесь электронный бананс можно ещё электонно — ионный написать.
HBr = H + Br H2SO4 = 2H + SO4 HNO3 = H + NO3 HClO4 = H + CLO4 H3PO4 = 3H + PO4 HMnO4 = H + MnO4 Кислоты диссоциируют на катионы водорода и анионы кислотного остатка. В растворах кислот всегда присутствуют одинаковые ионы водорода — Н( + ).
Так как если бы химию соединили с другими науками о природе, то получилась бы какая — то каша. Каждая наука изучает что — то своё.
1) Оксиды : CaO, CuO, Mn2O7, ZnO, N2O5, SO3, SO2, P2O5, Na2O, B2O3, BeO, CrO3, MnO2, Br2O5, Rb2O, PbO2 2) Основания : Cu(OH)2, LiOH, Be(OH)2, Ca(OH)2, Ba(OH)2, NaOH, KOH, Fe(OH)2, Zn(OH)2 3) Кислоты : HNO3, H2S, HCl, H2SO4, H3PO4, H2SO3, HMnO4, H3AsO..
M (Na3BO3) = (23 * 3) + 11 + (16 * 3) = 128 г \ моль.
Вроде так, но это не точно.
В) он просто не может с ним реагировать так как ничего не случиться.
http://1ku.ru/obrazovanie/29002-himicheskij-jelement-rubidij-harakteristiki-svojstva-soedinenija/
http://himia.my-dict.ru/q/641695_napisite-uravnenie-reakcii-vzaimodejstvia-rubidia-s/