Химия. 11 класс
Конспект урока
Урок № 8. Химические источники тока. Ряд стандартных электродных потенциалов
Перечень вопросов, рассматриваемых в теме: урок посвящён устройству и принципу работы гальванического элемента и других химических источников тока. Учащиеся получат представление о ряде электродных потенциалов и возможностях его использования.
Гальванический элемент — химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока.
Электрод — электрический проводник, имеющий электронную проводимость и находящийся в контакте с ионным проводником — электролитом. В электрохимии — это часть электрохимической системы, включающая в себя проводник и окружающий его раствор
Анод — электрод, на котором происходит процесс окисления
Катод — электрод, на котором происходит процесс восстановления
Аккумулятор — химический источник тока многоразового действия
Топливный элемент — устройство, обеспечивающее прямое преобразования химической энергии в электрическую
Электрохимия — наука, которая изучает закономерности взаимного превращения химической и электрической форм энергии
Ряд стандартных электродных потенциалов — ряд металлов, расположенных в порядке возрастания значения их стандартных потенциалов
Стандартные условия — температура 25 о С, концентрация солей 1моль/л, давление 0,1МПа
Стандартный водородный электрод — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Химические источники тока
Рассмотрим знакомую нам окислительно-восстановительную реакцию. В раствор сульфата двухвалентной меди опустим цинковую пластинку. Со временем на поверхности цинка образуется красноватая пленка кристаллической меди. Синяя окраска раствора постепенно ослабевает. Это говорит о том, что протекает химическая реакция.
Cu 2+ + Zn = Zn 2+ + Cu
Молекулы воды отрывают ион цинка. Отдавая электроны, цинк является восстановителем. Ион меди – окислитель — принимает электроны. Электроны передаются от цинка к меди в месте соприкосновения металлов.
Давайте немного изменим условия проведения реакции. Цинковую пластинку опустим в сосуд с раствором сульфата цинка. Медную поместим в другой сосуд с раствором сульфата меди. Соединим пластинки с помощью металлического проводника. Теперь на цинковой пластинке идет окисление атомов цинка, а на медной восстанавливаются ионы меди. Электроны для их восстановления передаются теперь не напрямую, а по проводнику. Направленное движение электронов по этой внешней цепи и есть не что иное, как электрический ток.
Таким образом, произошло превращение энергии, полученной в результате химической реакции в электрическую. Устройство, в котором это осуществилось, получило название гальванический элемент.
Металлические пластинки или стержни называются электродами. Электроны перемещаются по внешней цепи от анода (цинка) к катоду (меди).
Образовавшиеся на аноде ионы цинка выходят в раствор и придают ему избыточный положительный заряд. В это же время у катода катионы меди восстанавливаются (принимают электроны), а оставшиеся в растворе анионы SO4 2- заряжают раствор отрицательно. Это препятствует дальнейшему течению процесса.
Чтобы не допустить этого, соединим сосуды стеклянной трубкой, которую заполним раствором хлорида калия с желатином. Теперь анионы будут двигаться в сторону цинка, а катионы – наоборот. Так будет поддерживаться электронейтральность растворов.
Гальванический элемент будет продолжать работу до полного растворения цинкового электрода или до восстановления всех ионов меди.
Впервые установку, в которой химическая реакция породила электрический ток, собрал Алессандро Вольта в 1800 году. Название «гальванический элемент» она получила позднее.
Теперь наука, которая изучает химические процессы, проходящие под действием электрического тока, а также процессы, в результате которых энергия химических реакций преобразуется в электрическую энергию, называется электрохимия.
Химические источники тока применяются очень широко. Знакомые нам «батарейки» — это разные варианты гальванических элементов. К сожалению, разрядившаяся батарейка уже не может быть восстановлена.
Этого недостатка лишены аккумуляторы, которые тоже представляют собой химические источники тока. Они устроены так, что израсходовав в процессе работы материалы электродов и электролит, способны вновь восстановить рабочие свойства после зарядки.
В свинцовом аккумуляторе чередуются решетчатые пластины, заполненные губчатым свинцом и диоксидом свинца. Электролитом служит серная кислота. Во время работы аккумулятора металлический свинец окисляется, а диоксид свинца восстанавливается.
Когда аккумулятор заряжают, то подключают его таким образом, чтобы ток шёл в направлении, противоположном тому, в котором двигались электроны во время работы. Благодаря этому, процессы окисления и восстановления на электродах поворачивают вспять. Теперь протекают обратные реакции, в результате которых снова появляются свинец, диоксид свинца и серная кислота.
Аккумулятор снова готов к работе.
Еще один источник преобразования химической энергии в электрическую – топливный элемент. Он подобен гальваническому элементу с той лишь разницей, что реагенты постоянно поступают в него извне. Поэтому он не разряжается и не требует электричества для повторной зарядки. Примером может служить водородный топливный элемент, перспективный для водородной энергетики.
Ряд стандартных электродных потенциалов
Вернемся к электродам и посмотрим поближе, что происходит там, где металл граничит с раствором.
Молекулы воды поляризованы и способны отрывать ионы металла. Удерживающиеся на поверхности электроны образуют отрицательно заряженный слой. К нему притягиваются из раствора катионы, образуя второй слой — положительный. Возникающую в двойном слое разность потенциалов называют электродным потенциалом, но определить его величину напрямую невозможно.
Однако есть такой электрод, которым пользуются для сравнения электродных потенциалов разных металлов. Он сделан из платины, но называется водородным, потому что водород пропускается через кислоту, в которой находится электрод. Благодаря платине, выступающей как катализатор, часть молекул водорода распадаются на атомы, которые окисляются на границе с кислотой. Одновременно идет и обратная реакция.
Разность потенциалов, возникающая в двойном электрическом слое водородного электрода, условно принимается за ноль.
Потенциал металла, измеренный относительно стандартного водородного электрода при концентрации ионов металла 1 моль/л и температуре раствора, равной 25 о С, называют стандартным электродным потенциалом металла.
Соберём гальванический элемент, соединив электрод из исследуемого металла со стандартным водородным электродом. Электролитом для металлического электрода послужит раствор соли этого металла, а для водородного, как всегда, кислота.
Зная, что электродвижущая сила вычисляется как разность потенциалов двух электродов, и, подставив ноль в случае водородного электрода, мы видим, что измеренная ЭДС и будет потенциалом исследуемого электрода.
Металлы, расположенные в порядке возрастания значений их стандартных потенциалов, составляют электрохимический ряд напряжений металлов или ряд стандартных электродных потенциалов. Еще одно название – ряд активности металлов.
Имея в своем распоряжении ряд напряжений, мы можем характеризовать химические свойства металлов:
- Чем меньше значение электродного потенциала металла, тем больше его восстановительная способность;
- Каждый металл, начиная с магния, вытесняет все следующие за ним металлы из растворов их солей (это касается металлов, не взаимодействующих с водой);
- Металлы, стоящие в ряду напряжений до водорода, вытесняют его из разбавленных кислот (кроме азотной).
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
- Решение задачи на использование электрохимического ряда напряжений металлов
Условие задачи: Учитель загадал металл и дал ученикам три подсказки:
- из соли ртути он вытеснит ртуть;
- но не вытеснит водород из растворов кислот;
- вам отгадать поможет вполне таблица, висящая на стене.
— Конечно, это ___, — засмеялись ученики, — только один металл подходит под ваше описание.
Вставьте в текст название металла.
Шаг первый: из таблиц выбираем «Электрохимический ряд напряжений металлов»
Шаг второй: находим металлы левее ртути, т.к. они вытесняют ртуть из растворов солей.
Шаг третий: из выбранных металлов находим те, что расположены правее водорода, т.к. они не вытесняют водород из растворов кислот.
Этим условиям отвечает только один металл – медь.
2. Решение задачи на расчеты по уравнению реакции
Условие задачи: Мастер решил покрыть железную фигурку слоем меди и поместил её в сосуд с раствором медного купороса. Он знал, что на изготовление фигурки было использовано ровно 120 г железа. Когда мастер достал фигурку из раствора, её масса оказалась уже 121,56 г. Сколько граммов меди осело на фигурке?
Шаг первый: Запишем уравнение реакции
Шаг второй: Выразим массу железа через массу меди.
Из уравнения реакции следует, что количество вещества выделившейся меди равно количеству вещества прореагировавшего железа
m(Fe)/56 = m(Cu)/64, тогда
Шаг третий: Рассчитаем массу меди.
Так как масса пластинки уменьшилась на величину массы прореагировавшего железа и увеличилась на величину массы выделившейся меди, можно записать равенство:
Электродный потенциал. Уравнение Нернста.
Учение об электродвижущих силах гальванических элементов является одним из основных разделов электрохимии. Начало изучению электродвижущих сил было положено еще М. В. Ломоносовым (1750), который в своих работах отмечал связь между химическими и электрическими явлениями. Позднее наблюдения итальянского физиолога Гальвани (1780) и обширные работы итальянского физика Вольта (1780) привели к открытию гальванических элементов.
В 1800 г. Вольта изобрел первый химический источник тока, так называемый вольтов столб, который был собран из пластинок различных металлов, разделенных прослойками ткани, смоченной электролитом. Исследования привели Вольта к открытию контактной разности потенциалов, возникающей при соприкосновении металлов различной природы. В первых исследованиях в качестве чувствительного прибора для обнаружения малой разности потенциалов ученый использовал свежеанатомированные мышцы лягушки. Этот случай является наглядным примером того, как биологические методы исследования нередко могут способствовать успешному развитию физики и других точных наук.
Открытие химических источников тока и контактной разности потенциалов оказало большое влияние на все последующее развитие электрохимических явлений. В настоящее время методы электрохимии получили широкое распространение в агрохимии, физиологии растений, в биологии, почвоведении, а также во многих других смежных дисциплинах.
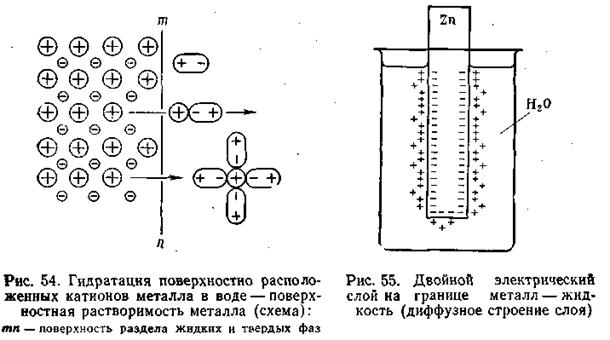
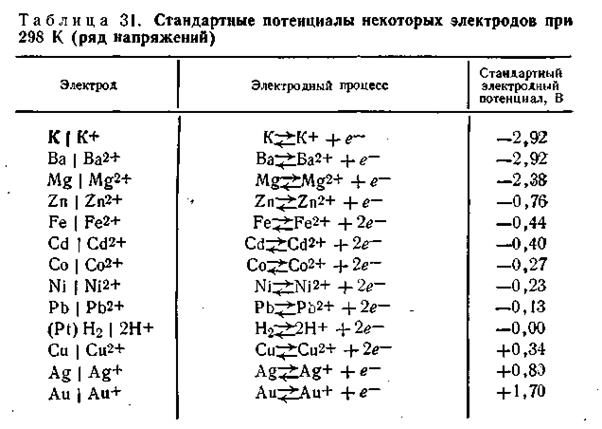
Если в чистую воду погрузить пластинку какого-либо металла, то согласно гидратной теории Д. И. Менделеева ионы металла будут взаимодействовать с полярными молекулами воды. Иными словами, поверхностно расположенные катионы этого металла будут гидратироваться молекулами воды и переходить в окружающий раствор, заряжая его положительно, т. е. металл будет как бы растворяться (рис.4.8).
Однако электроны, в избытке остающиеся в металле, заряжают его поверхностный слой отрицательно. В результате этого между ионами металла, перешедшими в раствор, и поверхностью металлической пластинки возникают силы электростатического притяжения, в силу чего ионы, окружающие пластинку, образуют так называемый двойной электрический слой, схема которого приведена на рис. 4.8. Этот слой препятствует дальнейшему растворению металла и в системе устанавливается подвижное равновесие, которое характеризуется равными скоростями как растворения, так и обратного осаждения ионов из раствора на поверхности металлической пластинки.
Первоначально считали, что двойной электрический слой имеет плоское строение. Он уподоблялся конденсатору, одна из обкладок которого расположена на поверхности металла, другая — в слое прилегающей к электроду жидкости. Расстояние между обкладками равно диаметру молекулы.
Согласно этой теории, которую обычно связывают с именем Гельмгольца (1879), учитывалось только проявление электростатических сил взаимодействия между зарядами противоположного знака и не учитывалось изменение свойств двойного электрического слоя с изменением концентрации электролита и его температуры, что явилось основным недостатком теории Гельмгольца.
В разработке современной теории строения двойного электрического слоя на границе твердая фаза—жидкость и методов его исследования ведущая роль принадлежит А. Н. Фрумкину и его школе. Работы А. Н. Фрумкина и его учеников установили, что слой ионов, располагающийся в жидкости, благодаря действию двух противоположно направленных сил (электростатического притяжения и теплового движения) имеет диффузное строение, т. е. он проникает в жидкость на некоторую глубину (рис. 4.8).
|
|
Определенная часть ионов удерживается вблизи поверхности раздела металл—электролит, образуя обкладку двойного слоя с толщиной, отвечающей среднему радиусу ионов электролита. Остальные ионы, входящие в состав двойного слоя, распределяются диффузно, с постепенно убывающей плотностью заряда.
Таким образом, при соприкосновении металла с водой ионы его находятся под действием двух конкурирующих сил: электростатического притяжения, возникающего между ионами металла и молекулами воды (явление гидратации), и электростатического притяжения со стороны электронного газа, определяющего прочность кристаллической решетки.
Вполне понятно, что чем прочнее кристаллическая решетка металла, тем труднее иону металла перейти в раствор. Чем выше величина энергии гидратации, тем с большей жадностью молекулы воды взаимодействуют с этими ионами, и тем легче им выделиться в раствор.
В результате взаимодействия двух указанных взаимно противоположных сил растворение металла в воде приобретает характер только поверхностного процесса и охватывает лишь очень узкую область на границе металл—жидкость. В этом поверхностном слое концентрация ионов металла, несмотря на его чрезвычайно малую растворимость, может быть довольно значительной. Кроме того, в поверхностном растворе гидратированные катионы в силу электростатических сил притяжения со стороны электронов кристаллической решетки металла совершают лишь ограниченное кинетическое движение в виде так называемых «пристенных» скачков. Они прочно связаны с жестким каркасом кристаллической решетки металла.
Таким образом, в системе металл — вода на границе раздела фаз возникает двойной электрический слой, блокирующий поверхность металла. Образовавшаяся пограничная разность потенциалов получила название электродного потенциала (дат. potentia — возможность, мощь).
Если жидкая среда — чистая вода, для всех металлов картина в качественном отношении будет однозначной: металл заряжается отрицательно, прилегающий слой жидкости — положительно. Однако количественно для разных металлов будут наблюдаться существенные различия, что объясняется не только неодинаковой энергией связи катионов этих металлов в кристаллической решетке, но и неодинаковой гидратируемостью этих катионов.
Несколько иная картина наблюдается в случае, если металлическую пластинку погрузить не в чистую воду, а в раствор соли этого металла. При этом могут иметь место три случая.
1. Исходная концентрация ионов данного металла в растворе С меньше концентрации Со, соответствующей равновесному состоянию ионов после погружения в раствор металлической пластинки, т. е. С С0. В этом случае наблюдается обратное явление: ионы металла из раствора выделяются на поверхности металлической пластинки. Чтобы ионы металла могли выделиться, они должны присоединить электроны согласно уравнению (б). Поскольку источника электронов в системе нет, выделение металла на поверхности пластинки происходит в виде ионов. В результате поверхность приобретает положительный заряд.
3. При условии С=С0 вся система будет находиться в состоянии подвижного равновесия, разность потенциалов между жидкостью и металлом равна нулю. В этом случае из раствора осаждается на единицу поверхности металла столько же катионов, сколько их выходит в двойной электрический слой.
Принимая это во внимание, нетрудно найти математическую зависимость между величиной скачка потенциала на границе соприкосновения металла и раствора и концентрацией (точнее, активностью) ионов этого металла в растворе.
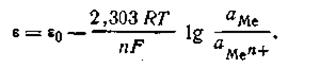 | 4.84 |
Так как активность металла принимается равной единице (аMе= 1), то с учетом этого уравнения (4.84) будет иметь следующее выражение:
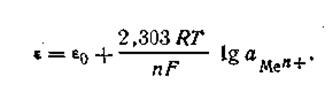 | 4.85 |
Уравнение (4.85) называется уравнением Нернста,
ε0— постоянная величина, характеризующая электрохимическую природу электрода.
Для расчетов удобнее предварительно вычислить значение R·T· 2,303/F при какой-либо температуре. Например, при 291 К это число будет равно 0,0577. Следовательно, для температуры 291 К уравнение Нернста будет иметь вид:
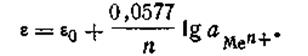 | 4.86 |
Обозначим численное значение выражения R·T·2,303/F буквой Ж.
Зависимость этого числа от температуры выразится следующей формулой:
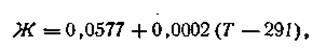 | 4.87 |
где Г —любая температура, при которой производится измерение разности потенциалов. С учетом этого обозначения уравнение электродного потенциала Нернста будет иметь следующий вид:
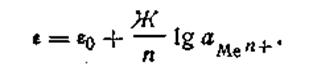 | 4.88 |

обращается в нуль, и тогда
 | 4.89 |
Таким образом, стандартным (нормальным) потенциалом называется такой потенциал, который возникает на металлической пластинке, находящейся в контакте с одноименными ионами в растворе, с концентрацией С=1 моль/л.
За нулевую точку измерения потенциалов условно принят нормальный потенциал водородного электрода. Для изготовления его используют способность платины растворять газообразный водород. Платиновая проволока или пластинка, содержащая растворенный водород, играет роль «водородной пластинки», а функции «раствора солей» может выполнять любой водный раствор, в котором всегда присутствуют ионы водорода Н + . Причем нормальный потенциал водородного электрода равен нулю при условии, что давление молекулярного водорода на пластинке равно 101,325 кПа и СН+ = 1 моль/л.
Если нормальный потенциал какого-либо металла больше водородного, его принято считать положительным, если меньше — отрицательном.
Если все металлы расположить последовательно по возрастающей величине их нормальных электродных потенциалов, получится ряд напряжений. В табл. 4.9 приведены стандартные потенциалы некоторых металлов.
В этой таблице каждый электрод обозначен символом элемента, из которого он состоит, и соответствующего иона, а вертикальная линейка изображает поверхность раздела двух фаз, где имеет место скачок потенциала.
Представленным в табл. 4.9 рядом напряжений широко пользуются в практике при составлении так называемых гальванических элементов, а также при изучении взаимодействия между металлами и кислотами, между солями и металлами. Зная ряд напряжений, можно предвидеть направление реакции вытеснения одних элементов другими. Так металлы, стоящие в ряду напряжений после водорода, не способны вытеснять водород из кислот. Вытеснение металла из солей другим металлом осуществляется только в том случае, если вытесняющий металл расположен в ряду напряжений до вытесняемого.
Например, при составлении гальванического элемента из цинка и свинца в качестве положительного электрода следует взять свинцовый (εо= -0,13 В), а в качестве отрицательного — цинковый (εо= -0,76 В).
|
Электроды подразделяются на электроды первого и второго рода. Электроды первого рода — это электроды из металла, погруженного в раствор, содержащий ионы того же металла (например, Cu|Cu 2+ , Zn|Zn 2+ ). Эти электроды обратимо обменивают катионы Ме↔Ме n + nе, где n — число теряемых (или приобретаемых) электронов (е — ).
Электроды второго рода состоят из металла, покрытого слоем труднорастворимой соли и погруженного в раствор какой-либо легкорастворимой соли с тем же анионом. Такие электроды обратимы относительно этого аниона.
Для электродов второго рода выражение электродного потенциала
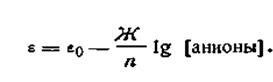 | 4.90 |
Дата добавления: 2016-02-20 ; просмотров: 2583 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Электрохимические процессы. Электродный потенциал ряд стандартных электродных потенциалов металлов. Уравнение Нернста.
Все электрохимические процессы можно разделить на две противоположные группы: процессы электролиза, при которых под действием внешнего источника электроэнергии происходят химические реакции, и процессы возникновения электродвижущей силы и электрического тока вследствие определенных химических реакций.
В первой группе процессов электрическая энергия превращается в химическую, во второй ‒ наоборот, химическая ‒ в электрическую.
Примерами процессов обоих типов могут быть процессы, происходящие в аккумуляторах. Так, при работе свинцового аккумулятора генератора электрической энергии происходит реакция:
Вследствие этой реакции освобождается энергия, которая и превращается в электрическую. Когда аккумулятор разрядится, его заряжают, пропуская через него электрический ток в обратном направлении.
В обратном направлении протекает и химическая реакция:
В этом случае электрическая энергия превратилась в химическую. Теперь аккумулятор снова имеет запас энергии и снова может разряжаться.
Все электрохимические реакции происходят при протекании электрического тока в цепи. Этот круг обязательно состоит из последовательно соединенных металлических проводников и раствора (или расплава) электролита. В металлических проводниках, как мы знаем, ток переносят электроны, в растворе электролитов ‒ ионы. Непрерывность протекания тока в цепи обеспечивается только тогда, когда происходят процессы на электродах, т.е. на границе металл ‒ электролит На одном электроде происходит процесс приема электронов ‒ восстановление, на втором электроде — процесс отдачи электронов, т.е. окисления.
Особенностью электрохимических процессов, в отличие от обычных химических, является пространственное разделение процессов окисления и восстановления. Из этих процессов, которые не могут происходить друг без друга, и состоит в целом химический процесс в электрохимической системе.
Если погрузить металлическую пластинку (электрод) в раствор электролита, то между пластинкой и раствором возникает разность потенциалов, которая называется электродного потенциала.
Рассмотрим причины его возникновения. В узлах кристаллической решетки металла содержатся только положительно заряженные ионы. Благодаря их взаимодействию с полярными молекулами растворителя, они отрываются от кристалла и переходят в раствор. Вследствие такого перехода в металлической пластинке остается избыток электронов, отчего она приобретает отрицательный заряд. Положительно заряженные ионы, которые перешли в раствор благодаря электростатическому притяжению, остаются непосредственно у поверхности металлического электрода. Образуется двойной электрический слой. Между электродом и раствором возникает скачок потенциала, который и называется электродным потенциалом.
Наряду с переходом ионов из металла в раствор происходить и обратный процесс. Скорость перехода ионов из металла в раствор V1 может быть больше скорость обратного перехода ионов из раствора в металл V2 (V2 ˃ V1).
Такая разница в скоростях приведет в результате к уменьшению количества положительных ионов в металле и увеличению их в растворе. Металлический электрод приобретает отрицательный заряд, раствор ‒ положительного.
Чем больше разница V1‒V2, тем более негативным будет заряд металлического электрода. В свою очередь величина V2зависит от содержания ионов металла в растворе; большим их концентрациям соответствует большая скорость V2. Следовательно, с увеличением концентрации ионов в растворе уменьшается отрицательный заряд металлического электрода.
Если, наоборот, скорость перехода ионов металла в раствор будет меньше скорость обратного процесса (V1 2+ из раствора в металл. Увеличится разница V1‒V2 (которая в состоянии равновесия равна нулю), и новое количество ионов цинка перейдет из металла в раствор. Это обусловит появление избытка электронов в цинковой пластинке, которые немедленно переместятся к медной пластинки, и опять все будет непрерывно повторяться. Вследствие этого цинк растворяться, а в кругу непрерывно протекать электрический ток.
Понятно, что непрерывное перемещение электронов от цинковой пластинки к медной возможно только тогда, когда они асимилируют на медной пластинке. Появление избытка электронов в медной пластинке приведет к перестройке двойного слоя. Отрицательные ионы SO4 2- отталкиваться, а положительные ионы меди, которые есть в растворе, будут заходить в двойной электрический слой благодаря электростатическому притяжению, обусловленном появлением электронов. Скорость процесса перехода ионов в металлV2 увеличится. Ионы Сu 2+ проникать в кристаллическую решетку медной пластинки, присоединяя электроны. Именно этот процесс ассимиляции электронов на медной пластинке обеспечит непрерывность процесса в целом.
Величина ЭДС Е равна разности электродных потенциалов Е1и Е2 на электродах: Е = Е1‒Е2.
Процессы, которые происходят на электродах, можно изобразить схемой: на грани цинковая пластинка ‒ электролит Zn ‒ 2е — = Zn 2+ , на грани медная пластинка электролит Сu 2+ + 2е — = Сu.
Как видим, процессы окисления цинка и восстановление меди разделены в пространстве, они происходят на разных электродах. В целом химическую реакцию, которая происходит в медно-цинковом элементе, можно записать в ионной форме так:
Zn + Сu 2+ = Zn 2+ + Сu.
Такая же картина будет наблюдаться и в том случае, когда обе пластинки будут заряжены отрицательно относительно раствора. Погрузим две медные пластинки в разбавленные растворы сульфата меди. Концентрация ионов меди в этих растворах С1 и С2 (С2 > С1). Предположим, что обе пластинки зарядятся негативно относительно растворов. Но пластинка А в сосуде с концентрацией раствора С1 зарядится более негативно благодаря тому, что концентрация ионов меди в этом сосуде меньше, чем во второй сосуде, и соответственно скорость проникновения ионов Сu 2+ в кристаллическую решетку будет меньше. Если замкнуть круг, то электроны будут перемещаться от пластинки А, где их плотность больше, к пластинке В. На грани пластинки А с электролитом происходить процесс Сu° ‒ 2е — = Сu 2+ , на грани пластинки В с электролитом Сu 2+ + 2е — + Сu°.
Обе пластинки, как было уже отмечено, заряжены отрицательно относительно раствора. Но пластинка А заряжена отрицательно относительно пластинки В и поэтому в гальваническом элементе выполнять роль отрицательного электрода, а пластинка В ‒ положительного.
Величина ЭДС, равной разности электродных потенциалов, будет тем больше, чем больше разница концентраций ионов в растворах.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.









Если в формулу Нернста подставить числовые значения констант 


http://helpiks.org/7-14677.html
http://zdamsam.ru/a28343.html