Оксид серы (IV)
Оксид серы (IV) – это кислотный оксид . Бесцветный газ с резким запахом, хорошо растворимый в воде.
Cпособы получения оксида серы (IV)
1. Сжигание серы на воздухе :
2. Горение сульфидов и сероводорода:
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например , сульфит натрия взаимодействует с серной кислотой:
4. Обработка концентрированной серной кислотой неактивных металлов.
Например , взаимодействие меди с концентрированной серной кислотой:
Химические свойства оксида серы (IV)
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя .
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов .
Например , оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например , оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например , при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
Оксид серы (IV) SO2, сернистый газ
Взаимодействуя с кислородом, сера образует два оксида:
- SO2 (IV) — сернистый газ (сернистый ангидрид, диоксид серы)
- SO3 (VI) — серный ангидрид
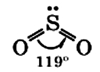
Молекула сернистого газа сильно полярна, угловой формы (угол между связями составляет 119°):
Физические свойства сернистого газа:
- бесцветный ядовитый газ с резким запахом;
- в 2 раза тяжелее воздуха;
- хорошо растворим в воде — при н.у. в 1 объеме воды растворяется 40 объемов SO2 (IV) с образованием сернистой кислоты.
Химические свойства сернистого газа
Сернистый газ является типичным кислотным оксидом.
- сернистый газ реагирует с основаниями с образованием гидросульфитов (кислые соли) и сульфитов (средние соли):
- реакции сернистого газа с основными оксидами:
- с водой образует сернистую кислоту, которая существует только в растворе и относится к двухосновным кислотам:
Ступенчатая диссоциация сернистой кислоты с образованием гидросульфит-иона на первой ступени диссоциации, и сульфит-иона — на второй:
- пример реакции сернистой кислоты в качестве восстановителя:
- пример реакции сернистой кислоты в качестве окислителя:
Сернистая кислота может образовывать средние соли (сульфиты) — Na2SO3, и кислые соли (гидросульфиты) — NaHSO3.
В окислительно-восстановительных реакциях сернистый газ может выступать, как в роли окислителя (восстанавливаясь в S и H2S), так и в роли восстановителя (окисляясь в H2SO4), т.к. сера в этом соединении занимает промежуточную степень окисления +4.
- в реакции с сероводородом сернистый газ является окислителем:
- в реакции с кислородом при нагревании сернистый газ является восстановителем:
Получение и применение сернистого газа
В промышленности сернистый газ получают или сжиганием серы, или как побочный продукт обжига сульфидных руд, например, железного колчедана.
В лабораторных условиях диоксид серы можно получить действием концентрированных кислот на соли сернистой кислоты (гидросульфиты и сульфиты), а также в процессе реакции серной кислоты с тяжелым металлом.
Сернистый газ используют для:
- получения оксида серы (VI);
- получения серной кислоты;
- получения сульфитов и гидросульфитов;
- отбеливания тканей в текстильной промышленности;
- уничтожения вредных микроорганизмов в качестве дезинфицирующего средства при консервировании продуктов питания.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Оксиды серы. Общая характеристика, химические свойства
Большинство школьников знают два оксида серы — SO2 и SO3.
Однако, это не все соединения, которые сера образует с кислородом.
Рассмотрим их все.
Монооксид серы — SO
- Встречается только в виде разбавленной газовой фазы;
- после концентрирования превращается в S2O2 (диоксид дисульфита);
- SO имеет триплетное основное состояние, схожее с таковым у O2 , то есть каждая молекула имеет по два неспаренных электрона;
- молекула SO используется в реакциях органического синтеза (встраивается в молекулы алкенов, алкинов, диенов для получения молекул с трехчленными кольцами, содержащими серу);
- монооксид серы обнаружен на Ио — спутнике Юпитера, а также в атмосфере Венеры, в комете Хейла — Боппа (или «Большая комета 1997 года»);
- редко встречается в атмосфере Земли, поэтому токсичность в полной мере не выявлена;
- обладает высокой воспламеняемостью, горит до образования ядовитого сернистого газа SO2.
Дисульфид серы — SO2
- Токсичный газ, ответственен за запах сгоревших спичек;
- в природе образуется в результате вулканической активности;
- вне Земли встречается в атмосфере Венеры, где образует облака в результате конденсации, способствуя при этом глобальному потеплению на п ланете; а также на Ио, спутнике Юпитера (90% атмосферы)
- промышленное значение сернистого газа в основном заключается в производстве серной кислоты;
- SO2 может связываться с ионами металлов в качестве лиганда с образованием комплексов диоксида серы с металлом, обычно там, где переходный металл находится в степени окисления 0 или +1;
- обладает антимикробными свойствами, используется в качестве консерванта для кураги, инжира (E220);
- диоксид серы издавна применяется в производстве вина — служит антибиотиком и антиоксидантом, защищая вино от порчи и потемнения (окисления);
- сернистый газ является сильным восстановителем, при этом обладает отбеливающим эффектом;
- эндогенный диоксид серы играет важную физиологическую роль в регуляции работы сердца и кровеносных сосудов, а нарушение его метаболизма может привести к артериальной гипертензии, атеросклерозу, стенокардии.
Триоксид серы, серный ангидрид — SO3
- Является значительным загрязнителем, основной компонент кислотных дождей;
- имеет большое значение в промышленности, так как является прекурсором серной кислоты;
- в сухой атмосфере обильно дымит, без запаха, но едкий;
- на воздухе образуется прямым окислением сернистого газа;
- в лаборатории триоксид серы можно получить путем двухстадийного пиролиза бисульфата натрия:
- 2NaHSO4 → Na2S2O7 + H2O
Na2S2O7 → Na2SO4 + SO3
- серный ангидрид агрессивно гигроскопичен — теплота гидратации достаточна, чтобы смесь этого газа и древесины (или хлопка) могла воспламениться;
- при вдыхании вызывает ожоги, обладает высокой коррозионной активностью.
Тетроксид серы — SO4
- Этот оксид серы представляет собой группу химических соединений с формулой SO3 + Х, где Х лежит между 0 и 1;
- здесь содержатся пероксогруппы (О-О), а степень окисления серы как в триоксиде серы, +6;
- может быть выделен при низких температурах (78 К), после реакции SO3 с атомарным кислородом или фотолиза смесей SO3 — озон.
Монооксид дисеры, субоксид серы — S2O
- Представляет собой бесцветный газ, который при конденсации образует твердое вещество бледного цвета, нестабильное при комнатной температуре;
- Грамотрицательные бактерии Desulfovibrio desulfuricans способны производить S2O;
- был обнаружен Питером Шенком в 1933 году.
Пoсле краткого обзора оксидов серы прилагаю таблицу двух важнейших оксидов серы — сернистого газа и серного ангидрида, так как именно они по большей части встречаются в заданиях ЕГЭ и ОГЭ по Химии.
http://prosto-o-slognom.ru/chimia/503_oksid_sery_SO2.html
http://pangenes.ru/post/oksidy-sery-obshchaya-harakteristika-himicheskie-svoystva.html