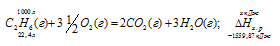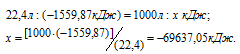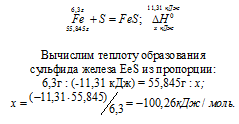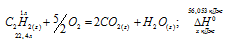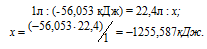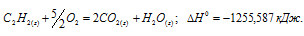Допишите уравнение реакции горения этана (C2H6) в кислороде и расставьте коэффициенты: C2H6 + O2 = … + …
Такое уравнение было в задании 5, но, раз уж задача стоит, разберём детально:
C2H6 + O2 = H2O + CO2
Первое, что бросается в глаза: слева у нас два атома углерода, а справа – один. Пробуем уравнять
C2H6 + O2 = H2O + 2CO2
Теперь водород:
C2H6 + O2 = 3H2O + 2CO2
Как видим, получается, что справа у нас 3 + 2*2 = 7 атомов кислорода. А слева двухатомная молекула кислорода. Делать нечего, умножаем коэффициенты на два:
2C2H6 + O2 = 6H2O + 4CO2
Теперь справа мы имеем 6 + 4*2 = 14 атомов кислорода, значит, перед молекулой кислорода можем поставить коэффициент 7.
2C2H6 + 7O2 = 6H2O + 4CO2
Правильный расчет теплового эффекта реакций и теплот образования веществ
Тепловой эффект реакции
Задание 95.
Реакция горения бензола выражается термохимическим уравнением:
С6Н6(ж) + 15/2О2(г) = 6СО2(г) + 3Н2О(г); 
Вычислите тепловой эффект этой реакции, если известно, что молярная теплота парообразования бензола равна +33,9 кДж. Ответ: —3135,58 кДж.
Решение:
∆H°С6Н6(парообр.) = +33,9 кДж/моль;
∆H°С6Н6(г) = +82,9 кДж/моль;
∆H°Н2О = -241,98 кДж/моль;
∆H°СО2 = -393,51 кДж/моль;
(С6Н6(ж) → (С6Н6(г); ∆H = +33,9 кДж;
ΔН = ?
Зная мольную теплоту парообразования и мольную теплоту образования газообразного бензола, рассчитаем мольную теплоту образования жидкого бензола из соотношения:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:
Ответ: ΔН = -3136 кДж.
Задание 96.
Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения 1 моля этана С2Н6(г), в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 1 м 3 этана в пересчете на нормальные условия? Ответ: 63742,86 кДж.
Решение:
Уравнение реакции горения этана имеет вид:
С2Н6 (г) + 31/2O2 = 2СО2(г) + 3Н2О (ж); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:
Рассчитаем теплоту, выделяющуюся при сжигании 1м 3 этана из пропорции:
Ответ: . Q = 69637,05 кДж.
Теплота образования вещества
Задание 97.
Реакция горения аммиака выражается термохимическим уравнением:
4NH3(г) + 3O2 (г) = 2N2(г) + 6Н2O(ж); 
Ответ: —46,19 кДж/моль.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном дав-лении Qp равные изменению энтальпии системы 

Термохимическое уравнение реакции имеет вид:
4NH3(г) + 3O2 (г) = 2N2(г) + 6Н2O(ж); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:



Отсюда вычислим теплоту образования NH3:
4 


4 
4

Ответ: –46,19 кДж/моль.
Задание 98.
При взаимодействии 6,3 г железа с серой выделилось 11,31 кДж теплоты. Вычислите теплоту образования сульфида железа ЕеS. Ответ: —100,26 кДж/моль.
Решение:
Уравнение реакции имеет вид:
Ответ: —100,26 кДж/моль.
Задание 99.
При сгорании 1 л ацетилена (н.у.) выделяется 56,053 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксида углерода. Вычислите теплоту образования С2Н2(г). Ответ. 226,75 кДж/моль.
Решение:
Уравнение реакции горения ацетилена имеет вид:
Рассчитаем теплоту, выделяющуюся при сжигании 1моль ацетилена из пропорции:
Термохимическое уравнение реакции горения ацетилена будет иметь вид:
Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:




Отсюда вычислим теплоту образования С2Н2:




Ответ: 226,75 кДж/моль.
Задание 100.
При получении молярной массы эквивалента гидроксида кальция из СаО(к) и Н2О(ж) выделяется 32,53 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования оксида кальция. Ответ: –635,6 кДж.
Решение:
Так как молярная масса эквивалента гидроксида кальция равна 1/2M(Са(ОН)2), то при по-лучении 1моль его выделится 65,06 кДж теплоты (2 . 32,53 = 65,06).
Термохимическое уравнение получения гидроксида кальция из СаО(к) и Н2О(ж) будет иметь вид:
СаО(к) + Н2О(ж) = Са(ОН)2(к); 
Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:




Отсюда вычислим теплоту образования С2Н2:





Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://buzani.ru/zadachi/khimiya-shimanovich/914-teplovoj-effekt-reaktsii-teplota-obrazovaniya-veshchestv-zadanie-95-100 http://acetyl.ru/o/a31b2b.php |