Лабораторные органическая химия. Лабораторная работа 1 окси, оксокислоты гидроксикарбоновые кислоты опы Свойства молочной кислоты
| Название | Лабораторная работа 1 окси, оксокислоты гидроксикарбоновые кислоты опы Свойства молочной кислоты |
| Анкор | Лабораторные органическая химия .doc |
| Дата | 22.04.2017 |
| Размер | 0.81 Mb. |
| Формат файла |  |
| Имя файла | Лабораторные органическая химия .doc |
| Тип | Лабораторная работа #5376 |
| страница | 3 из 3 |
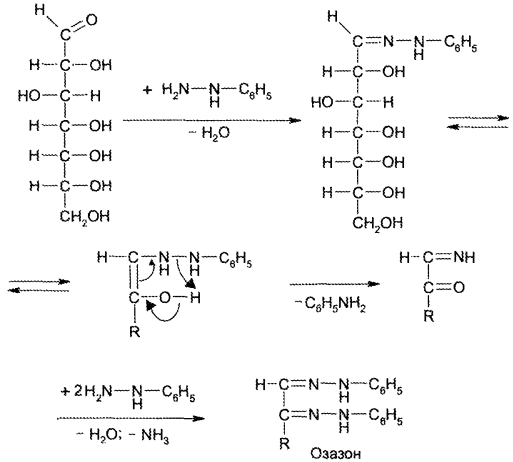
| Подборка по базе: Лабораторная работа-раб с вирт машинами.docx, курсовая работа.docx, Конттрольная работа по дисциплине Документирование.docx, Практическая работа.docx, Проектная работа.docx, ПРАКТИЧЕСКАЯ РАБОТА №1 ЗаданиеИностранный язык. Английский. Част, иностранный язык письменная работа.docx, Курсовая работаЭкономика организации.docx, Практическая работа Русский язык.docx, Лабораторная работа №1.pdf Опыт 27. Реакции на гидроксильные группы дисахаридов 27.2. Ацилирование дисахаридов (тяга). В сухой пробирке смешивают 0,5 г безводной лактозы и 0,5 г безводного ацетата натрия. К полученной смеси приливают 2,5 мл уксусного ангидрида, содержимое пробирки перемешивают и нагревают 5 мин при непрерывном встряхивании. Реакционную смесь охлаждают на воздухе и выливают в стакан с водой и льдом при тщательном перемешивании: По какому механизму идет эта реакция? Опыт 28. Реакции дисахаридов по карбонильной группе. Сравнение свойств восстанавливающих и невосстанавливающих дисахаридов Схема реакции окисления мальтозы реактивом Фелинга: Положительную реакцию с фелинговой жидкостью дают восстанавливающие дисахариды (мальтоза и лактоза), в водных растворах которых вследствие таутомерных переходов имеются свободные альдегидные группы. Раствор, содержащий сахарозу, при нагревании до начинающегося кипения не изменяет своей окраски, так как сахароза относится к невосстанавливающим дисахаридам и не окисляется реактивом Фелинга. Следует помнить, что длительное кипячение раствора сахарозы в щелочной среде приводит к ее расщеплению, и продукты гидролиза могут восстанавливать реактив Фелинга до оксида меди (I). Напишите уравнение реакции окисления лактозы реактивом Фелинга. 28.2. Получение фенилозазонов мальтозы и лактозы. В две сухие пробирки помещают по 100 мг (на кончике шпателя) смеси солянокислого фенилгидразина и безводного ацетата натрия (1:3). Затем в одну пробирку добавляют 1 мл 1%-ного раствора мальтозы, а в другую — 1 мл 1%-ного раствора лактозы при тщательном перемешивании. Пробирки помещают на кипящую водяную баню на 15—20 мин. При охлаждении на воздухе, а потом в стакане со льдом в реакционной смеси выпадают кристаллы фенилозазонов мальтозы и лактозы.
Напишите уравнение реакции образования фенилозазона лактозы. Кристаллы фенилозазонов мальтозы и лактозы рассматривают под микроскопом. Кристаллы озазона мальтозы имеют форму игл, частично образующих сферические скопления, а кристаллы фенилозазона лактозы — форму пластинок, образующих розетки. Зарисуйте кристаллы фенилозазонов мальтозы и лактозы в рабочий журнал. Опыт 29. Гидролиз (инверсия) сахарозы Для доказательства гидролитического расщепления сахарозы необходимо провести реакции, подтверждающие наличие в содержимом пробирки продуктов гидролиза. Для этого содержимое пробирки делят на две части. Первую часть раствора нейтрализуют 10%-ным раствором гидроксида натрия (контроль по универсальной индикаторной бумаге), а затем добавляют равный объем реактива Фелинга и нагревают верхнюю часть жидкости. Наблюдают образование красного осадка оксида меди (I). Для сравнения нагревают смесь исходного раствора сахарозы с равным объемом реактива Фелинга. Окраска раствора не изменяется. Этот опыт показывает, что в результате гидролиза сахарозы, не способной восстанавливать реактив Фелинга, образуется смесь моносахаридов, окисляющихся фелинговой жидкостью. Со второй частью гидролизата проводят реакцию Селиванова на наличие фруктозы, входящей в состав сахарозы (см. опыт 26.1). Опыт 30. Реакция сахарозы с сульфатами кобальта и никеля 3.3. ВЫСШИЕ ПОЛИСАХАРИДЫ В две пробирки наливают по 1 мл 1%-ных растворов полисаха-Ридов: в первую — крахмала, во вторую — гликогена. Затем добавляют равный объем реактива Фелинга. Жидкости тщательно перемешивают и нагревают верхнюю часть растворов до начинающегося кипения. Цвет растворов не изменяется. Молекулы полисахаридов содержат в своем составе большое число соединенных друг с другом при помощи гликозидных связей остатков моносахаридов. Молекулы крахмала (амилоза и амилопектин) содержат в среднем от 1000 до 300000 остатков D-глюкозы, в гликогене число остатков D-глюкозы доходит до нескольких миллионов. Однако в макромолекулах амилозы и амилопектина содержится всего по одному свободному гликозидному гидроксилу, который в растворе может дать альдегидную группу, поэтому концентрация альдегидных групп в растворе настолько мала, что крахмал не восстанавливает реактив Фелинга. В молекулах гликогена общее число глюкозных остатков выше, чем в молекулах амилопектина, поэтому он, как и крахмал, не обладает восстанавливающими свойствами. Опыт 32. Взаимодействие крахмала и гликогена с иодом Реакция крахмала и гликогена с иодом представляет собой сложный процесс. Синюю окраску с иодом дает амилоза — одна из фракций крахмала. Амилоза — полисахарид линейного строения, состоящий из остатков а, D-глюкопиранозы. Ее молекулы имеют структуру спирали, внутри которой есть свободный канал диаметром около 5 мкм, в него внедряются молекулы иода, образуя окрашенные комплексы («соединения включения») за счет взаимодействия с гидроксильными группами моносахаридных остатков. При нагревании молекулы амилозы теряют свою спиралевидную структуру, и окрашенные комплексы разрушаются, при охлаждении спиралевидная структура амилозы и, следовательно, окрашенные комплексы восстанавливаются. Для полисахаридов с разветвленными цепями (амилопектин и гликоген) наряду с процессами образования комплексов большое значение имеет процесс адсорбции иода на поверхности боковых цепей. Если боковые цепи в молекуле гликогена короткие, то развивается бурая окраска, если они длинные, то темно-красная. Опыт 33. Гидролиз крахмала Реактивы и оборудование: 1%-ный раствор крахмала, 10%-ный раствор серной кислоты, разбавленный раствор иода в иодиде калия (раствор Люголя), 10%-ный раствор гидроксида натрия, реактив Фелинга, универсальная индикаторная бумага; конические колбы на 100 мл, пипетки, мерные цилиндры на 50 и 10 мл, пробирки. Схема гидролиза крахмала: После того как реакционная смесь перестанет давать окраску с иодом, ее кипятят еще несколько минут, охлаждают и нейтрализуют 10%-ным раствором гидроксида натрия (контроль по универсальной индикаторной бумаге). Отливают в пробирку 1—2 мл гидролизата и добавляют равный объем реактива Фелинга. Верхнюю часть жидкости нагревают на пламени горелки до начинающегося кипения. Выпадает красный осадок оксида меди (I), что свидетельствует о наличии в растворе продуктов глубокого гидролиза крахмала — глюкозы и мальтозы. Напишите уравнения реакций окисления продуктов гидролиза крахмала фелинговой жидкостью. Опыт 34. Кислотный гидролиз клетчатки Реактивы и оборудование: концентрированная серная кислота, 10%-ный раствор гидроксида натрия, реактив Фелинга, универсальная индикаторная бумага; мелко нарезанная фильтровальная бумага, стеклянные палочки, водяные бани, пробирки. В сухую пробирку помещают несколько мелко нарезанных кусочков фильтровальной бумаги и приливают 1 мл концентрированной серной кислоты. Содержимое пробирки тщательно перемешивают стеклянной палочкой до полного разрушения бумаги и образования бесцветного вязкого раствора. После этого к нему осторожно при перемешивании по каплям добавляют 1 мл дистиллированной воды. Пробирку ставят на кипящую водяную баню. Смесь нагревают 10—15 мин при регулярном перемешивании. После охлаждения жидкость нейтрализуют 10%-ным раствором гидроксида натрия (контроль по универсальной индикаторной бумаге) и проводят с ней реакцию с фелинговой жидкостью (см. опыт 55.3) для обнаружения в продуктах гидролиза восстанавливающих Сахаров. Напишите уравнение реакции гидролиза целлюлозы и объясните опыт. Лабораторная работа №4 Опыт 35. Получение фурфурола и его свойства Фурфурол образуется из пентозанов, которые вместе с клетчаткой входят в состав древесины: С полученным раствором фурфурола проводят некоторые реакции. 35.2. На полоску фильтровальной бумаги наносят каплю анилина. В это же место добавляют каплю уксусной кислоты, а затем раствора фурфурола. Появляется пятно, окрашенное в красный цвет. 35.3. В пробирку наливают 1 мл аммиачного раствора гидроксида серебра (см. опыт 22.1) и добавляют 1—2 капли раствора фурфурола. Раствор нагревают на горячей водяной бане. Выпадает черный осадок металлического серебра. Напишите уравнение реакции взаимодействия фурфурола с аммиачным раствором гидроксида серебра. Подберите коэффициенты методом электронного баланса. Полоску белой хлопчатобумажной ткани смачивают водой, отжимают, а затем опускают в раствор «белого» индиго. Через несколько минут ткань вынимают, отжимают от избытка раствора и оставляют развешенной на воздухе. Постепенно «белое» индиго окисляется кислородом воздуха, и ткань окрашивается в синий цвет: К капле пиридина осторожно прибавляют концентрированную соляную кислоту. Реакционная смесь сильно разогревается, и выпадает белый осадок. К полученному осадку приливают воду. Наблюдают его растворение. Напишите уравнение реакции пиридина с соляной кислотой. 37.2. Образование солей пиридина. В две пробирки наливают по 1мл 2%-ных растворов хлорида железа (III) и сульфата меди и добавляют по 1—2 капли раствора пиридина, полученного в предыдущем опыте. В пробирке с хлоридом железа (III) выпадает осадок бурого цвета: В пробирке с сульфатом меди сначала выпадает голубой осадок В избытке пиридина осадок гидроксида меди (II) быстро ра- Опыт 38. Мочевая кислота Несколько кристаллов мочевой кислоты растворяют в 1—2 мл соляную кислоту. Сначала выпадают кристаллы малорастворимой Кристаллы мочевой кислоты имеют форму удлиненных призм. Во вторую пробирку добавляют равный объем фелинговой Органическая химия (стр. 5 )
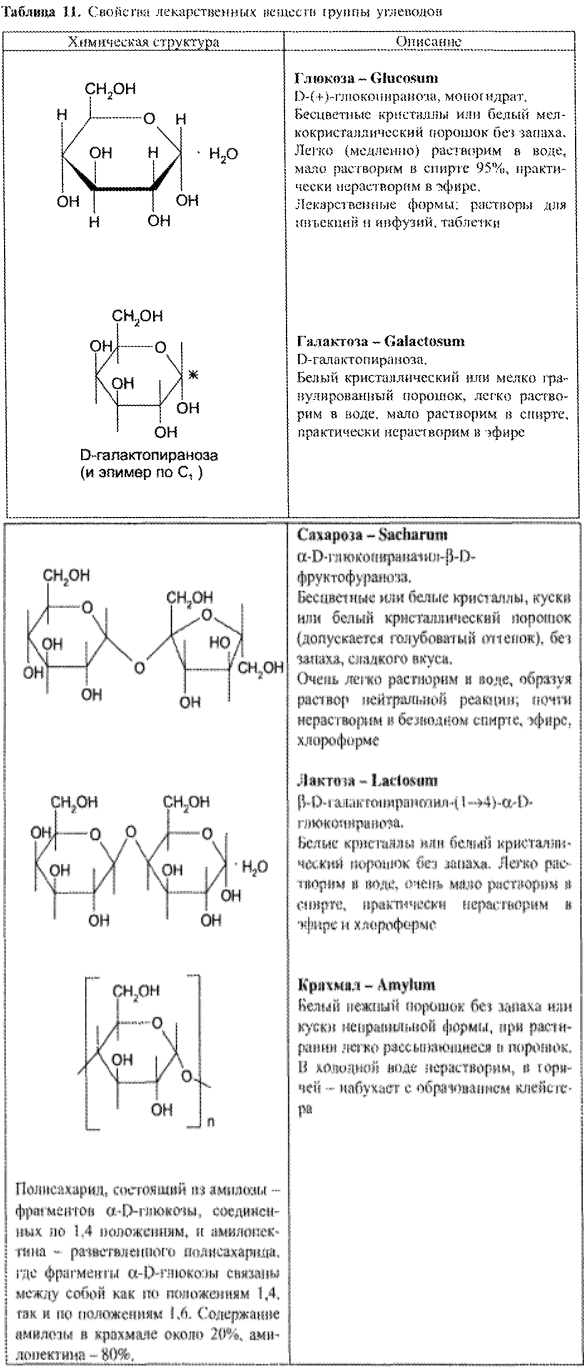
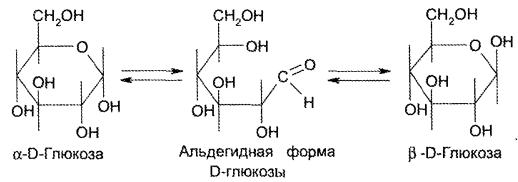
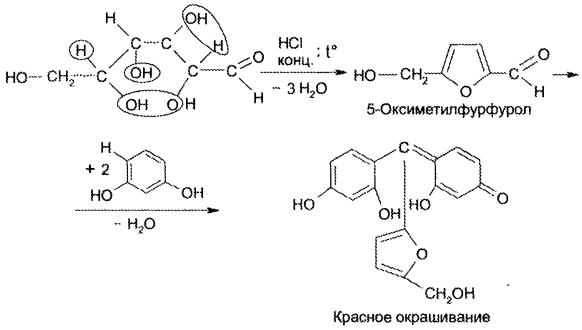
Реактивы: подсолнечное масло, этилацетат (полученный в предыдущем опыте), бензол, этанол, толуол, бензин, тетрахлорметан. Материалы, оборудование: кусочки фильтровальной бумаги, стеклянные палочки. Ход работы: Центральную часть заранее заготовленных кусочков фильтровальной бумаги смочите подсолнечным маслом так, чтобы образовалось небольшое пятно. К центру пятна на бумаге прикоснитесь стеклянной палочкой, наполненной этилацетатом. Палочку держите перпендикулярно к бумаге. По испарении растворителя в центре окажется кружочек чистой, обезжиренной бумаги, а масло расположится на периферии расплывшегося пятна. Это указывает на то, что эфир очень хорошо растворяет подсолнечное масло и способен экстрагировать (извлекать) его из бумаги. Аналогичные опыты проводят и с другими растворителями. Опишите ваши наблюдения по экстракции масла остальными растворителями. Опыт № 3. Омыление жира водно – спиртовым раствором щелочи. Ход работы: В пробирку помещают 1 мл касторового масла, 1 мл этилового спирта, 1 мл 35 % — ного раствора едкого натра. Содержимое пробирки перемешивают и нагревают на пламени спиртовки. Омыление протекает при слабом кипячении в течение 3 – 5 минут. Для выделения мыла из водно – спиртового раствора, содержимое пробирки выливают в фарфоровую чашку и при непрерывном перемешивании добавляют насыщенный раствор хлорида натрия (высаливание мыла). На поверхность в фарфоровой чашке всплывают мыла, которые затем отфильтровывают через слой марли. Образовавшийся фильтрат используют для качественной реакции на глицерин. Условно считая жир тристеаратом глицерина, напишите уравнение реакции его щелочного гидролиза. Как называется вещество, которое вы получили? 1. Какие производные карбоновых кислот называют сложными эфирами? Какие химические соединения называют восками и жирами? Являются ли природные жиры и воски индивидуальными химическими веществами. 2. Как физические свойства жиров зависят от природы углеводородного радикала, входящего в кислотный остаток? 3. Сколько граммов этилацетата можно получить из спирта массой 40 г с массовой долей 96 % и кислоты массой 60 г с массовой долей 40 %, если выход его составляет 90 % от теоретического? Лабораторная работа № 5. Цель: Изучить способы получения и химические свойства углеводов, сформировать умения составлять уравнения реакций с участием моно — и дисахаридов. Научиться проводить химические опыты. Материалы и оборудование: штатив с пробирками, водяная баня, спиртовки, спички. Реактивы: раствор глюкозы, гидрооксид натрия, сульфат меди, раствор глюкозы, известковое молоко, аммиак, раствор сахарозы, раствор мальтозы, серная кислота, соляная кислота (конц), сульфат кобальта, сульфат никеля. Опыт № 1. Реакции на гидроксильные группы в моносахаридах. а).Реакция моносахаридов со щелочным раствором гидроксида меди (II). В пробирку помещает 1-2 капли 1%-ного раствора Д-глюкозы, 3-5 капель 10%-ного раствора гидроксида натрия и 1 каплю 5%-ного раствора сульфата меди(11). Образующийся вначале осадок гидроксида меди (II)( какого цвета?) при встряхивании растворяется и получается прозрачный, раствор (какого цвета?) комплексного глюкозата мед(II). Сравните этот опыт с реакцией образования глицерата меди и комплексной соли двухвалентной меди с солью винной кислоты. Этот опыт повторяют с использованием 1%-ного раствора Д-фруктозы. Напишите уравнение реакции. б). Реакция моносахаридов с раствором гидроксида кальция К 3-5 каплям 20%-ного раствора Д-глюкозы добавляют по каплям при встряхивании известковое молоко. При этом образуется раствор глюкозата кальция. Известковое молоко добавляют в избытке, чтобы в пробирке был осадок, не исчезающий при встряхивании. Через 5 мин. отфильтровывают раствор и через него пропускают медленный ток оксида углерода(IV) из аппарата Киппа. Выпадает белый осадок (какой соли)? При длительном пропускании CO2 осадок вновь раствориться. Почему? Напишите уравнения протекающих реакций. Опыт № 2. Реакции на карбонильные группы в моносахаридах. а). 0кисление моносахаридов в щелочной среде гидроксидом меди (II). В пробирке смешивают 1-2 капли 1%-ного раствора Д-глюкозы и 5-6 капель 10% — ного раствора гидроксида натрия. Затем при встряхивании по каплям добавляют 5%-ный раствор сульфата меди(II) до начала появления неисчезающего осадка. К полученной смеси приливают около I мл воды так, чтобы высота слоя жидкости была 15-20 мл. Затем, держа пробирку наклонно, нагревают ее верхнюю часть до начала кипения, а нижнюю оставляют без нагрева для контроля. Что вы наблюдаете? Опыт повторяют, но с использованием I%-ного раствора Д-фруктозы. Напишите уравнение реакции окисления, глюкозы гидроксидом меди (II). б). Окисление моносахаридов аммиачным раствором оксида серебра. Сначала нужно приготовить аммиачный раствор оксида серебра, (реактив Толленса). Для этого в чисто вымытой пробирке к 3-5 каплям 1%-ного раствора нитрата серебра прибавляют 2 капли 10%-ного раствора гидроксида натрия и 3-5 капель 10%-ного раствора аммиака до растворения первоначально образующемуся осадка гидроксида серебра. К полученному бесцветному раствору прибавляют 1-2 капли 1%-ного раствора Д-глюкозы, и нагревают пробирку в течение 5-10 минут на водяной бане, при температуре 7О-80 °С. Выделяющееся в результате реакций металлическое серебро выпадает либо в виде черного осадка (если пробирку во время нагревания встряхивали), либо в виде зеркального налета на стенках пробирки. Отсюда и название реакция «серебряного зеркала». Напишите уравнения реакций получения аммиачного раствора оксида серебра и окисления Д-глюкозы до Д-глюконовой кислоты. Опыт № 3.Реакции на гидроксильные группы дисахаридов. а). Получение сахарата кальция. Повторяют опыт «1б» с использованием 20 % ного раствора сахарозы, но в отфильтрованный раствор не пропускают СО2, а просто нагревают до кипения. При этом выпадает мелкокристаллический осадок сахарата кальция, который после охлаждения вновь растворяется. Напишите уравнение реакции образования моносахарата кальция. б). Реакция дисахаридов с гидроксидом меди ( II) в щелочной среде. Повторяют опыт «1а» с использованием 1%-ных растворов сахарозы и мальтозы. Напишите уравнение реакции образования моносахарата меди(II), получившейся при взаимодействии сахарозы с гидроксидом меди (П). Какие выводы можно сделать из опытов? в). Гидролиз сахарозы. Помещают в пробирку 2-3 капли I%-ного раствора сахарозы, I каплю 10%-ного раствора серной кислоты и 5-6 капель воды. Полученный раствор осторожно при постоянном встряхивании кипятят в течение 1-2 мин.’, охлаждают и делят на две части. К первой половине раствора прибавляет 5-6 капель 10%-ного раствора гидроксида натрия, а затем равный объем реактива Фелинга и нагревают верхнюю часть жидкости до начинающегося кипения. Что образуется в нагретой части раствора? Объясните, почему раствор приобрел восстанавливающую способность? Напишите уравнение гидролиза сахарозы. Ко второй части раствора гидролизата сахарозы добавляют 2 капли 1%-ного раствора резорцина, 2 капли конц. соляной кислоты и нагревают смесь до кипения (реакция Селиванова). Происходит ли изменение окраски раствора? На присутствие какого вещества указывает положительная проба Селиванова? Для сравнения проводят реакцию Селиванова с 1%-ным раствором сахарозы. Опыт№ 4. Цветные реакции на дисахариды. а). Реакции сахарозы с сульфатами никеля(II) и кобальта(II). В две пробирки наливают по 3-5 капель 10%-ного раствора сахарозы и по 1 капле 10%-ного раствора гидроксида натрия. Затем в одну пробирку добавляют 1-2 капли 5%-ного раствора сульфата кобальта(II), а в другую 5%-ного раствора сульфата никеля(.11)- Какие изменения в окраске растворов вы наблюдаете? Лабораторная работа №6. Цель: практически подтвердить свойста углеводов. Сформировать умения составлять уравнения реакций с участием полисахаридов. Научиться проводить химические опыты. Материалы и оборудование: штатив с пробирками, спиртовки, асбестовая сетка, спички, вата, фильтровальная бумага. Реактивы: крахмальный клейстер, йод в йодиде калия, серная кислота, реактив Швейцера, соляная кислота (конц), серная кислота (конц), гидросульфат натрия, сульфат меди, гидроксид натрия. Опыт№ 1. Реакции крахмала с йодом. В пробирку наливают 5 капель 1%-ного раствора крахмального клейстера и I каплю раствора йода в иодиде калия, разбавленного водой до светло-желтого цвета. В какой цвет окрашивается раствор? Что происходит с окраской при нагревании раствора до кипения и после охлаждения? Йодкрахмальная реакция применяется в химии для открытия как крахмала, так и йода. Опыт № 2. Кислотный гидролиз крахмала. В 7 пронумерованных пробирок наливает по 3 капли раствора йода в иодиде калия, разбавленного водой до светло-желтого цвета, и ставят их в штатив. В первую пробирку вносят 1-2 капли 1%-ного раствора крахмального клейстера и отмечают образовавшуюся окраску. Затем в коническую колбу емкостью 50 мл наливают 10 мл 10%-ного раствора серной кислоты 10 мл 1%-ного крахмального клейстера, перемешивают, нагревают на асбестовой сетке над небольшим пламенем горелки. Через 30 сек. после начала кипения смеси отбирают пипеткой пробу (1-2 мин), добавляют во 2-ую пробирку, встряхивают и отмечают цвет смеси. Аналогичные отборы продолжают через каждые 30 секунд и отмечают постепенное изменение окраски растворов при реакции с йодом. После того как реакционная смесь перестанет давать окраску с йодом, смесь кипятят еще 2-3 минуты, охлаждают и нейтрализуют 10%- ным раствором гидроксида натрия. Затем в пробирке смешивают около 0.5 мл реактива Фелинга и нагревают верхнюю часть жидкости до начинающегося кипения. Какие изменения вы наблюдаете? Напишите уравнение реакции гидролиза крахмала. Объясните, почему в процессе гидролиза изменяется окраска гидролизата с йодом. Углеводы. Фармацевтический анализ углеводов» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»> УГЛЕВОДЫ Углеводы составляют обширную группу природных веществ, выполняющих в растительных и животных организмах разнообразные функции. Углеводы получают главным образом из растительных источников. Это связано с тем, что углеводы являются первичными продуктами фотосинтеза, осуществляемого растениями из оксида углерода и воды. Углеводы представляют своеобразный мост между неорганическими и органическими соединениями. Название – «углеводы» возникло потому, что многие представители этого класса имеют общую формулу Сn(Н2О)m, и формально могут быть отнесены к «гидратам углерода». Наиболее значимым ЛС данной группы является глюкоза. К группе углеводов относятся также сахароза, лактоза, галактоза и крахмал (табл. 11). Требования НД к качеству глюкозы как лекарственному средству соответствуют требованиям к химически чистым веществам. Характерными физическими свойствами глюкозы являются следующие: – определённая форма крупных или мелких кристаллов, оптическая активность с сильно выраженным вращением плоскости поляризации (удельное вращение 10% раствора глюкозы +52,3°), Тпл безводной глюкозы. Для глюкозы, которую получают в виде моногидрата, количество кристаллизационной воды является показателем качества ЛС. Содержание кристаллизационной воды должно составлять 10% от массы глюкозы моногидрата. Определение удельного вращения глюкозы имеет свои особенности. В свежеприготовленных растворах глюкозы происходит мутаротация (изменение во времени величины угла вращения; через определенный временной интервал эта величина становится постоянной). Мутаротацию можно ускорить путем прибавления к раствору глюкозы раствора аммиака (не более 0,1%). Если определять угол вращения глюкозы сразу после ее растворения и без прибавления к раствору аммиака, то этот показатель составит +109,16° и конечного значения +52,3° достигнет только через несколько часов. Явление мутаротации объясняется тем, что при растворении глюкозы, которая в кристаллическом состоянии находится в какой-либо одной циклической форме, образуется ее альдегидная форма, через которую получаются аномерные циклические формы глюкозы: α и β – формы, различающиеся расположением полуацетального гидроксила относительно 1-го углеродного атома. Для α -D-глюкозы величина угла вращения составляет +109,6°, а для β-D-глюкозы +20,5°. Конечное значение угла вращения соответствует состоянию равновесия между α- и β – формами, которые через альдегидную форму в растворе превращаются друг в друга: ХИМИЧЕСКИЕ СВОЙСТВА Глюкоза и галактоза относятся к моносахаридам, сахароза и лактоза — к олигосахаридам, крахмал — к полисахаридам. Моносахариды, являясь веществами с двойственными функциями, вступают во многие реакции, характерные для спиртов и карбонильных соединений (альдегидов). Олигосахариды и полисахариды подвергаются гидролизу (ферментативному или кислотному) с образованием соответствующих моносахаридов. Реакции на спиртовые гидроксилы Как многоатомные спирты глюкоза, галактоза, сахароза и лактоза (подобно этиленгликолю и глицерину) способны взаимодействовать с меди (II) гидроксидом с образованием комплексных соединений синего цвета (химизм – см. с. 100). Лекарственные вещества группы углеводов способны также к реакциям этерификации. Реакции на альдегидную группу Окисление, В зависимости от условий окисления моносахариды превращаются в различные продукты, В щелочной среде моносахариды окисляются под воздействием таких мягких окислителей, как реактивы Толленса и Фелинга (химизм – см. с, 107). С реактивом Толленса проходит реакция «серебряного зеркала», которая характерна для альдегидов. Следовательно, в эту реакцию моносахариды вступают в своей открытой (альдегидной) форме. С реактивом Фелинга моносахариды образуют Сu2О красно-оранжевого цвета. И в этом случае моносахарид реагирует в открытой форме за счет альдегидной труппы. Обе реакции используются для обнаружения моносахаридов (например, глюкозы) в биологических жидкостях (кровь, моча). Гликозиды и другие производные углеводов, не содержащие по- луацет:шьного гидроксила., не могут переходить в альдегидную форму и поэтому не обладают восстанавливающей способностью и не дают реакций с указанными реактивами. В нейтральной среде окислению подвергается только альдегидная группа. При этом образуются альдоновые кислоты, которые в кислой среде, отщепляя воду, превращаются в лактоны. Образование озазонов. При нагревании моносахаридов с фенил- гидразином сахара превращаются в кристаллические соединения, плохо растворимые в воде, — озазоны. На 1-й стадии образуется фенилгидразон, который перегруппировывается в ходе внутримолекулярной окислительно-восстановительной реакции в моноимин 1,2-дикарбонильного соединения. Из последнего образуется озазон: Озазоны — кристаллические вещества желтого цвета с четкой Тпл Реакция образования озазонов широко используется для установления подлинности сахаров, а также для выделения их из смесей. АНАЛИЗ ИНДИВИДУАЛЬНЫХ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ Глюкоза (декстроза) Подлинность. ФС в качестве испытания подлинности приводит реакцию окисления глюкозы реактивом Фелинга (химизм — см. с. 107). Известны и другие чувствительные и специфические реакции на глюкозу, не включенные в НД. Так, преобразование глюкозы в ме- тилфурфурол является чувствительной реакцией, которая основана на получении фурфурола из глюкозы при действии концентрированных серной или хлороводородной кислот с одновременным взаимодействием фурфурола с каким-либо фенолом (резорцином, тимолом, а-нафтолом) или ароматическим амином: С меди (II) сульфатом глюкоза при подщелачивании (без нагревания!) образует растворимый фиолетово-синий комплекс; при стоянии раствора происходит окислительно- восстановительная реакция с выделением Сu2О. Таким образом, одновременно доказывается наличие и альдегидной, и спиртовых функциональных групп. Регламентируется также определение удельного вращения. Измерение угла вращения проводят после прибавления к испытуемому раствору 2 капель раствора аммиака для предотвращения мутаротации. Чистота, Статья ГФ на глюкозу включает стандартные испытания: прозрачность и цветность раствора, кислотность, присутствие хлоридов, сульфатов, кальция, бария, декстрина, мышьяка. Растворы для инъекций дополнительно проверяют на пирогенность. Количественное определение. ГФ не регламентирует количественное определение субстанции. В препаратах глюкозы, в частности в растворах для инъекций, глюкозу определяют поляриметрически. Сахароза Сахароза является невосстанавливающим дисахаридом (олигосахаридом), так как образование гликозидной связи произошло за счет полуацетальных гидроксилов глюкозы и фруктозы. Поэтому сахароза не окисляется (в обычных условиях) реактивами Толленса и Фелинга. Сахароза — самый распространенный дисахарид, главный источник углеводов в пище человека. В фармации сахарозу применяют в виде сиропа — средство для улучшения вкуса. Подлинность. Как многоатомный спирт сахароза образует с раствором кобальта (И) нитрата в присутствии эквивалентного количества натрия гидроксида комплекс фиолетового цвета. Британская фармакопея (2001) регламентирует регистрацию ИК- спектра, а также ТСХ с использованием в качестве свидетелей стандартного образца сахарозы и других дисахаридов. Чистота. Определение проводят так же, как у глюкозы. Количественное определение не проводят. Лактоза Подлинность. У лактозы гликозидная связь образована между полуацетальным и спиртовым (С4) гидроксилами, поэтому подлинность лекарственного вещества доказывают прибавлением при нагревании реактива Фелинга. В результате выпадает кирпично-красный осадок меди (I) оксида (химизм — см. с. 107). Чистота, Определение проводят так же, как у глюкозы. источники: http://pandia.ru/text/80/192/8360-5.php http://farmf.ru/lekcii/uglevody-farmatsevticheskij-analiz-uglevodov/ |