«Уравнение состояния идеального газа»
Самостоятельная работа в 2 вариантах.Предназначена для учеников 10 общеобразовательного класса, для закрепления темы Уравнение состояния идеального газа, газовые законы.
Просмотр содержимого документа
«»Уравнение состояния идеального газа»»
Уравнение состояния идеального газа. Вариант 1
1.Баллон вместимостью 40 л содержит 1,98 кг углекислого газа. Баллон выдерживает давление не выше 30·10 5 Па. При какой температуре возникает опасность взрыва?
2.Какое давление рабочей смеси установилось в цилиндрах двигателя внутреннего сгорания, если к концу такта сжатия температура повысилась с 47 до 367˚С, а объем уменьшился с 1,8 до 0,3 л? Первоначальное давление было 100кПа.
3.Определить плотность азота при температуре 27˚С и давлении 100 кПа.
4.Как изменится давление идеального газа при увеличении его объема в 2 раза и уменьшении абсолютной температуры в 4 раза.
5. Одинакова для обоих вариантов.
1.Газ массой 16г при давлении 1МПа и температуре 112˚С занимает объем 1,6 л. Определите, какой это газ.
2.Рассчитайте плотность кислорода при температуре 12˚С и давлении 10 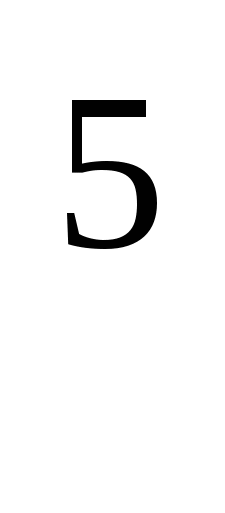
3.Определите массу водорода, находящего в баллоне вместимостью 20 л под давлением 830 кПа при температуре 17˚С.
4. Как изменится давление идеального газа при уменьшении его объема в 2 раза и увеличении абсолютной температуры в 4 раза.
Самостоятельная работа по теме «Уравнение состояния идеального газа. Газовые законы»
Просмотр содержимого документа
«Самостоятельная работа по теме «Уравнение состояния идеального газа. Газовые законы»»
(Ф-10) Самостоятельная работа по теме
«Уравнение состояния идеального газа. Газовые законы»
Записать математически уравнение Менделеева-Клапейрона. Пояснить смысл величин.
Понятие изотермического процесса.
Понятие изохорного процесса.
Сформулировать и записать математически закон Гей-Люссака.
Каково давление сжатого воздуха, находящегося в баллоне вместимостью 20 л при 12 0 С, если масса этого воздуха 2 кг, а молярная масса 0, 029 кг/моль.
(Ф-10) Самостоятельная работа по теме
«Уравнение состояния идеального газа. Газовые законы»
Записать математически уравнение Клапейрона. Пояснить смысл величин.
Понятие изобарного процесса.
Сформулировать и записать математически закон Бойля-Мариотта.
Какое количество вещества содержится в газе, если при давлении 200 кПа и температуре 240 К его объём равен 40 л.
(Ф-10) Самостоятельная работа по теме
«Уравнение состояния идеального газа. Газовые законы»
Записать математически уравнение Менделеева-Клапейрона. Пояснить смысл величин.
Понятие изотермического процесса.
Понятие изохорного процесса.
Сформулировать и записать математически закон Гей-Люссака.
Каково давление сжатого воздуха, находящегося в баллоне вместимостью 20 л при 12 0 С, если масса этого воздуха 2 кг, а молярная масса 0, 029 кг/моль.
(Ф-10) Самостоятельная работа по теме
«Уравнение состояния идеального газа. Газовые законы»
Записать математически уравнение Клапейрона. Пояснить смысл величин.
Понятие изобарного процесса.
Сформулировать и записать математически закон Бойля-Мариотта.
Какое количество вещества содержится в газе, если при давлении 200 кПа и температуре 240 К его объём равен 40 л.
Самостоятельная работа по теме «Уравнение состояния идеального газа. Газовые законы»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Самостоятельная работа № 6
Тема «Уравнение состояния идеального газа. Газовые законы»
Задания обязательного уровня
Относительной молекулярной массой вещества называется…
Число молекул любого количества вещества определяется по формуле:
1) n = 

3. Количество вещества обозначается:
4. Постоянная Авогадро равна:
1) 1,38∙10 -23 

5. Процесс в газе, который происходит при постоянной массе и неизменном давлении называется…
6. Уравнение изохорного процесса:
1) 

7. График закона Бойля – Мариотта

8. Формула закона Клапейрона – Менделеева:
1) p = nkT ; 2) E = 

9. Единица измерения молярной массы вещества:
1) кг/моль; 2) моль; 3) моль/кг; 4) кг.
10. Термодинамическая температура вычисляется по формуле:
1) t = T + 273; 2) t = 273 – T ; 3) T = t + 273; 4) T = 273 — t
Задания дополнительного уровня
При давлении 2∙10 5 Па объем воздуха 4 л. Найти его объем при давлении 3∙10 5 Па.
В сосуде объемом 83 л находится 20 г водорода при температуре 27 0 С. Определить его давление.
13 * . Изменится ли средняя квадратичная скорость молекул азота, если температура газа увеличится в 4 раза?
Задания обязательного уровня
1. Молярной массой вещества называют…
2. Количество вещества вычисляется по формуле:
1) ν = 


3. Число молекул любого количества вещества обозначают:
1) n ; 2) N A ; 3) M ; 4) N
4. Постоянная Больцмана равна:
1) 1,38∙10 -23 

5. Процесс в газе, который происходит при постоянной массе газа и неизменной температуре называется…
6. Уравнение закона Гей – Люссака:
1) 

7. График изохорного процесса:

8. Объединенный газовый закон:
1) p = nkT ; 2) E = 

9. Единица измерения количества вещества:
1) кг/моль; 2) моль; 3) моль/кг; 4) кг.
10. Средняя кинетическая энергия поступательного движения молекул вычисляется по формуле:
1) υ = 

Задания дополнительного уровня
Газ занимал объем 3∙10 -3 м 3 при температуре 460 К. После изобарного сжатия температура газа понизилась до 130 К. До какого объема сжали газ?
12. Определить температуру газа в сосуде при давлении 5∙10 5 Па, если его концентрация 6∙10 25 м -3 .
13 * . В резервуаре объемом 3000 л находится пропан (С 3 Н 8 ), количество вещества которого 140 моль, а температура 300 К. Какое давление оказывает газ на стенки сосуда?
Задания обязательного уровня
1. Один моль – это …
2. Молярная масса вещества вычисляется по формуле
1) M = m 0 N A ; 2) M = 

3. Концентрация молекул обозначается:
4. Универсальная газовая постоянная равна:
1) 1,38∙10 -23 

5. Уравнение закона Шарля:
1) 

6. График закона Гей – Люссака:

7. Перемешивание газов жидкостей и твердых тел называют …
8. Основное уравнение МКТ:
1) 

9. Единица измерении термодинамической температуры:
1) 0 C ; 2) м/с; 3) Дж; 4) К
10.Средняя квадратичная скорость движения молекул вычисляется по формуле:
1) υ = 


Задания дополнительного уровня
11. Давление газа в сосуде при температуре 10 0 С равно 4∙10 5 Па. Каким станет давление в сосуде при повышение температуры до 200 0 С?
12. Вычислить кинетическую энергию молекул газа, находящихся под давлением 180 кПа, если его концентрация 3∙10 25 м -3 .
13 * . Концентрация молекул газа уменьшилась в 2 раза, а средний квадрат скорости движения молекул увеличился в 4 раза. Изменилось ли давление газа? Как?
Задания обязательного уровня
1. Идеальным газом называют такой газ, в котором …
2. Относительная молекулярная масса вычисляется по формуле:
1) M = m 0 N A ; 2) ν = 

3. Масса молекулы обозначается:
4. Процесс в газе, который происходит при постоянной массе газа и неизменном объеме называется …
5. Уравнение закона Бойля – Мариотта:
1) 

6. График изобарного процесса:

7. Формула, выражающая зависимость давления газа от его температуры:
1) p = nkT ; 2) p = 
8. Единица измерения средней квадратичной скорости движения молекул:
1) Дж; 2) м/с; 3) м 3 ; 4) м/с 2
9. Число молекул любого количества вещества определяется по формуле:
1) N A = 

10. Постоянная Лошмидта равна:
1) 1,38∙10 -23 

Задания дополнительного уровня
11. Кислород при температуре 31 0 С и давлении 2∙10 5 Па изохорно охладили, после чего давление стало равно 10 5 Па. До какой температуры охладили кислород?
12. Определить массу молекулы водорода при температуре 0 0 С, если ее средняя квадратичная скорость равна 1800 м/с
13 * . При изотермическом процессе давление газа уменьшилось в 3 раза. Изменилась ли концентрация молекул газа в сосуде? Как?
Задания обязательного уровня
Количество вещества равно… .
Средняя квадратичная скорость движения молекул определяется по формуле
1) ν = 


Какое явление, названное затем его именем, впервые наблюдал Роберт Броун
беспорядочное движение отдельных молекул;
беспорядочное движение отдельных атомов;
беспорядочное движение мелких твердых частиц в жидкости;
все три явление перечисленные в ответах а-в
Универсальная газовая постоянная равна
1) 1,38∙10 -23 

Уравнение закона Бойля-Мариотта
1) 

График закона Шарля

Объединенный газовый закон
1) p = nkT ; 2) pV = 


Единица измерения средней кинетической энергии поступательного движения молекул
1) 0 C ; 2) м/с; 3) Дж; 4) К
Молярная масса вещества вычисляется по формуле
1) M = m 0 N A ; 2) M r = 

Постоянная Авогадро обозначается
1) n ; 2) N A ; 3) M ; 4) N
II . Задания дополнительного уровня
Газ занимал объем 5∙10 -3 м 3 при температуре 360 К. Какой стала температура газа после изобарного сжатия газа до объема 2∙10 -3 м 3 ?
Какое количество вещества содержится в газе, если при давлении 200 кПа и температуре 240 К его объем равен 40 л?
13 * . При изобарном процессе концентрация молекул газа в сосуде увеличилась в 5 раз. Изменилась ли средняя кинетическая энергия молекул?
Задания обязательного уровня
Средняя кинетическая энергия поступательного движения молекул вычисляется по формуле
1) E = 

Первое положение МКТ
Термодинамическая температура обозначается
1) t; 2) m; 3) T; 4) k
Уравнение Менделеева — Клапейрона
1) p = nkT ; 2) pV = 


Единица измерения массы молекулы вещества
1) кг; 2) кг / моль; 3) Дж; 4) моль
Постоянная Авогадро равна
1) 1,38∙10 -23 

Уравнение закона Гей – Люссака
1) 

График изотермического процесса

Относительная молекулярная масса вещества вычисляется по формуле
1) M = m 0 N A ; 2) M r = 

Задания дополнительного уровня
При сжатии газа его объем уменьшился с 8 до 5 л, а давление стало равным 60 кПа. Найти первоначальное давление газа.
12. Определить давление газа на стенки сосуда, если его концентрация 2∙10 25 м -3 , средняя квадратичная скорость движения молекул 2000 м/с, а масса молекулы 3∙10 -27 кг.
13 * . Метеорологический шар, заполненный водородом, поднялся на высоту, где температура воздуха 0 0 С. Давление внутри шара 1,5∙10 5 Па. Какова плотность водорода внутри шара?
Задания обязательного уровня
Постоянной Авогадро называют …
2. Количество вещества вычисляется по формуле:
1) N = 


3. Постоянная Больцмана равна:
1) 6,02∙10 23 

4. Молярная масса вещества обозначается:
1) n ; 2) N A ; 3) M ; 4) N
5. Единица измерения давления газа:
1) кг; 2) м 3 ; 3) Дж; 4) Па
6. Второе положение МКТ.
7. График закона Гей – Люссака:

Уравнение изотермического процесса:
1) 

9. Основное уравнение МКТ:
1) 

10.Средняя кинетическая энергия поступательного движения молекул вычисляется по формуле
1) R = N A k; 2) υ = 

II .Задания дополнительного уровня
11. При сжатии газа, давление которого 50 кПа, его объем уменьшился с 7 до 3 л. Каким стало давление газа?
В баллоне вместимостью 0,03 м 3 находится газ под давлением 1,35∙10 6 Па при температуре 455 0 С. Какой объем занимал бы этот газ при нормальных условиях?
13 * . В первом сосуде находится водород, во втором – кислород. Чему равно отношение 
Задания обязательного уровня
2. Давление газа вычисляется по формуле:
1) р = 


3. Постоянная Лошмидта равна:
1) 1,38∙10 -23 

4. Универсальная газовая постоянная обозначается:
1) k ; 2) N A ; 3) R ; 4) T
5. Единица измерения объема газа:
1) кг; 2) м 3 ; 3) Дж; 4) Па
6. Третье положение МКТ.
7. График изобарного процесса:

Уравнение изобарного процесса:
1) 

9. Формула, выражающая зависимость давления газа от его температуры:
1) p = nkT ; 2) p = 
10. Число молекул любого количества вещества определяется по формуле:
1) N = 

II .Задания дополнительного уровня
11. Газ находится в сосуде при температуре 25 0 С равно 4∙10 5 Па. Каким было первоначальное давление газа, если при повышении температуры до 100 0 С, его давление стало равно 4∙10 5 Па?
12. При какой температуре средняя кинетическая энергия поступательного движения молекул газа будет равно 5,71∙10 -20 Дж?
13 * . Какое давление производят пары ртути в баллоне ртутной лампы объемом 3∙10 -3 м 3 при 200 К, если в ней содержится 1000 молекул?
http://multiurok.ru/files/samostoiatelnaia-rabota-po-teme-uravnenie-sostoian.html?list-125-b0.html
http://infourok.ru/samostoyatelnaya-rabota-po-teme-uravnenie-sostoyaniya-idealnogo-gaza-gazovye-zakony-4022746.html




