Методы и примеры балансирования химических уравнений
балансировка химических уравнений подразумевает, что все элементы, присутствующие в указанном уравнении, имеют одинаковое количество атомов на каждой стороне. Для достижения этого необходимо использовать методы уравновешивания, чтобы назначить стехиометрические коэффициенты, подходящие для каждого вида, присутствующего в реакции..
Химическое уравнение — это представление посредством символов того, что происходит в ходе химической реакции между двумя или более веществами. Реагенты взаимодействуют друг с другом, и в зависимости от условий реакции в качестве продукта будет получено одно или несколько различных соединений..
При описании химического уравнения необходимо учитывать следующее: во-первых, вещества с реагентами пишутся в левой части уравнения, за которыми следует однонаправленная стрелка или две противоположные горизонтальные стрелки, в зависимости от типа проводимой реакции. накидка.
- 1 Методы уравновешивания химических уравнений
- 1.1 Баланс химических уравнений методом проб и ошибок (также называется проверкой или пробой)
- 1.2 Алгебраическое уравновешивание химических уравнений
- 1.3 Скользящее окислительно-восстановительное уравнение (ионно-электронный метод)
- 2 Примеры балансировки химических уравнений
- 2.1 Первый пример
- 2.2 Второй пример
- 2.3 Третий пример
- 3 Ссылки
Методы балансировки химических уравнений
Принимая за основу то, что реагенты и продукты известны, и что их формулы правильно выражены на той стороне, которая им соответствует, мы переходим к уравновешиванию уравнений в соответствии со следующими методами..
Балансировка химических уравнений методом проб и ошибок (также называется проверкой или пробой)
Он основан на стехиометрии реакции и пытается попытаться использовать разные коэффициенты, чтобы сбалансировать уравнение при условии, что выбраны наименьшие возможные целые числа, при которых одинаковое число атомов каждого элемента получается с обеих сторон. реакции.
Коэффициент реагента или продукта — это число, которое предшествует его формуле, и это единственное число, которое может быть изменено при балансировке уравнения, поскольку изменение индексов в формулах изменит идентичность соединения. в вопросе.
Посчитайте и сравните
После определения каждого элемента реакции и размещения его на правильной стороне, мы приступаем к подсчету и сравнению количества атомов каждого элемента, присутствующего в уравнении, и определяем те, которые должны быть сбалансированы.
Затем мы продолжаем балансировку каждого элемента (по одному за раз), помещая целые коэффициенты, предшествующие каждой формуле, содержащей несбалансированные элементы. Обычно сначала уравновешиваются металлические элементы, затем неметаллические элементы и, наконец, атомы кислорода и водорода..
Таким образом, каждый коэффициент умножает все атомы предыдущей формулы; поэтому, уравновешивая элемент, другие могут разбалансировать, но это исправлено, поскольку реакция уравновешена.
Наконец, последним подсчетом подтверждается, что все уравнение правильно сбалансировано, то есть подчиняется закону сохранения материи..
Алгебраическая балансировка химических уравнений
Чтобы использовать этот метод, установлена процедура для обработки коэффициентов химических уравнений как неизвестных системы, которая должна быть решена..
Во-первых, конкретный элемент реакции берется в качестве ссылки, а коэффициенты помещаются в виде букв (a, b, c, d . ), которые представляют неизвестные, в соответствии с существующими атомами этого элемента в каждой молекуле (если вид не содержит этот элемент помещается «0»).
После получения этого первого уравнения определяются уравнения для других элементов, присутствующих в реакции; будет столько же уравнений, сколько и элементов в указанной реакции.
Наконец, неизвестные определяются одним из алгебраических методов редукции, выравнивания или замещения, и получаются коэффициенты, которые приводят к правильно сбалансированному уравнению.
Балансирующие окислительно-восстановительные уравнения (ионно-электронный метод)
Сначала общая (несбалансированная) реакция переводится в свою ионную форму. Затем это уравнение делится на две полуреакции: окисление и восстановление, каждая из которых балансируется в зависимости от количества атомов, их типа и зарядов этих.
Например, для реакций, которые происходят в кислой среде, добавляют молекулы H.2Или сбалансировать атомы кислорода и добавить H + сбалансировать атомы водорода.
Напротив, в щелочной среде добавляется равное количество ионов ОН — по двум сторонам уравнения для каждого иона H + , и где возникают ионы H + и ОН — они собираются вместе, чтобы сформировать молекулы H2О.
Добавить электроны
Затем вы должны добавить столько электронов, сколько необходимо для уравновешивания зарядов, после уравновешивания вещества в каждой полуреакции..
После прокрутки каждой полуреакции они добавляются и завершаются балансированием окончательного уравнения методом проб и ошибок. В случае различий в количестве электронов в двух полуреакциях, один или оба должны быть умножены на коэффициент, равный этому числу.
Наконец, необходимо подтвердить, что уравнение включает в себя одинаковое количество атомов и атомы одинакового типа, в дополнение к одинаковым зарядам на обеих сторонах глобального уравнения.
Примеры балансирующих химических уравнений
Первый пример
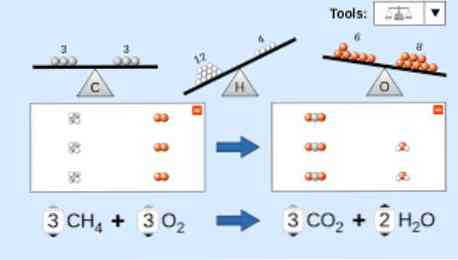
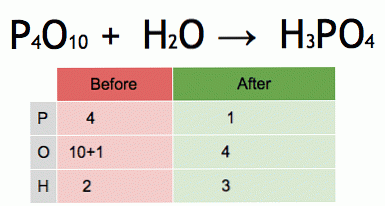
Это анимация сбалансированного химического уравнения. Пентоксид фосфора и вода превращаются в фосфорную кислоту.
P4O10 + 6 H2O → 4 H3PO4 (-177 кДж).
Второй пример
У вас есть реакция сгорания этана (несбалансированная).
Используя метод проб и ошибок, чтобы уравновесить его, мы видим, что ни один из элементов не имеет одинаковое количество атомов с обеих сторон уравнения. Таким образом, он начинается с баланса углерода, добавляя два в качестве стехиометрического коэффициента, который сопровождает его на стороне продуктов.
Углерод был сбалансирован с обеих сторон, поэтому мы продолжаем балансировать водород, добавляя три к молекуле воды.
Наконец, поскольку в правой части уравнения семь атомов кислорода и это последний элемент, который еще предстоит сбалансировать, дробное число 7/2 ставится перед молекулой кислорода (хотя в целом предпочтительны целые коэффициенты).
Затем убедитесь, что на каждой стороне уравнения находится одинаковое количество атомов углерода (2), водорода (6) и кислорода (7)..
Третий пример
Окисление железа дихромат-ионами происходит в кислой среде (неуравновешенной и в ее ионной форме).
вера 2+ + Cr2О7 2- → Вера 3+ + Cr 3+
Используя ионно-электронный метод для его балансировки, он делится на две полуреакции.
Окисление: вера 2+ → Вера 3+
Поскольку атомы железа уже сбалансированы (1: 1), электрон добавляется на сторону продуктов, чтобы сбалансировать заряд.
вера 2+ → Вера 3+ + и —
Теперь атомы Cr сбалансированы, добавив два к правой части уравнения. Затем, когда реакция происходит в кислой среде, добавляют семь молекул H.2Или на стороне продуктов, чтобы сбалансировать атомы кислорода.
Чтобы сбалансировать атомы Н, добавляют четырнадцать ионов Н + на стороне реагентов и, после выравнивания материала, заряды уравновешиваются путем добавления шести электронов на одной стороне.
Наконец, добавляются обе полуреакции, но поскольку в реакции окисления присутствует только один электрон, все это должно быть умножено на шесть.
6Fe 2+ + Cr2О7 2- +14H + + 6e — → Вера 3+ + 2Пар 3+ + 7H2O + 6e —
Наконец, электроны должны быть удалены с обеих сторон глобального ионного уравнения, проверяя, что их заряд и вещество правильно сбалансированы.
Балансировка химического уравнения
Балансировка химической реакции — процесс уравнивания количества химических элементов в обеих частях химического уравнения. Это значит, что количество атомов, содержащихся в реагентах, до реакции и после — одинаково.
Калькулятор балансировки химического уравнения
Описание: Онлайн калькулятор для балансировки уравнения химической реакции.
Пример балансировки химического уравнения
Шаг 1.
Сравнить элементы в левой и правой частях
| Элемент | Левая часть | Правая часть |
|---|---|---|
| N | 2 | 1 |
| H | 2 | 3 |
Шаг 2.
Чтобы сбалансировать химическое уравнение, добавьте 2 к правой части.
| Элемент | Левая часть | Правая часть |
|---|---|---|
| N | 2 | 2 |
| H | 2 | 6 |
Шаг 3.
Добавьте 3 к элементу H в левой части уравнения
Уравнение : N2 + 3H2 = 2NH3
Баланс химических реакций
Химический закон сохранения масс гласит: «Масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции».
Это значит, что количество атомов, содержащихся в реагентах, до реакции и после — одинаково.
Любая химическая реакция описывается химическим уравнением. Количество каждого химического элемента в обеих частях уравнения должно быть одинаковым — уравнение должно быть сбалансированным.
В результате взаимодействия газообразного азота и водорода получается аммиак:
Уравнение показывает какие вещества участвуют в реакции и какое вещество получается, но уравнение не дает ответ на вопрос о необходимом количестве реагентов для получения аммиака. Чтобы провести баланс масс, необходимо, чтобы количество одноименных атомов в левой и правой частях уравнения было одинаково. Делается это с помощью простановки коэффициентов перед компонентами уравнения. Например:
- молекула воды Н2О содержит один атом кислорода и два атома водорода;
- молекула воды с катионом 2- 2Н2О содержит 2 атома кислорода и 4 атома водорода, и т.д.
Вернемся к формуле получения аммиака:
Нетрудно заметить, что в левой части находится два атома азота и два атома водорода. В правой части — один атом азота и три атома водорода. Чтобы сбалансировать это уравнение, необходимо его правую часть умножить на 2. После этого в левой части поставить коэффициент 3 для водорода:
Теперь уравнение сбалансировано: в левой части два атома азота и шесть атомов водорода, и в правой части такое же количество атомов азота и водорода.
Разберём ещё один пример.
Дана следующая схема химической реакции:
С алюминием полный порядок — в левой и правой части схемы стоит по одному атому этого металла.
С водородом и хлором прдиётся поработать, поскольку, в левой части схемы стоит по одному атому, а в правой — 3 атома хлора и два водорода. В получившимся отношении 1:2:3 наименьшим общим кратным будет число 6.
Делим 6:1=6; 6:2=3; 6:3=2, и дописываем получившиеся коэффициенты:
Теперь у нас получился «непорядочек» с алюминием, которого в правой части стало 2 атома, а в левой — остался один. Не беда, ничего не мешает нам уравнять кол-во этого металла в левой и правой частях, дописав слева 2:
Теперь полный порядок, о чем свидетельствует замена стрелки на знак равенства.
Следует помнить, что стехиометрические коэффициенты в химическом уравнении (не путать с индексами) показывают не только число молекул, но и число молей, как исходных веществ, так и продуктов их реакции.
Вышеприведенное уравнение показывает, что в результате взаимодействия двух молей алюминия и шести молей хлороводорода образуются два моля хлорида алюминия и три моля водорода. В этом можно убедиться «воочию», если посчитать молярные массы.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
http://wpcalc.com/balansirovka-ximicheskogo-uravneniya/
http://prosto-o-slognom.ru/chimia/19_balans_ch_r.html