Сера плюс гидроксид натрия уравнение
Сера реагирует с гидроксидом натрия по механизму диспропорционирования (самоокисления-самовосстановления). Подобные реакции со щелочью характерны для целого ряда неметаллов, в частности, — галогенов.
Данную реакцию можно использовать для растворения серы в растворе едкого натра или других щелочей.
Раствор серы в едком натре нужен для будущего получения гидроокиси хрома (чтобы после реакции получения Cr(OH)3 в растворе было как можно меньше щёлочи). Провел серию экспериментов.
1. Сначала пробовал растворить серу в щёлочи в таком соотношении:
При 75 °C сера внезапно растворилась, спирт изопропиловый (он в этой смеси нерастворим) на поверхности раствора закипел. Пришлось охладить колбу снаружи струёй воды.
К сожалению, раствор нестабилен. При 60 °C раствор помутнел. В следующий раз попробую растворить серу в меньшем количестве щёлочи.
2. Потом получилось растворить серу в щёлочи в следующем соотношении:
m(NaOH, 43 %) = 82.5 г,
m(S) = 38.4 г,
m(воды) = 10.6 г,
m(C3H7OH) = 1.00 г.
Концентрация серы составила 450 г/л.
3. Увеличил загрузку в 5/3 раза. Вместо 43 % NaOH использовал 50 % и массу спирта уменьшил. Загрузки получились следующие:
m(NaOH, 50 %) = 120 г,
m(S) = 64 г,
m(воды) = 35.1 г,
m(C3H7OH) = 0.50 г.
Так смесь начала сама по себе греться, да ещё с ускорением.
Значит, можно и без плитки обойтись, только условия надо подбирать.
4. Попытался растворить серу в щёлочи в таком соотношении:
• m(NaOH) = 30 г,
• m(S) = 48 г,
• m(воды) = 63.6 г.
Вот только сера растворилась не вся. Промыл остаток, высушил, взвесил. Получилось:
Что примерно соответствует реакции
Концентрация серы составила 494 г/л. А саморазогрев не такой уж сильный оказался. Смесь нагрелась всего на 20°C. Всё равно пришлось греть на плитке.
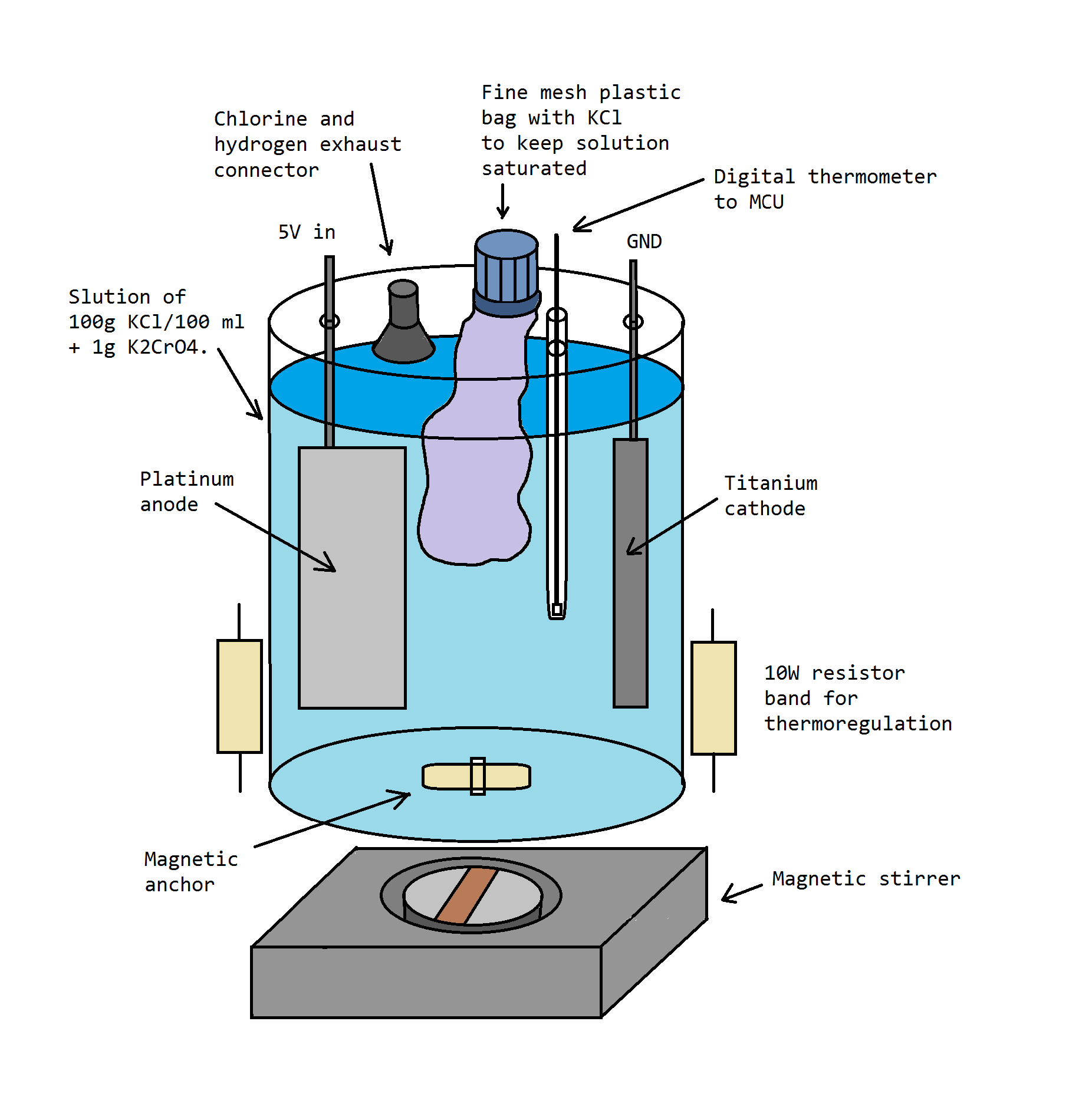
Электролиз насыщенного раствора KCl платинированным и титановым электродом (платинированный электрод брал у американцев на ebay). Пока пробный эксперимент. Небольшой фотоотчёт.
1. «Хлоратная» камера. Из базовых устройств включает в себя систему отвода газов — хлора и водорода (иначе от камеры пахнет больницей на всю квартиру) + опускающаяся в раствор трубка, куда можно поместить измазанную термопастой термопару. Имеется, но не было задействовано приспособление для добавления хлорида калия (во время работы электролизера) — с целью поддержания раствора в насыщенном состоянии.
 2. Стартовый вариант, проработавший на балконе 16 часов. |
 3. Вымороженные в морозилке кристаллы — в ходе одного из циклов. |
 4. Сушка кристаллов, в начале я их просто вычёрпывал ложкой и обсушивал бумажными полотенцами дабы удалить как можно больше влаги с растворённым хлоридом. Относительно «чистый» хлорат очень характерен формой кристаллов: тонкие лёгкие пластинки. |
 5. Потом освоил более продвинутый способ. Валялся слабенький насос от вакуумного пинцета (им поднимают крохотные SMD радиодетальки), оказывается он вполне способен проводить какую-то пародию на вакуумную фильтрацию. Знаю, всё плохо — обязательно куплю воронку Бюхнера и нормальный насос. В качестве фильтра использовалась пластмассовая ткань для тюли, она в отличии от бумаги не раскисает от хлорида/хлората/гипохлорита (за 5 секунд). Здесь же появилась возможность ещё и промыть кристаллы хлората ледяной водой от остатков хлорида. Т.е. прямо «тру» очистка. В итоге получаются еле влажные комки хлората (особенно если ещё надавить на них краями «фильтра» — сушатся в течении 8-ми часов, просто лежа на подоконнике (горячей воды нет, иначе сушил бы на батарее)). |
 6. Выход, конечно, не ахти, изолировать у меня получилось всего 40.5 грамм не самого грязного KClO3. Но это при условии, что я несколько раз «начудил». Где-то половину времени температура в камере была на уровне 75°С, т.к. было холодно ночью, и я укутал камеру полотенцем, а за утро, пока сам спал, температура сильно выросла. Ещё при одной из рекристаллизаций лопнула банка из-под консервации, когда я нагревал её на водяной бане (не ожидал). Сколько мог продукта спас, но то потери были серьёзными. Всего было 5 рекристаллизаций (по тем или иным причинам — неопытности/криворукости). |
 Пару замечаний насчет крепежа. Сейчас запуск производился со шпильками из меди, у меня их много осталось со времён, пока не нашел в продаже нержавеющие. Не лучший выход: крепёж должен быть титановый, но пока не знаю, где его можно купить — в своё время намучился даже с поиском латуни и немагнитной нержавейки, нужны были для работы в сильных магнитных полях где другие металлы раскаляются, как в индукционной грелке. Даже старое видео есть, где когда-то точил их дрелькой из провода. Медь в хлоратной камере чернеет и пассивируется, загрязняет раствор не сильно, а вот болты/шайбы из нержавейки и стоечки из никелированной бронзы — сильно потрепало: |
 Раствор при тестовом запуске хорошо загрязнился, был аж тёмно-серым, но горячая фильтрация и рекристаллизация спасли продукт т.к. примеси в воде не растворялись. Пока что обмотал имеющийся крепёж изолентой, винил по идее от хлора не должен разрушаться. Попробую найти локально титан, но без него особо лучше пока не сделаешь. Планы на будущее примерно такие. Нужна какая-никакая автоматизация, чтобы электролиз прекращался если темпер выше 60°С, и наоборот, чтобы включался нагреватель если камера остывает ниже 40°С. В общем надо добавить термостатирование. Так же хочу добавить хромат калия (по Карякину) [K3], в прошлый раз побрезговал т.к. эта штука сейчас описывается с явной истерикой: мол страшный канцероген + у детей потом будут руки-крюки и заячья губа. И, наверное, главное приспособление — это пластмассовый мешочек, который можно будет всегда наполнять хлоридом через порт сверху, и хлорид не будет опускаться на дно к выпавшему хлорату. Конечная цель — сделать такой девайс, чтобы его можно было оставлять без присмотра и собирать хлорат каждые дней 5. В идеале получая за раз грамм 500. Зачем оно мне? А вроде и не надо, просто интересно. Хлорат, наверное, потом сожгу с сахаром. |
 Продолжу описание экспериментов. Я запнулся при разработке термостата, застрял почти что на 2 недели — хотел сделать его с термопарой, что оказалось весьма непросто. Хотя, в хлоратной камере легко можно было применить вообще любой термистор/транзистор/микросхему (которые до +125°С). Но термопара круче, она до 1200°С и может быть применена ещё много где. В итоге «термопарный термометр» я сделал (и очень хорошо подтянул себя в термопарах), но в установке он применён не был из-за постоянной июльской жары — камера сама по себе без проблем удерживалась в нужном температурном диапазоне. Прототип термопарного термометра вот так выглядит (36°С — это я термопару под язык засунул) и рядом оптосимисторное реле которое может переключать 220V нагрузку мощностью до пары кВт. По логике, оптосимисторных реле было бы 2 штуки, одна включала электролиз в диапазоне 40-60°С (дергая 220V к AXT блоку питания) и вторая включала бы подогрев (электроплитку или другое) когда температура в камере ниже 40°С: |
 Итак. Пока без термостата был проведён ещё один заход, на этот раз в 3-литровой банке. Новую крышку делать не стал, но в отличии от прошлого захода — сшил мешочек для досыпки хлорида калия, который должен удерживать раствор 100% насыщенным 100% времени. Это оказалось ключевым приспособлением, без которой электросинтез хлората крайне неэффективен — всегда реализуйте решение для удержания насыщенности хлоридом. Фото до запуска, пока ещё на подоконнике в комнате: |
 В этот заход похоже производилось не менее, чем 100 грамм KClO3 за период в 24 часа. Первые 2 дня камера работала на насыщение 3-х литров раствора хлоратом, объём очень большой и на дно ничего не выпадало. На 3-й день появился слой из выпавшего хлората и начал интенсивно расти: |
 В течении следующих 3-х дней набралось около 1/4 банки. На 5-й день мой мешочек из шторной тюли растворился в «хлорке» (не ожидал такого), и куча хлорида была по ошибке просыпана сквозь него, в продукт. Ещё 2 дня я гонял камеру без добавления хлорида, дабы ушел тот который на дне. Как правило, 1 досыпка уходит за 1 день. На 7-й день я завершил электролиз, т.к. у нас была семейная поездка в другой город. Банка вот так выглядела, это с перемешиванием (встряской всей банки), так что слой не распушен пузырьками воздуха: |
 Да, камера весьма грязная, т.к. применялись те же несовместимые материалы: болты/гайки из нержавейки, медные шпильки, и никелированные латунные стоечки. В итоге железо опало нерастворимой ржавчиной Fe2O3, а никель и легирующие смеси нержавейки осели неким «зеркалом» на стекле банки. Возможно что-то ещё осталось в растворе. В идеале таки юзать полностью титановый крепёж, но достать его в Украине оказалось как-то очень не просто — хоть ищи кого-то с токарником и точи свой. В любом случае, это проблемы для следующего захода — когда я буду перерабатывать всю систему, включая крышку и крепёж. По возвращении в Киев меня ждала та самая баночка, перед поездкой просто вытащил электроды, но раствор и кристаллы остались. Хлорат не скис (я что-то переживал за это), но, видимо, из-за дневного/ночного термоциклирования трансформировался из пластинок в моноклинные кристаллы. Я слил раствор, достал кристаллы и растворил их в чистой воде, дважды сделал горячую фильтрацию и перекристаллизацию, и затем отсосал продукт на воронке Бюхнера вакуумом, с двойной промывкой водой при 0°С. |
 Товарищ Карякин обещает, что после такой обработки кристаллы хлората получаются квалификации «ч». ( Ю.В. Карякин — Чистые химические реактивы (1947 г) [ссылка] или др. издания — прим. ред.) Выглядели они очень чисто, однако меня смущает факт загрязнения раствора материалом на который крепились электроды. Так что может оно «ч», а может и нет. |
 Да, выход получился 409 грамм хорошо очищенного KClO3, это с неслабой потерей продукта. Упаривание и переработка воды, в которой проводилась рекристаллизация/промывка, — дали ещё 117 грамм чистого хлората калия. В сумме 526 грамм за 7 дней электролиза. Это только с выпавшего хлората в 3-литровой банке при комнатной температуре, маточный раствор я оставил на будущее. Продукт из-за рыхлости очень хорошо поместился в реахимовскую 1-литровую банку и теперь у него там домик. |
 1. Карякинский хромат калия (K2CrO4) добавлять не стал, на 3 литра его бы понадобилось целых 30 грамм. Работать с веществом значительно удобней, зная что там нету никакой канцерогенной пакости. Пара разливов у меня таки были при переработке, и тот оказался бы на ковре. Да, касательно функций хромата или дихромата — много где проскакивает инфа что он не только защищает электроды, но ещё и повышает КПД камеры, в частности — преобразования хлорида в хлорат. Нужно, однако, исследовать просторы книг, каким образом хромат это делает; 2. Переработка продукта заняла немало времени и сил. Первые 409 грамм были получены примерно за вечер интенсивной работы, а вот 117 грамм из отходов выпаривались/выделялись почти что 2 дня неспешной работы. Думаю, есть смысл пускать отходный продукт в утиль и просто дальше запускать камеру. Более того, перерабатывая отходы, — я умудрился треснуть свой любимый боросиликатный стакан на 600 мл, и разбить воронку Бюхнера. Первый по ошибке был поставлен на горячую плитку, а воронка разбилась т.к. я держал её за пробку во время очередной промывки — пробка коническая и воронка просто «уть» и вылетела. Остаток пришлось доработать в «poor man’s» версии Бюхнера. |
 400 грамм чистого продукта каждые 4 дня (из насыщенного хлоридом и хлоратом раствора). Скорее всего, можно чуть улучшить эффективность, подняв ток. Мой ATX блок питания от старого компа давал около 2.8А, тогда как электрод явно сможет выдержать до 3.5А без какого-либо увеличения износа (нужен лучший блок питания). В следующем заходе, планируется таки прикрепить термостат — раз он уже есть. Вместо мешочка применить толстую полиэтиленовую пробирку с мелкими отверстиями для удержания насыщенности хлорида. Также, как-то изготовить 100% титановый крепёж. P.S. Я, правда, только сейчас понял, что хлората мне вообще много и не надо было. Нынешней баночки, если не сжигать налево и направо, — наверное, на года хватит, а тут уже такой индустриальный процесс разработан. |
 К1 Тоководы надо тоже титановые делать, сталь будет корродировать сильно во влажной хлоридной среде. Вместо хромата можно вроде кальций хлористый добавлять, но мне не нравилось, гидроокись выпадает на аноде. К2 Соли хрома надо немного и зависит это от площади электродов, а не от объема раствора (может быть, просто на бОльшие количества раствора берут бОльшей площади электроды, чтобы оно не месяц «кипело», а неделю, отсюда неадекватно много солей хрома). Редко добавляют суммарно более 1-3г. Плохо помню суть реакций, но вроде на одном из электродов должны тонкой пленкой осаждаться соли хрома, мешающие восстановлению соединений хлора, тем самым повышая выход целевого продукта ввиду снижения его потерь на побочных реакциях. Но при их добавлении даже запах реакционного «выхлопа» обычно ощутимо менялся. Главное — не добавлять аммонийные соли хрома. Для подвода питания не нужно никакого титана. Все малостойкие части тщательно и щедро покрываются автомобильным герметиком, которые продаются в тюбиках и держат относительно высокую температуру. После высыхания, если было хорошо обмазано, никаких проблем с воздействием соединений хлора обычно не возникает. К3 Зачем? Хромат нужен в случае графитовых анодов. Оксид серы (IV)Оксид серы (IV) – это кислотный оксид . Бесцветный газ с резким запахом, хорошо растворимый в воде. Cпособы получения оксида серы (IV)1. Сжигание серы на воздухе : 2. Горение сульфидов и сероводорода: 2CuS + 3O2 → 2SO2 + 2CuO 3. Взаимодействие сульфитов с более сильными кислотами: Например , сульфит натрия взаимодействует с серной кислотой: 4. Обработка концентрированной серной кислотой неактивных металлов. Например , взаимодействие меди с концентрированной серной кислотой: Химические свойства оксида серы (IV)Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя . 1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов . Например , оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи): SO2(изб) + NaOH → NaHSO3 Еще пример : оксид серы (IV) реагирует с основным оксидом натрия: 2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду. 3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается. Например , оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая: Сернистый ангидрид обесцвечивает бромную воду: Азотная кислота очень легко окисляет сернистый газ: Озон также окисляет оксид серы (IV): Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия: Оксид свинца (IV) также окисляет сернистый газ: 4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например , при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы: Оксид серы (IV) окисляет угарный газ и углерод: SO2 + 2CO → 2СО2 + S Оксиды серы. Примеры заданий ОГЭ с объяснениями.Задание 1: Дана схема превращений: Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращенное ионное уравнение реакции. Решение: Веществом X должно быть соединение, содержащее ион сульфит (SO3 2- ), которое при реакции с кислотой в результате реакции обмена образует сернистую кислоту. А ты наверняка знаешь, что H2SO3 — слабая кислота, неустойчивая, разлагается на сернистый газ и воду. Значит, первая реакция должна проходить между гидроксидом натрия и сернистым газом: Вторая реакция — сульфит натрия плюс соляная кислота: Это реакция обмена,в результате которой должны образоваться хлорид натрия и сернистая кислота, но, как я указала выше, вместо нее выделяется SO2 и вода. Теперь, когда мы получили сернистый газ, нужно получить серный ангидрид; а это каталитическое окисление: Однако, это не конец задания (нужно всегда читать задания до конца!); для второй реакции необходимо составить сокращенное ионное уравнение: Задание 2: Установите соответствие между исходными веществами и продуктом(-ами) реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Решение: Итак, первая реакция — взаимодействие сернистого газа с водой, я на предыдущем уроке объясняла свойства сернистого газа, поэтому, очевидно, что эта реакция получения сернистой кислоты; ответ А — 5. Вторая реакция — серный ангидрид плюс вода — реакция получения серной кислоты; ответ Б — 4. В третьей реакции оксид серы (IV) реагирует с щелочью,гидроксидом кальция — это реакция обмена, без изменения степени окисления. Исходя из чего, сернистый газ в этом случае даст соль сернистой кислоты и воду; ответ В — 2. Задание 3: Через 80 грамм раствора с массовой долей гидроксида натрия 4% пропустили сернистый газ. При этом образовался сульфит натрия. Вычислите объем (н.у.) вступившего в реакцию газа. Решение: Составляем план решения: 1) Пишем химическую реакцию: 2) Производим действия на основе указанного вещества: — нам дано 80 грамм раствора гидроксида натрия, однако, его массовая доля равна 4%; чтобы узнать, чему равна масса чистого гидроксида натрия необходимо следовать формуле:
Теперь мы узнали массу чистого гидроксида натрия, через эту массу мы можем найти количество вещества NaOH:
3) Теперь находим моль сернистого газа через моль гидроксида натрия:
4) Последнее действие — нахождение объема SO2 Задание 4: Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой Определите окислитель и восстановитель. Решение: В данной реакции изменяют свои степени окисления два элемента — сера и хлор. Составим уравнения электронного баланса: Перед серой мы должны поставить коэффициент 4, перед хлором — 1 (мы же сокращаем 2 и 8). Не забываем указать, кто окислитель и восстановитель: Хлор в степени окисления +7 — окислитель, Сера в степени окисления + 4 — восстановитель. источники: http://chemege.ru/oksid-sery-iv/ http://pangenes.ru/post/oksidy-sery-primery-zadaniy-oge-s-obyasneniyami.html |
