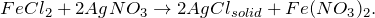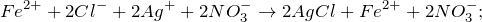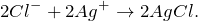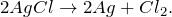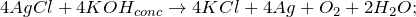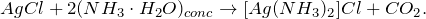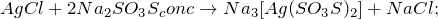Серебро нитрат железа ii ионное уравнение
Составьте уравнения указанных реакций, используя химические формулы веществ из п. 6.1.
Ниже даны описания двух химических превращений с участием веществ, перечень которых был приведён в задании 6:
(1) железо + нитрат серебра → нитрат железа(II) + серебро;
(2) гидроксид бария + серная кислота → сульфат бария + вода.
В зависимости от числа и состава веществ, вступающих в химическую реакцию и образующихся в результате неё, различают реакции соединения, разложения, замещения и обмена. Выберите ЛЮБУЮ реакцию (1) или (2) и укажите её тип.
1. Реакция (1) — реакция замещения (атомы железа замещают атомы серебра в составе сложного вещества — нитрата серебра).
2. Реакция (2) — реакция обмена (два сложных вещества (гидроксид бария и серная кислота) обмениваются своими составными частями (ионами), в результате чего образуются два других сложных вещества — сульфат бария и вода).
Из приборов, изображённых на рисунках, выберите тот, с помощью которого можно разделить смесь железных опилок и порошка сульфата бария. Какой метод разделения веществ при этом используется? Почему прибор, изображённый на другом рисунке, не может быть использован для разделения смеси железных опилок и сульфата бария?
Разделить смесь железных опилок и сульфата бария можно действием магнита (рисунок 2). Прибор, изображённый на рисунке 1, используется для отделения примесей, нерастворимых в жидкости; поскольку и железные опилки, и сульфат бария представляют собой твёрдые вещества, они не могут быть разделены с помощью этого прибора.
Ответ: 2, действие магнитом.
1.
2.
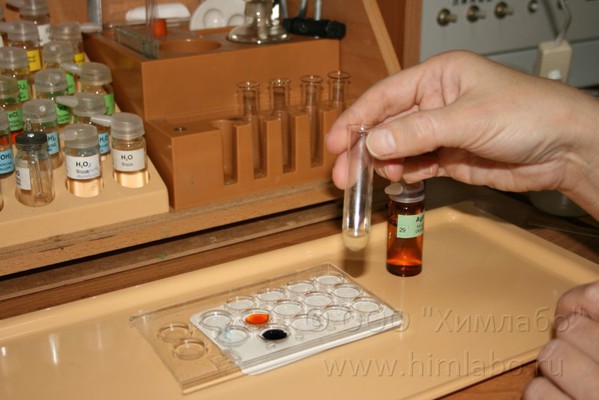
Окисление сульфата железа(II) нитратом серебра
При проведении опыта используем Микролабораторию для химического эксперимента
Оборудование: планшетка, фоновый экран, пробирка (2 шт.), стеклянная палочка, фильтровальная бумага, воронка, спиртовка, зажим пробирочный, спички.
Реактивы: 10% раствор сульфата железа(II) FeSO4, 1% раствор нитрата серебра (I), раствор гексацианоферрата(III) калия K3[Fe(CN)6], раствор роданида калия KSCN (или роданида аммония NH4SCN).
В опыте используют свежеприготовленные растворы сульфата железа(II) и нитрата серебра (I). Причем раствор сульфата железа не желательно подкислять серной кислотой, т.к. в противном случае реакция гидролиза не идет до конца и бурый осадок не образуется, раствор просто приобретает слегка бурую окраску.
Данный опыт можно использовать для создания проблемных ситуаций: первая — протекание окислительно-восстановительной реакции вместо реакции ионного обмена, а вторая — образование бесцветного раствора соли железа (III), который только в результате гидролиза будет приобретать бурую окраску.
Ход работы
1. Устанавливают планшетку на белую сторону фонового экрана.
2. В две ячейки планшетки вносят по 5-6 капель сульфата железа(II).
3. В одну ячейку добавляют 5-6 капель гексацианоферрата(III) калия. Образуется темно-синий осадок (турнбулева синь). В другую ячейку планшетки добавляют 5-6 капель роданида калия, может появиться небольшое кирпичное окрашивание из-за следов ионов железа(III), если при приготовлении раствора использовали старый реактив.
4. В пробирку наливают 25 капель сульфата железа(II) и приливают к нему раствор нитрата серебра(I) до образования и осаждения мелкодисперстного серебристо-серого осадка серебра.
3FeSO4 + 3AgNO3=Fe2(SO4)3 + 3Ag↓ + Fe(NO3)3
5. Стеклянной палочкой переносят несколько капель получившегося раствора в планшетку
6. Добавляют 1 каплю раствор роданида калия KSCN. Наблюдают ярко-красное окрашивание вследствие образования роданида железа (III).Если реакция пройдет до конца, то при проведении аналогичной реакции с гексацианоферратом(III) калия, качественной реакции не наблюдают.
7. Полученный раствор соли железа (III) отфильтровывают от осадка серебра в пробирку.
8. Пробирку вставляют в пробирочный зажим и нагревают на спиртовке.
9. При нагревании раствор приобретает коричневую окраску, затем она усиливается, а потом выпадает бурый осадок.
После проведения данного опыта создаются сразу две проблемные ситуации. Первая заключается в том, что наблюдается реакция, которая, по представлениям учеников, протекать не должна. Ведь учащимся известно, что реакция между растворами солей возможна, если в результате взаимодействия образуется новая малорастворимая соль, выпадающая в осадок. В этом опыте в осадок выпадает не соль, а металл. Составляют уравнения окислительно-восстановительных реакций.
Далее обращают внимание на цвет раствора, образовавшегося в результате реакции. По представлениям учащихся, растворы солей железа (III) имеют желто-коричневую окраску, но полученный раствор окраски не имеет. Учащиеся должны сделать вывод о том, что свежеприготовленный раствор соли железа (III) окраски не имеет, цвет обычных растворов обусловлен гидролизом. Опираясь на уравнения реакций гидролиза по отдельным ступеням, учащиеся должны определить, что при нагревании гидролиз значительно усиливается и даже сопровождается выпадением осадка Fe3O3•nH2O.
Оказываем содействие в подготовке технических требований для тендерной документации.
Внимание! Изображение товара может отличаться от полученного Вами товара. Производитель оставляет за собой право изменять комплектацию и технические характеристики товара без предварительного уведомления без ухудшения функциональных и качественных показателей. Информация о товаре носит справочный характер и не является публичной офертой, определяемой Статьей 437 ГК РФ.
Убедительная просьба, при покупке учебного оборудования согласовывать с менеджером важные для Вас характеристики, комплектацию и цену учебного оборудования.
Серебро нитрат железа ii ионное уравнение
FeCl2 + AgNO3 = ? уравнение реакции
Что произойдет в результате взаимодействия хлорида железа (II) с нитратом серебра (FeCl2 + AgNO3 = ?)? Приведите основные физические параметры твердого продукта реакции, расскажите о химических свойствах и других способах его получения.
При взаимодействии хлорида железа (II) с нитратом серебра (FeCl2 + AgNO3 = ?) происходит обменная реакция, результатом которой является выпадение осадка белого цвета, нерастворимого в воде и кислотах – хлорида серебра, а также образование нитрата железа (II). Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что хлорид серебра на ионы не распадается, т.е. не диссоциирует.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Хлорид серебра разлагается на свету с образованием металлического серебра:
Реагирует с концентрированными растворами щелочей, гидратом аммиака.
Переводится в раствор за счет комплексообразования.
При сплавлении с карбонатом натрия (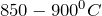
Серебро нитрат железа ii ионное уравнение
Для выполнения задания используйте следующий перечень веществ: сероводород, оксид железа(II), нитрат серебра, карбонат бария, хлорид железа (III). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, оксид железа(II), нитрат серебра, карбонат бария, хлорид железа (III). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Возможно несколько правильных ответов, принимается любой из них.
1)
2)
2 | →
1 | →
3) Железо в степени окисления +3 (или хлорид железа (III) за счёт железа в степени окисления +3) является окислителем. Сера в степени окисления -2 (или сероводород за счёт серы в степени окисления -2) — восстановителем.
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный, содержит следующие элементы: |
− выбраны вещества, и записано уравнение окислительно-восстановительной реакции;
Реакция железа и нитрата серебра
Реакция взаимодействия железа и нитрата серебра.
Уравнение реакции взаимодействия железа и нитрата серебра:
Железо и нитрат серебра (I) взаимодействуют друг с другом.
Реакция железа и нитрата серебра (I) протекает при обычных условиях.
В результате реакции железа и нитрата серебра (I) образуются серебро и нитрат железа (II).
Примечание: © Фото https://www.pexels.com, https://pixabay.com

Справочники
Мировая экономика
Востребованные технологии
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Серебра и нитрата железа (II)


16.При взаимодействии железа с кислородом:
Железо окисляется с образованием оксида
17. Бериллий в отличии от элементов второй группы элементов таблицы Д.И. Менделеева проявляет:
Амфотерные свойства
18.При взаимодействии перманганата калия (марганцовка) с перекисью водорода в присутствии серной кслоты образуются:
Сульфат марганца, сульфат калия, вода и кислород
19. При взаимодействии бромистоводородной кислоы (НВr) с двуокисью марганца образуются:
Бром, вода, бромид марганца
20.CrO3 проявляет:
Окислительые и кислотные свойства
21. Металлы реагируют с неокисляющими кислотами с выделением водорода если:
Стандартный потенциал меньше «0»
22. Активность металлов Pt, Au, Na, Fe, Pb, уменьшается в порядке:
Na, Fe, Pb, Au, Pt
23. Металл может быть получен электролизом водных растворов солей этого металла:
24.Латунь это сплав:
Меди и цинка
25. Реакция : Me + nHCl = MeCln + H2 xaрактерна для :
Тесты по разделу «Металлы и электрохимический ряд напряжений металлов» .
1.Координационное число в кристаллической решетке металлов может быть равным
2.В узлах кристаллической решетки металлов находятся
Положительно заряженные ионы металла
3.Наибольшей электропроводностью среди металлов обладают
4.В химических реакциях металлы выступают в роли
1) восстановителей
5.Электродные потенциалы не зависят от
1) атомной массы металла
6.Промышленная очистка титана от примесей осуществляется
Иодидным способым
7.Промышленная очистка меди от примесей осуществляется
1) электролитическим путем
8.Получение хрома алюмотермическим методом выражается реакцией
9.Электролизом растворов нельзя получить
10.При электрохимическом рафинировании меди, содержащей марганец, цинк, золото и серебро в анодный шлам перейдут
11.При электрохимическом рафинировании меди, содержащей марганец, цинк, железо и серебро в раствор перейдут
12.Стандартные электродные потенциалы соответствуют концентрации иона Me n + , равной
13.Флотационный метод обогащения руды основан на
1) различной смачиваемости минералов
14.Не взаимодействуют с разбавленной соляной кислотой
15.Возможным является процесс, описываемый уравнением
1) Zn + CuSO4 → ZnSO4 + Cu
16.Реакция меди с концентрированной азотной кислотой описывается уравнением
17.Реакция меди с разбавленной азотной кислотой описывается уравнением
18.Реакция магния с разбавленной азотной кислотой выражается уравнением
19.Концентрированная серная кислота не взаимодействует со следующими металлами
20.Амфотерными свойствами обладают металлы
21.Не взаимодействуют с водой
22.Относятся к легким конструкционным следующие металлы
23.Из четырех металлов Li , Na , K , Rb наименьший потенциал ионизации имеет
24.Из четырех металлов Mg , Ca , Sr , Ba наименьшую электроотрицательность имеет
25.Разбавленная серная кислота не взаимодействует со следующими металлами
Тесты по разделу «Строение атома и периодическая система Д.И.Менделеева».
1.Ядерную планетарную модель атома предложил
2.Принцип неопределенности Гейзенберга описывается уравнением
3) 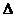
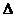
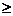
3.Уравнение Де-Бройля имеет вид
1) 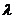
4. Уравнение Шредингера имеет вид
4) H 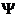
5. Изотопами являются
1) 40 Ca и 42 Ca
6. Ядро атома состоит из
Протонов и нейтронов
7. Энергию и размер орбитали характеризует
http://www.himlabo.ru/experiments/okislenie-sulfata-zheleza-ii-nitratom-serebra
http://ollimpia.ru/serebro-nitrat-zheleza-ii-ionnoe-uravnenie/