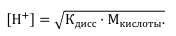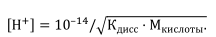Серная кислота метиловый оранжевый уравнение
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Лабораторный опыт 8. Изучение свойств серной кислоты.
1. Налейте в пробирку 1 мл разбавленной серной кислоты и добавьте в неё лакмус. Как изменился цвет индикатора?
2. Положите в пробирку кусок цинка и добавьте к нему разбавленную серную кислоту. Что наблюдаете? Проведите аналогичные опыты с алюминиевой и медной проволокой.
3. Получите осадок гидроксида меди (II) и прилейте к нему разбавленную серную кислоту. Что наблюдаете?
4. На кусок фильтровальной бумаги нанесите несколько капель раствора серной кислоты и осторожно нагрейте его, держа над плиткой. Что происходит? Объясните наблюдения, зная, что при нагревании вода, содержащаяся в растворе кислоты, испаряется и концентрация раствора возрастает.
5. К раствору серной кислоты добавьте одну-две капли раствора хлорида бария. Запишите цвет выпавшего осадка. Проделайте аналогичный опыт с растворами сульфата, карбоната и хлорида натрия, подкисленными серной кислотой. Опишите качественную реакцию на серную кислоту и её соли.
Цвет лакмуса в растворе серной кислоты изменяется на красный.
При добавлении кусочка цинка к разбавленной серной кислоте наблюдается выделение бесцветного газа на поверхности цинка.
Zn + H2SO4 ⟶ ZnSO4 + H2↑
При добавлении кусочка алюминия к разбавленной серной кислоте наблюдается выделение бесцветного газа на поверхности алюминия.
2Al + 3H2SO4 ⟶ Al2(SO4)3 + 3H2↑
При добавлении кусочка меди к разбавленной серной кислоте изменений не наблюдается.
Cu + H2SO4 ⇸
Получим осадок гидроксида меди (II) с помощью раствора щелочи и раствора сульфата меди (II):
2NaOH + CuSO4 ⟶ Na2SO4 + Cu(OH)2↓
При добавлении серной кислоты к гидроксиду меди (II) наблюдается растворение осадка:
Cu(OH)2 + H2SO4 ⟶ CuSO4 + 2H2O
Концентрированная серная кислота обугливает лист бумаги, значит концентрированная серная кислота обладает сильными гигроскопическими свойствами.
При добавлении хлорида бария к раствору серной кислоты наблюдается выпадение белого осадка.
BaCl2 + H2SO4 ⟶ 2HCl + BaSO4↓
При добавлении хлорида бария к раствору сульфата натрия наблюдается выпадение белого осадка.
BaCl2 + Na2SO4 ⟶ 2NaCl + BaSO4↓
При подкислении изменений не наблюдается.
При добавлении хлорида бария к раствору карбоната натрия наблюдается выпадение белого осадка.
BaCl2 + Na2CO3 ⟶ 2NaCl + BaCO3↓
При подкислении серной кислотой наблюдается выделение газа:
BaCO3 + H2SO4 ⟶ BaSO4 + H2O + CO2↑
При добавлении хлорида бария к хлорида натрия изменений не наблюдается.
Качественной реакцией на серную кислоту и её соли является реакция с растворимым соединением бария. В результате такой реакции выпадет белый осадок не взаимодействующий с кислотами.
Кислотно-основное титрование. Индикаторы, техника титрования
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Кислотно-основное титрование
Основные понятия кислотно-основного титрования
Индикаторы метода кислотно-основного титрования. Теории индикаторов
Техника титрования
Основные понятия кислотно-основного титрования
Метод кислотно-основное титрование базируется на реакциях взаимодействия между кислотами и основаниями, т. е. на реакции нейтрализации:
Рабочими растворами метода являются растворы сильных кислот (HCl, H2S, НNО3 и др.) или сильных оснований (NaOH, КОН, Ва(ОН)2 и др.). В зависимости от титрованного раствора (титранта) кислотно-основное титрование подразделяют на ацидиметрию, если титрантом является раствор кислоты, и алкалиметрию, если используют в качестве титранта раствор основания.
Согласно правилу эквивалентности титрование необходимо продолжать до тех пор, пока количество прибавленного реагента не станет эквивалентным содержанию определяемого вещества. Наступающий в процессе титрования момент, когда количecтвo вещества в растворе титранта становится строго эквивалентным количеству определяемого вещества согласно уравнению химической реакции, называют точкой эквивалентности.
Точку эквивалентности устанавливают различными способами. В методах ручного анализа преимущественно используют изменение окраски индикатора, добавляемого в титруемый раствор. Момент, при котором происходит наблюдаемое изменение цвета индикатора, называют конечной точкой титрования. Очень часто конечная точка титрования не совсем совпадает с точкой эквивалентности. Как правило, они отличаются друг от друга не более чем на 0,04 мл (2 капли) титранта. Это то количество вещества в растворе титранта, которое необходимо для взаимодейcтвия его с индикатором.
Если для приготовления растворов используют вещества, которые не являются стандартными, то проводят их стандартизацию. Например растворы кислот можно стандартизовать по стандартным веществам — натрия тетраборат Na2B4О7 ∙10Н2О, натрия карбонат Nа2СО3 ·10Н2О или по стандартным растворам NaOH, КОН; а растворы оснований — по щавелевой кислоте Н2С2О4 ∙2Н2О, янтарной кислоте Н2С4Н4О4 или по стандартным растворам HCl, H2SO4 , НNО3 .
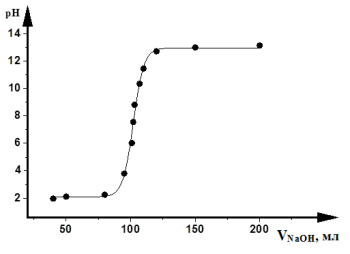
Кривые кислотно-основного титрования выражают зависимость изменения рН раствора от объема добавленного титранта (рис. 3.4).
Рис. 3.4. Кривая кислотно-щелочного титрования
При расчете рН необходимо знать состав титриметрической смеси. Для упрощения вычислений (что не приводит к заметным ошибкам) не учитывают разбавление раствора в процессе титрования и используют понятие «концентрация», а не «активность». Кривые титрования представляют в виде графика зависимости рН от объема добавленного титранта или объема избытка определяемого вещества и избытка титранта.
В начале титрования рН изменяется очень медленно. Кривая (см. рис. 3.4) показывает, в частности, что если оттитровать половину имеющегося количества кислоты (50 мл), рН раствора изменится незначительно по сравнению с исходным, если оттитровать 90 % (90 мл), то и тогда уменьшение рН составит лишь одну единицу. С уменьшением концентрации оставшейся кислоты изменение рН при титровании становится более резким. Оттитровывание кислоты от 90 до 99 % вызывает изменение рН на три единицы. Также на единицу возрастает рН при оттитровывании от 99 до 99,9 %, т. е. на 0,9 %. Титрование остатка кислоты (0,1%) приводит к изменению рН на целых 3 единицы. Введение избытка в 0,1 % NaOH по сравнению с эквивалентным количеством вызывает изменение рН также на 3 единицы, и рН раствора становится равным 13,0.
Кривая титрования сильного основания сильной кислотой представляет собой зеркальное отображение кривой титрования сильной кислоты сильным основанием. При титровании сильной кислотой сильного основания и наоборот до точки эквивалентности рН раствора определяется концентрацией неоттитрованной щелочи или кислоты, а после точки эквивалентности — концентрацией добавленной кислоты или щелочи. В точке эквивалентности раствор нейтрален.
Скачок титрования — это резкое изменение рН в области точки эквивалентности. Факторы, влияющие на величину и положение скачка титрования (на величину скачка титрования влияют все факторы, от которых зависят значения рН):
- ● константа диссоциации титруемого вещества;
- ● концентрация титруемого вещества;
- ● концентрация титранта;
- ● температура;
- ● ионная сила.
Чем меньше концентрация титруемого вещества и титранта, тем меньше скачок. Практически невозможно оттитровать сильные протолиты концентрацией 10 –4 М, а слабые — концентрацией 10 –2 М. При изменении температуры сильно изменяется константа автопротолиза воды, входящая во многие формулы расчета рН. В результате при увеличении температуры скачок уменьшается и смещается в более кислую область. Ионная сила влияет незначительно.
В рассматриваемом случае расчет рН проводят по следующим формулам:
● Для сильной кислоты, например HCl, рН определяется концентрацией ионов водорода: [H+] = M кислоты.
● Для сильного основания, например КОН [H+] = 10 –14 / Mщелочи. Часто проводят титрование с использованием слабых электролитов.
При титровании слабой кислоты сильным основанием чем слабее кислота, тем больше значение рН в начале титрования. Следовательно, ветвь кривой титрования (рис. 3.5) до точки эквивалентности смещается в щелочную область. После достижения точки эквивалентности образуется сильное основание, следовательно, значение рН резко смещается в щелочную область. При дальнейшем титровании кривая изменяется незначительно.
В ходе титрования раствора уксусной кислоты сильным основанием значение pH все время остается выше, чем при тех же концентрациях соляной кислоты. В результате этого скачок на кривой начинается с более высокого значения рН. Заканчивается он, как и в первом случае, при рН = 10, так как титрование производят тем же раствором 0,1 моль/л NaOH.
Рис. 3.5. Ход титрования слабой кислоты сильным основанием
При титровании слабой кислоты сильным основанием pH раствора кислоты вычисляют с учетом ее константы диссоциации:
Интервал скачка рН на кривой титрования 0,1 мольл уксусной кислоты раствором 0,1 мольл NaOH значительно уже предыдущего случая. Он простирается от рН = 7,8 до рН = 10.
При титровании слабого основания сильной кислотой интервал скачка уменьшается в щелочной области рН. Рассчитывается рН в этом случае следующим образом:
При титрование слабой кислоты слабым основанием (или наоборот) сужение интервала скачка рН происходит и в кислотной, и в щелочной областях рН. Вследствие этого интервал скачка рН на кривой вовсе исчезает. Пример — нейтрализация раствора 0,1 моль/л СН3СООН раствором 0,1 моль/л NН4ОН. Кривая титрования не имеет скачка рН. Поэтому нельзя ожидать и резкого изменения окраски индикаторов. Титрование слабой кислоты слабым основанием вообще невозможно.
Индикаторы метода кислотно-основного титрования. Теории индикаторов
Индикаторы — вещества, которые резко реагируют на изменение концентрации определяемого компонента или титранта вблизи точки эквивалентности. В методах кислотно-основного титрования для определения конечной точки титрования используют кислотноосновные индикаторы (табл. 3.1). Это органические вещества, способные видимо и обратимо изменять свою окраску в растворе при изменении рН среды.
Кислотно-основные индикаторы изменяют свою окраску в области интервала перехода независимо от того, достигнута ли точка эквивалентности. Правильно выбранный индикатор изменяет окраску в области скачка титрования. У неправильно выбранного индикатора изменение окраски может происходить задолго до наступления точки эквивалентности или после нее.
Таблица 3.1 Характеристики кислотно-основных индикаторов
Выбирают индикатор с помощью кривой титрования. Для этого на график наносят интервал перехода индикатора. У правильно выбранного индикатора интервал перехода полностью или частично перекрывается скачком титрования. Если такого перекрывания нет, то индикатор для данного титрования не подходит. Значение рН, при котором заканчивается титрование с данным индикатором, называют показателем титрования и обозначают рТ. Показатель титрования находится обычно в середине интервала перехода индикатора. Существуют различные теории индикаторов, каждая из которых по-своему объясняет поведение кислотно-основных индикаторов в кислых и щелочных средах.
Ионная теория индикаторов. В связи с тем, что кислотно-основные индикаторы представляют собой слабые кислоты или слабые основания, любой индикатор диссоциирует в растворе согласно уравнению:
HInd = Н+ + Ind — (бесцветный — малиновый).
Окраска раствора, в котором индикатор находится в молекулярной форме (HInd), отличается от окраски раствора, в котором индикатор находится в ионной форме (Ind − ). Молекулы фенолфталеина HInd бесцветны, а его анионы Ind − окрашены в малиновый цвет. Достаточно к раствору, содержащему фенолфталеин, прибавить 1−2 капли щелочи, как введенные ОН – ионы станут связывать катионы Н+ с образованием слабого электролита — молекул воды. При этом равновесие диссоциации индикатора сместится вправо, и накопление анионов Ind − вызовет окрашивание раствора в малиновый цвет. То есть переход одной окраски, присущей молекулярной форме кислотно-основного индикатора, в другую, свойственную его ионной форме, происходит под влиянием Н+ или ОН − -ионов, т. е. зависит от рН раствора.
Хромофорная теория индикаторов. Поведение индикаторов, объясняемое ионной теорией индикаторов, дополняется хромофорной теорией, согласно которой изменение окраски индикаторов связано с изменением структуры их молекул, внутримолекулярной перегруппировкой, вызываемой действием Н+ или ОН − -ионов. По хромофорной теории в процессе изменения рН раствора меняется строение молекул кислотно-основных индикаторов. Это явление обусловливается бензоидно-хиноидной таутомерией. При изменении рН среды раствора или при диссоциации хромофоры могут перегруппировываться. Перемена окраски у индикаторов является результатом изменений в их внутреннем строении. У одноцветных индикаторов окраска изменяется в связи с появлением или исчезновением хромофоров. У двухцветных индикаторов эти изменения обусловлены превращением одних хромофоров в другие. Типичным одноцветным индикатором является фенолфталеин. При рН –4 , у лакмуса Кд = 10 –8 , а у фенолфталеина Кд = 10 –9 . Следовательно, фенолфталеин является наиболее слабой органической кислотой из этих индикаторов.
Изменение окраски индикаторов происходит при прибавлении к любому раствору любой кислоты или щелочи влечет за собой изменение концентрации ионов Н+ в нем, а следовательно, и величины рН. Перемена окраски у индикаторов также связана с изменением рН раствора. Однако каждый индикатор изменяет окраску только в определенном, характерном для него интервале значений рН. Объясняется это тем, что окраска индикатора зависит от соотношения концентраций его диссоциированной и недиссоциированной форм, т. е.
При рН = 7, [Н+] = 1 –7 , а [HInd] / [Ind−] = 10 –7 / 10 –9 , т. е. при рН = 7 на каждые 100 бесцветных молекул фенолфталеина приходится лишь один окрашенный ион, следовательно, раствор бесцветный.
Если к раствору фенолфталеина прибавить щелочь и довести рН раствора до 8, то соотношение [HInd] / [Ind−] = 10 –8 /10 –9 уменьшится в 10 раз и раствор станет бледно-розовым. При рН = 9 соотношение [HInd] / [Ind−] = 10 –9 /10 –9 = 1,0, т. е. в растворе присутствуют равные количества бесцветных молекул индикатора и окрашенных в красный цвет ионов, при этом раствор приобретает розовую окраску. Следовательно, цвет водного раствора индикатора определяется соотношением концентрации его молекулярной и ионной форм, отличающихся различной окраской, и зависит от [Н+].
Техника титрования
Правильное определение точки эквивалентности при титровании зависит не только от выбора индикатора, но и от порядка титрования. По методу нейтрализации титруют растворы кислот растворами оснований или наоборот. Этот порядок следует учитывать при выборе индикатора. Например, если титруют кислоту основанием и в качестве индикатора используют метиловый оранжевый (или метиловый красный), то розовая окраска индикатора от избыточной капли щелочи должна перейти в желтую.
Такое изменение окраски гораздо хуже улавливается глазом, чем переход ее из желтой в розовую. Поэтому с метиловым оранжевым (или метиловым красным) рекомендуют титровать растворы оснований растворами кислот. С фенолфталeином удобнее титровать растворы кислот растворами оснований, так как при этом бесцветный раствор становится малиновым.
Следует заметить, что при использовании индикаторов для фиксирования конечной точки титрования возможно появление индикаторной ошибки. Она образуется в случае несовпадения рН раствора в точке эквивалентности и рТ индикатора. Если такое несовпадение имеет место, то раствор обычно либо несколько перетитровывают, либо, наоборот, недотитровывают. Для уменьшения индикаторной ошибки титрование проводят с так называемым свидетелем. В запасную коническую колбу (или стакан) наливают дистиллированную воду в количестве, приблизительно равном объему жидкости, получающейся в конце титрования. Прибавляют к воде столько же капель индикатора, например метилового оранжевого, сколько и к титруемому раствору, и приливают из бюретки 1−2 капли кислоты, вызывающей слабое порозовение раствора. Приготовленный таким образом свидетель используют в качестве образца при титровании, добиваясь, чтобы окраска анализируемого раствора и свидетель была одинакова. С помощью свидетель вводят также поправку в результаты титрования на прибавленный избыток кислоты, т. е. из затраченного ее объема вычитают объем двух капель (0,04 мл), использованных на окрашивание индикатора в свидетель.
Правильное определение точки эквивалентности зависит от количества прибавленного индикатора. Иногда стараются прилить побольше индикатора, полагая, что большая интенсивность окраски раствора облегчит определение точки эквивалентности. Но чем больше прибавлено индикатора, тем труднее заметить изменение окраски, так как оно будет происходить медленнее. Для установления конечной точки титрования имеет значение не столько яркость окраски раствора, сколько четкость ее изменения. Опытным путем найдено, что на 10–15 мл анализируемого раствора следует брать одну каплю раствора индикатора, а на 25 мл — не более двух капель.
Таким образом, результат объемного определения зависит не только от выбора индикатора, но также от его взятого количества и от принятого порядка титрования.
http://gomolog.ru/reshebniki/9-klass/eremin-2019/27/lab-8.html
http://farmf.ru/lekcii/kislotno-osnovnoe-titrovanie-indikatory-tehnika-titrovaniya/