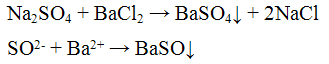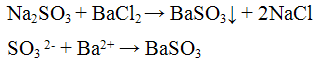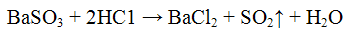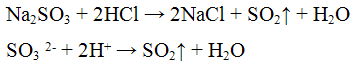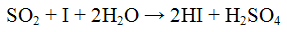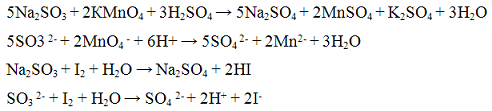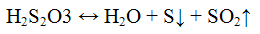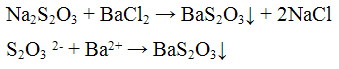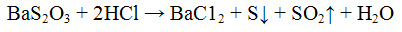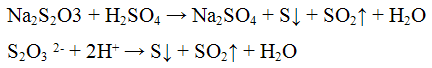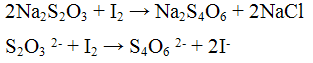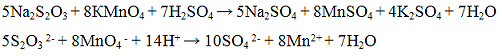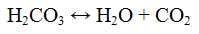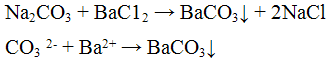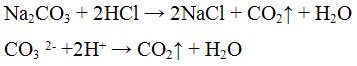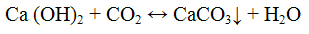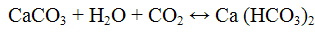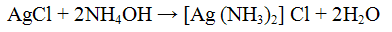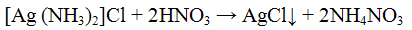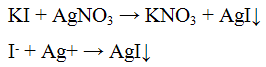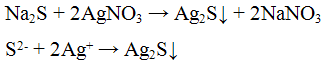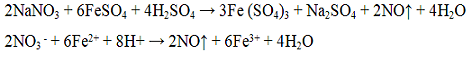Сульфат бария: способы получения и химические свойства
Сульфат бария BaSO4 — соль металла бария и серной кислоты. Белый, тяжелый, при сильном нагревании плавится и разлагается.
Не растворяется в воде. Малореакционноспособный.
Относительная молекулярная масса Mr = 233,39; относительная плотность для тв. и ж. состояния d = 4,5; tпл = 1580º C (разлагается).
Способ получения
1. В результате взаимодействия хлорида бария и сульфата натрия образуется сульфат бария и хлорид натрия:
2. Гидроксид бария вступает в реакцию с разбавленной серной кислотой и образует сульфат бария и воду:
Химические свойства
1. Сульфат бария реагирует с простыми веществами :
1.1. Сульфат бария взаимодействует с углеродом (коксом) при 1100 — 1200º С и образует сульфид бария, угарный газ или углекислый газ:
BaSO4 + 4C = BaS + 4CO
1.2. Хлорид бария вступает в реакцию с водородом при 900 — 1000º С с образованием сульфида бария и воды:
2. Сульфат бария вступает в реакцию со сложными веществами :
2.1. Сульфат бария взаимодействует с оксидами:
2.1.1. Сульфат в результате реакции с угарным газом при 600 — 800º С образует сульфид бария и углекислый газ:
BaSO4 + 4CO = BaS + 4CO2
2.2. Сульфат бария может реагировать с концентрированной серной кислотой. При этом сульфат бария образует гидросульфат бария:
3. Сульфат бария разлагается при температуре выше 1580º С, образуя оксид бария, оксид серы (IV) и кислород:
Лабораторная работа № 7.
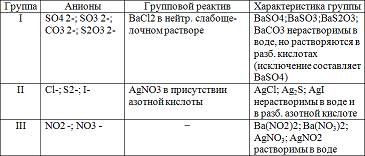
Цель: — изучение частных реакций анионов I, II, III групп.
Ход работы:
Задание 1: Проделать частные реакции анионов I, II, III групп. Результаты работы оформить в виде таблицы:
Реакции анионов первой аналитической группы: SO4 2-, SO3 2-, S2O3 2-, CO3 2-. Реакции сульфат — иона SO4 2-. Реакция с хлоридом бария ВаCl2. Хлорид бария ВаСl2 с сульфат — ионами SO4 2- образует кристаллический осадок сульфат бария BaSO4 белого цвета, нерастворимый в кислотах и щелочах:
Проведение реакции: В пробирку прилить2 — 3 капли раствора сульфата натрия Na2SO4 и хлорида бария ВаСl. Наблюдать выпадение осадка белого цвета. Осадок разделить на две части, к одной части добавить 2-3 капли раствора серной кислоты H2SO4, а к Другой — столько же раствора соляной кислоты HCl. Осадок не растворяется.
Реакции сульфит-иона SO3 2-.
Сернистая кислота H2SO3 существует только в водном растворе. Она нестойкая и разлагается на воду и оксид серы (IV). Сернистая кислота образует два типа солей: сульфиты и гидросульфиты (HSO3 -). Сернистая кислота и её соли — сильные восстановители и слабые окислители.
Реакция с хлоридом бария ВаС12.
Хлорид бария ВаС12 с сульфит- ионами SO3 2- образует кристаллический осадок сульфит бария BaSO3 белою цвета:
Осадок сульфита бария растворяется в соляной и азотной кислотах с выделением оксида серы (IV), обладающего характерным запахом:
Проведение реакции: К 2 — 3 каплям раствора сульфита натрия Na2SO3 прилить столько же раствора хлорида бария ВаС12. Наблюдать выпадение осадка белого цвета. Осадок разделить на две части, к одной части добавить раствор соляной кислоты HCl, а к другой раствор азотной кислоты HNO3. Наблюдать растворение осадка в обеих пробирках.
Реакция с кислотами. Кислоты разлагают все сульфиты с выделением оксида серы (IV):
Выделяющийся оксид серы (IV) обесцвечивает растворы йода или перманганата калия, например:
Эта реакция используется для определения общего количества SO? о сыром очищенном, сульфитированом картофеле.
Проведение реакции: В пробирку прилить 2 — 3 капли раствора йода и добавить раствор крахмала. Наблюдать окрашивание раствора йода в синий цвет. К смеси прилить 2 — 3 капли раствора сульфита натрия Na2SO3 и 2 — 3 капли раствора соляной кислоты. Исчезновение синей окраски указывает на присутствие оксида серы (IV) SO2. Реакция с окислителями (йод или перманганат калия). Сульфит — ионы обесцвечивают раствор йода и перманганата калия. Реакции протекают в кислой среде. Реакции протекают по уравнениям:
Проведение реакции: В одну пробирку прилить 1 — 2 кайли раствора перманганата калия KMnO4, прибавить 3 — 4 капли раствора серной кислоты ll2S04 и по каплям раствор сульфита натрия Na2SO3 до обесцвечивания реакционной смеси. В другую пробирку прилить 1 — 2 капли раствора йода I2, каплю раствора крахмала и по каплям прибавлять раствора сульфита натрия Na2SO3 до обесцвечивания реакционной смеси.
Реакции тиосульфат — иона S2O3 2-. Тиосерная кислота H2S2O3 неустойчива, разлагается на оксид серы (IV), серу и воду:
Разлагается даже в разбавленных водных растворах. Соли тиосерной кислоты — тиосульфаты — более устойчивы и являются более сильными восстановителями.
Реакция с хлоридом бария ВаС12. Тиосульфат — ионы с хлоридом бария ВаС12 образуют белый осадок тиосульфата бария BaS2O3. Осадок образуется только в избытке хлорида бария:
Осадок тиосульфата бария растворяется при нагревании в минеральных кислотах с выделением серы:
Проведение реакции: К 2 — 3 каплям раствора тиосульфата натрия Na2S203 прилить столько же капель раствора хлорида бария BaCl2. Наблюдать выпадение осадка белого цвета. К осадку добавить 2 — 3 капли раствора соляной кислоты HCl. Наблюдать растворение осадка.
Реакция с кислотами. Минеральные кислоты разлагают тиосульфаты, при этом выделяются в виде осадка бледно-желтого цвета и оксид серы (IV);
Проведение реакции: К 3 — 5 каплям раствора тиосульфата натрия Na2S2O3 cтолько же раствора серной кислоты H2SO4. Наблюдать выпадение осадка бледно-желтого цвета
Реакция с окислителями (йод I2 или перманганат калия KMnO4). Окислители (KMnO4, I2) окисляют ионы S2O3 2- до S4O6 2- — тетратионат — ионов. Реакцию проводят в нейтральной среде:
Эта реакция лежит в основе иодометрического метода определения содержания сахара в продуктах питания
Проведение реакции: В одну пробирку прилить 1 — 2 капли раствора перманганата калия KMnO4, прибавить 3 — 4 капли раствора серной кислоты H2SO4 и по каплям раствор тиосульфата натрия Na2S2O3 до обесцвечивания реакционной смеси. В другую пробирку прилить 1 — 2 капли раствора йода I2, каплю раствора крахмала и по каплям прибавлять раствора тиосульфата натрия Na2S2О3 до обесцвечивания реакционной смеси.
Реакции карбонат — ионов CO3 2-. Угольная кислота неустойчива, разлагается на оксид углерода (IV) и воду по уравнению
Угольная кислота дает два типа солей: карбонаты и гидрокарбонаты (НСО3). Карбонаты щелочных металлов и аммония растворимы в воде. Нерастворимые в воде карбонаты растворяются в уксусной и минеральных кислотах.
Реакция с хлоридом бария ВаС12. Хлорид бария ВаС12 с ионами СО3 2- дает осадок белого цвета, растворимый в минеральных и уксусной кислотах:
Проведение реакции: К 2 — 3 каплям раствора карбоната натрия Na2CO3 прилить 2 — 3 капли раствора хлорида бария ВаСl2. Наблюдать выпадение осадка белого цвета. К осадку добавить 4 — 5 капель раствора серной кислоты Наблюдать бурное выделение газа.
Реакция с кислотами. Карбонаты разлагаются разбавленными кислотами с выделением оксида углерода (IV) по уравнению:
Выделяющийся оксид углерода (IV) открывают по помутнению известковой или баритовой воды
Не следует продолжительное время пропускать оксид углерода (IV) через известковую пли баритовую воду, так как избыток СO2 превращает карбонаты в растворимые гидрокарбонаты
Проведение реакции: Реакцию выполняют в пробирке с газоотводное трубкой, в которую по метают 5 — 6 капель раствора карбоната натрия Na2CO3 и равный объем раствора соляной кислоты НCl. Пробирку закрывают пробкой с газоотводной трубкой, конец которой помещают в пробирку с известковой или баритовой водой. Наблюдать образование белого осадка или помутнение раствора.
Реакции анионов второй аналитической группы: Сl-, I-, S2-.
Реакции хлорид — ионов Cl-.
Соляная кислота НCl — сильный электролит. Образует нормальные соли – хлориды. Все хлориды растворимы в воде, за исключением AgCl, PbCl2, Ионы Сl- бесцветны.
Реакция с нитратом серебра AgNO3. Нитрат серебра AgNO3 с ионами Сl- образует белый творожистый осадок хлорида серебра:
Осадок хлорида серебра хорошо растворяется в растворе гидроксида аммония:
При подкислении азотной кислотой аммиачного раствора хлорида серебра вновь выпадает белый творожистый осадок хлорида серебра.
Проведение реакции: К 2 — 3 каплям раствора хлорида натрия NaCl прилить столько же раствора нитрата серебра AgNO3. Наблюдать выпадение белого осадка. К осадку добавим, раствор гидроксида аммония NH4OH до полного растворения. В полученном растворе открыть анноны Сl- действием 3 — 5 капель раствора азотной кислоты.
Реакции иодид — ионов I-.
Иодоводородная кислота HI — сильная кислота и сильный восстанови гель. Соли её называют иодидами. Все они, за исключением AgI, HgI2 PbI2, растворимы в воде. Ионы I- бесцветны.
Реакция с нитратом серебра AgNO3,
Нитрат серебра AgNO3 с ионами I- образует желтый творожистый осадок иодида серебра:
Осадок нерастворим в минеральных кислотах и растворе аммиака.
Проведение реакции: К 2 — 3 каплям раствора иодида калия КI прилить 3 — 4 капли раствора жирата серебра AgNO3. Наблюдать выпадение желтого осадка.
Реакции сульфид — иона S2-.
Ионы S2- бесцветны. Сероводородная кислота H2S образует два вида солей: сульфиды и гидросульфиды (HS-). Сульфиды щелочных и щелочно-земельных металлов и аммония растворимы в воде. Сероводородная кислота и сё соли — сильные восстановители, сами окисляются до свободной серы или до серной кислоты.
Реакция с нитратом серебрa AgNO3. Нитрат серебра AgNO3 с попами S2- образует черный осадок сульфида серебра:
Осадок сульфида серебра нерастворим в растворе NH4OH, но растворяется при нагревании в растворе азотной кислоты HNO3
Проведение реакции: К 2 — 3 каплям раствора сульфида натрия Na2S прилить 3 — 4 капли раствора нитрата серебра AgNO3. Наблюдать выпадение осадка черного цвета.
Реакция с кислотами. Разбавленные кислоты HCl, H2SO4 разлагают сульфиды с выделением сероводорода H2S:
Сероводород можно обнаружить по запаху (тухлых яиц) и по почернению бумажки, пропитанной солью свинца Эта реакция используется для определения сероводорода в мясных полуфабрикатах и полуфабрикатах из соленой рыбы. Присутствие сероводорода указывает на глубокий распад белков.
Проведение реакции: Смочить полоску фильтровальной бумаги раствором соли свинца В пробирку прилить 2 — 3 капли раствора сульфида натрия Na2S и 3 — 4 капли раствора соляной кислоты. Пробирку накрыть подготовленной полоской фильтровальной бумаги и слегка нагреть. Наблюдать почернение фильтровальной бумажки.
Реакции анионов третьей аналитической группы; NO3 -, NO2 -. Реакции нитрат — ионов NO3 -.
Азотная кислота HNO3 — сильный электролит. Разбавленная и концентрированная кислота — сильный окислитель. Соли азотной кислоты называют нитратами и хорошо растворимы в воде. Ионы NO3 — бесцветны. Реакция с сульфатом железа (II) FeSO4. Сульфат железа (II) FeSО4 восстанавливает азотную кислоту и её соли до оксида азота (II) NO:
Выделяющийся оксид азота (II) образует с FeSO4 непрочное комплексное соединение [Fe(NO)]SO4 бурого цвета.
Проведение реакции, в пробирку прилить 2 — 3 капли раствора нитрата калия KNO3, 3 — 4 капли концентрированного раствора сульфата железа (II) FeSO4. Затем осторожно по стенке пробирки добавить концентрированную серную кислоту. В месте соприкосновения жидкостей появляется темно-бурое окрашивание.
Реакция с дифениламином.
Дифениламин с ионами NO3 — даст интенсивное васильково — синее окрашивание Реакция весьма чувствительна, но не специфична, гак как такое же окрашивание дают и другие окислители, например, нитриты, хроматы, перманганаты.
Проведение реакции: В небольшую фарфоровую чашку поместить один кристалл дифениламина и 1 мл химически чистой концентрированной серной кислоты H2SO4. Сюда же осторожно прилить 1 — 2 капли раствора нитрата калия KNO3. Наблюдать появление интенсивного васильково — синего окрашивания.
Реакции ширит — ионов NO2 -.
Азотистая кислота HNO2 и её соли могут быть и окислителями, и восстановителями. Соли азотистой кислоты называются нитритами. Нитриты хорошо растворимы в воде, исключением является интриг серебра AgNO2, Ионы NO2 — бесцветны.
Реакция с перманганатом калин КМnО4. Перманганат кадия KMnO4 окисляет ноны NO2 — до NO3 -, при этом происходит обесцвечивание раствора перманганата калия.
Проведение реакции: В пробирку прилить 3 — 4 капли раствора нитрита калия, раствор подкислить раствором серной кислоты H2SO4. Затем к смеси добавить по каплям раствор перманганата калия КМnО4. Наблюдать обесцвечивание малиновой окраски перманганата калия
Контрольные вопросы:
1. Почему анионы I руины нельзя осаждать ВаСl2 в кислой среде?
2. Почему анионы II группы необходимо осаждать AgNO3 в присутствии HNO3?
3. Чем отличаются анионы III группы от анионов I и II групп?
4. Реакции ионов NO3 и NО2 — с соответствующими реактивами являются окислнтельно — восстановителными. Расставьте в них коэффициенты методом электронного баланса.
5. Какие анионы служат окислителями, и какие восстановителями?
Дата добавления: 2015-11-10 ; просмотров: 9052 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://helpiks.org/5-101686.html