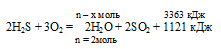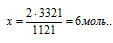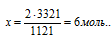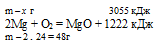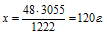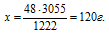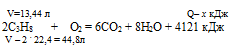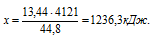Реакция взаимодействия магния и сероводорода
Реакция взаимодействия магния и сероводорода
Уравнение реакции взаимодействия магния и сероводорода:
Реакция взаимодействия магния и сероводорода.
В результате реакции образуются сульфид магния и водород.
Реакция протекает при условии: при температуре около 500°C.
Формула для поиска по сайту: Mg + H2S → MgS + H2
Реакция димеризации молекулы хлорида галлия (III)
Реакция взаимодействия карбида скандия и соляной кислоты
Реакция взаимодействия оксида железа (II,III) и водорода
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Магний: способы получения и химические свойства
Магний Mg — это щелочной металл. Серебристо-белый, относительно мягкий, пластичный, ковкий металл. На воздухе покрыт оксидной пленкой. Сильный восстановитель.
Относительная молекулярная масса Mr = 24,305; относительная плотность для твердого и жидкого состояния d = 1,737; tпл = 648º C; tкип = 1095º C.
Способ получения
1. В результате электролиза расплава хлорида магния образуются магний и хлор :
2. Нитрид магния разлагается при 700 — 1500º С образуя магний и азот:
3. Оксид магния легко восстанавливается углеродом при температуре выше 2000º С, образуя магний и угарный газ:
MgO + C = Mg + CO
4. Оксид магния также легко восстанавливается кальцием при 1300º С с образованием магния и оксида кальция:
MgO + Ca = CaO + Mg
Качественная реакция
Качественной реакцией для магния является взаимодействие соли магния с любой сильной щелочью, в результате которой происходит выпадение студенистого осадка:
1. Хлорид магния взаимодействует с гидроксидом калия и образует гидроксид магния и хлорид калия:
MgCl2 + 2KOH = Mg(OH)2 + 2KCI
Химические свойства
1. Магний — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Магний взаимодействует с азотом при 780 — 800º С образуя нитрид магния:
1.2. Магний сгорает в кислороде (воздухе) при 600 — 650º С с образованием оксида магния:
2Mg + O2 = 2MgO
1.3. Магний активно реагирует при комнатной температуре с влажным хлором . При этом образуется хлорид магния :
1.4. С водородом магний реагирует при температуре 175º C, избыточном давлении и в присутствии катализатора MgI2 с образованием гидрида магния:
2. Магний активно взаимодействует со сложными веществами:
2.1. Магний реагирует с горячей водой . Взаимодействие магния с водой приводит к образованию гидроксида магния и газа водорода:
2.2. Магний взаимодействует с кислотами:
2.2.1. Магний реагирует с разбавленной соляной кислотой, при этом образуются хлорид магния и водород :
Mg + 2HCl = MgCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой магний образует нитрат магния, оксид азота (I) и воду:
2.2.3. В результате реакции сероводородной кислоты и магния при 500º С образуется сульфид магния и водород:
Mg + H2S = MgS + H2
2.3. Магний вступает в реакцию с газом аммиаком при 600 — 850º С. В результате данной реакции образуется нитрид магния и водород:
2.4. Магний может вступать в реакцию с оксидами :
2.4.1. В результате взаимодействия магния и оксида азота (IV) при температуре 150º С в вакууме, в этилацетилене образуется нитрат магния и оксид азота (II):
2.4.2. Магний взаимодействует с оксидом кремния при температуре ниже 800º С в атмосфере водорода образуя силицид магния и оксид магния:
4Mg + SiO2 = Mg2Si + MgO,
а если температуру поднять до 1000º С, то в результате реакции образуется кремний и оксид магния:
2Mg + SiO2 = Si + 2MgO
Вычисление количества теплоты, количества и массы веществ реакций горения сероводорода, пропена и магния
Задача 1.8.
При полном сгорании сероводорода в избытке кислорода выделилось 3363 кДж теплоты. Согласно термохимическому уравнению:
2Н2S + 3О2 = 2Н2O + 2SO2 + 1121 кДж
количество вещества образовавшейся воды составляет:
1) 1 моль; 2) 2 моль; 3) 4 моль; 4) 6 моль.
Дано: Количество выделившейся теплоты: Q = 3363 кДж.
Найти: количество вещества образовавшейся воды: n(H2O) = ?
Р е ш е н и е:
I способ
Для выбора верного ответа удобнее всего провести расчет искомой в задаче величины и сравнить ее с предлагаемыми вариантами. Расчет по термохимическому уравнению ничем не отличается от расчета по обычному уравнению реакции. Над реакцией мы указываем данные в условии и искомые величины, под реакцией — их соотношения согласно коэффициентам. Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
Для вычисления количества вещества образовавшейся воды составляем пропорцию:
х моль сероводорода дают 3363 кДж (по условию)
2 моль сероводорода дают 1121 кДж (по уравнению)
Сравнивая полученный ответ с предложенными вариантами, видим, что подходит ответ № 4.
При решении данной задачи в условиях ЕГЭ можно было не составлять термохимическое уравнение. Рассмотрим этот способ.
II способ
Согласно определению теплоты образования 1121 кДж выделяется при полном сгорании 2 моль H2S, следовательно, можно составить пропорцию:
1211 кДж выделяется при сгорании 2 моль H2S
3363 кДж выделяется при сгорании х моль H2S
Подходит ответ № 4.
Ответ: n(H2O) = 6 моль.
Задача 1.9
При горении магния в кислороде выделилось 3055 кДж теплоты. Согласно термохимическому уравнению:
2Мg + О2 = МgО + 1222 кДж
масса сгоревшего магния равна:
1) 24 г; 2) 60 г; 3) 120 г; 4) 240 г.
Дано: Количество выделившейся теплоты: Q = 3055 кДж.
Найти: масса сгоревшего магния: m(Mg) = ?
Решение:
I способ
Для выбора верного ответа удобнее всего провести расчет искомой в задаче величины и сравнить ее с предлагаемыми вариантами. Расчет по термохимическому уравнению ничем не отличается от расчета по обычному уравнению реакции. Над реакцией мы указываем данные в условии и искомые величины, под реакцией — их соотношения согласно коэффициентам. Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
Для вычисления количества вещества образовавшейся воды составляем пропорцию:
х г магния дают 3055 кДж (по условию)
48г магния дают 1222 кДж (по уравнению)
Сравнивая полученный ответ с предложенными вариантами, видим, что подходит ответ № 3.
При решении данной задачи в условиях ЕГЭ можно было не составлять термохимическое уравнение. Рассмотрим этот способ.
II способ
Согласно определению теплоты образования 1222 кДж выделяется при полном сгорании 48 г Mg, следовательно, можно составить пропорцию:
1222 кДж выделяется при сгорании 48 г Mg
3055 кДж выделяется при сгорании х г Mg
Видим, что подходит ответ № 3.
Ответ: m(Mg) = 120 г.
Задача 1.10.
При сгорании 2 моль пропена выделяется 4121 кДж теплоты. При сгорании 13,44 л пропена (н.у.) выделяется:1) 2472,6 кДж; 2) 1236,ЗкДж; 3) 8242кДж; 4) 1373 кДж.
Дано: Количество выделившейся теплоты: Q = 4121 кДж.
Найти: количество теплоты Q= х кДж = ?
Решение:
I способ
Для выбора верного ответа удобнее всего провести расчет искомой в задаче величины и сравнить ее с предлагаемыми вариантами. Расчет по термохимическому уравнению ничем не отличается от расчета по обычному уравнению реакции. Над реакцией мы указываем данные в условии и искомые величины, под реакцией — их соотношения согласно коэффициентам. Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
Для вычисления количества вещества образовавшейся воды составляем пропорцию:
44,8 л пропена дают 4121 кДж (по условию)
13,44 л пропена дают х кДж (по уравнению)
Сравнивая полученный ответ с предложенными вариантами, видим, что подходит ответ № 2.
При решении данной задачи в условиях ЕГЭ можно было не составлять термохимическое уравнение. Рассмотрим этот способ.
Согласно определению теплоты образования 4121 кДж выделяется при полном сгорании 44,8 л пропена, следовательно, можно составить пропорцию:
4121 кДж выделяется при сгорании 44,8 л пропена
х кДж выделяется при сгорании 13,44 л пропена
http://chemege.ru/magnij/
http://buzani.ru/zadachi/ege-khimiya/950-termokhimicheskie-uravneniya-zadacha-1-8-1-10