Основные теоретические положения
ЛАБОРАТОРНАЯ РАБОТА № 1
ОПРЕДЕЛЕНИЕ СОСТАВА И ТЕПЛОФИЗИЧЕСКИХ ПАРАМЕТРОВ ПРОДУКТОВ СГОРАНИЯ АВИАЦИОННОГО КЕРОСИНА
Цель работы
Целью работы является освоение методики расчёта теплофизических параметров и состава многокомпонентной газовой смеси на примере продуктов сгорания авиационного керосина, а также исследование зависимости удельной теплоёмкости продуктов сгорания от их температуры и состава.
Основные теоретические положения
Взаимосвязь между термическими параметрами рабочего тела устанавливается уравнением состояния [1,2]
Во многих случаях достаточно точной для описания состояния газообразных рабочих тел и его изменения в различных процессах, происходящих в тепловых машинах, является модель идеального газа. Уравнение состояния для идеального газа имеет вид
В качестве рабочих тел в тепловых машинах и других технических устройствах для взаимного преобразования различных видов энергии используются различные газы, жидкости и (или) их пары.
Воздух и продукты сгорания углеводородных топлив, используемые в качестве рабочих тел в большинстве тепловых двигателей, работающих в атмосфере, являются многокомпонентными газами. Установлено, что смесь идеальных газов обладает свойствами идеального газа и для нее справедливо уравнение состояния (1.2). Однако при проведении расчётов возникает необходимость определения ряда параметров газовой смеси: молярной массы m, газовой постоянной R, удельной изобарной теплоёмкости сp, плотности r и др.
Они могут быть установлены достаточно просто при известном составе газовой смеси, который может быть выражен через массовые доли компонентов (число компонентов п)

объёмные доли компонентов

или мольные доли

где величины с индексом i относятся к отдельным компонентам смеси. Здесь Vi – парциальный объём компонента, находящегося в смеси при парциальном давлении (такой объём компонент занимал бы при температуре Т и давлении p смеси).
Взаимосвязь массовых и объемных долей компонентов смеси идеальных газов выражается соотношениями

Уравнения для расчета параметров смеси идеальных газов при известных параметрах для отдельных компонентов имеют вид:
– молярная масса смеси

– удельные газовые постоянные компонентов смеси

где 
– удельная газовая постоянная смеси

– удельная массовая теплоёмкость при постоянном давлении

– удельная массовая теплоёмкость при постоянном объёме по уравнению Майера

– удельная мольная теплоёмкость


– удельная объёмная теплоёмкость




– парциальные давления компонентов

Значения истинных теплоёмкостей в уравнениях (1.10)…( 1.15) для отдельных компонентов зависят, главным образом, от температуры и задаются в табличной форме (табл. 1.6) или уравнениями вида сi = f(Т). Поэтому соответствующие параметры газовой смеси будут также являться функциями температуры.
В состав сухого воздуха входят следующие компоненты:
азот N2 ( 




В практических расчётах обычно принимают воздух состоящим из кислорода и атмосферного азота, относя к азоту все примеси. При этом объёмные доли компонентов принимают равными: 



Зависимости истинных теплоёмкостей cр = f(Т) для компонентов воздуха и продуктов сгорания углеводородных топлив в диапазоне температур Т= 600…1300 К могут быть аппроксимированы полиномами вида

Значения mi , Ri и коэффициенты полинома (1.18) даны в табл. 1.1.
Значения mi , Ri и коэффициенты полинома (1.18)
| Газ | mi , | Ri , | Коэффициенты полинома | ||
 |  | а0 | а1 | а2 | |
| Атмосферный азот N2атм | 28,15 | 0,2954 | 0,87455 | 0,36339 | -0,0811 |
| Кислород О2 | 0,2598 | 0,77723 | 0,47505 | -0,16188 | |
| Диоксид углерода СО2 | 0,1889 | 0,67209 | 0,84759 | -0,28332 | |
| Водяной пар Н2О | 0,4615 | 1,60160 | 0,68262 | 0,00771 | |
| Оксид углерода CO | 0,2968 | 0,86421 | 0,43879 | -0,11824 |
Помимо истинных теплоемкостей в расчетах могут применяться также их средние для интервала температур значения. За начальную температуру при вычислении средней теплоемкости газа может приниматься t0 = 0 о С или T0 = -273,15 о С (0 K).
В первом случае средняя теплоемкость определяется по формуле


Соответственно энтальпии могут вычисляться по формулам


При этом будут соблюдаться условия: 



Использование средних теплоемкостей 

В термодинамических процессах с изменением температуры T 

Элементарный химический состав углеводородного топлива с условной формулой СхНу может быть определен с учетом соотношений


где 



Расчётный состав продуктов сгорания определяется в первом приближении по основным компонентам – СО2,СО, Н2О, N2атм, О2 в пренебрежении диссоциацией компонентов вследствие относительно низких температур газа.
Если пренебречь наличием в продуктах сгорания весьма незначительных концентраций несгоревших углеводородовСхНуи частиц углерода (дыма), то всю невыделившуюся теплоту сгорания топливаQнеп.сгор. можно отнести к незавершенности реакции СО®СО2
где Q(СО ® СО2) = 285500 кДж/кмоль – экзотермический тепловой эффект этой реакции.
Тогда из уравнения

можно определить массовый секундный расход оксида углерода СО за камерой сгорания двигателя

Здесь 


Массовый расход элементов, участвующих в реакциях горения, и полученных компонентов газовой смеси можно определить из приводимых ниже стехиометрических уравнений горения элементов топлива.
1. Реакция неполного сгорания углерода такова
1 кмоль 0,5кмоль 1кмоль
12 кг 16 кг 28 кг
Количество углерода, окисленного в его оксид СО

Количество прореагировавшего при этом кислорода определяется как

Количество углерода в топливе, не участвующего в реакции

2. Реакция окисления углерода в его диоксид СО2 такова
1 кмоль 1 кмоль 1кмоль
12 кг 32 кг 44 кг
Количество образовавшегося СО2 равно

Количество прореагировавшего при этом кислорода определяется как

3. Реакция окисления водорода в воду Н2О такова
1 кмоль 0,5 кмоль 1кмоль
2 кг 16 кг 18 кг
Количество образовавшейся воды Н2О равно

Количество прореагировавшего при этом кислорода определяется как

4. Общее количество кислорода, участвовавшего в реакциях горения, равно

5. Количество остаточного кислорода в продуктах горения составляет

Здесь 
3. Описание экспериментальной установки
В качестве исследуемой многокомпонентной газовой смеси выступают продукты сгорания авиационного керосина ТС-1. Регулирование их состава в экспериментах осуществляется за счет различного соотношения массовых расходов сжигаемого топлива 


где 
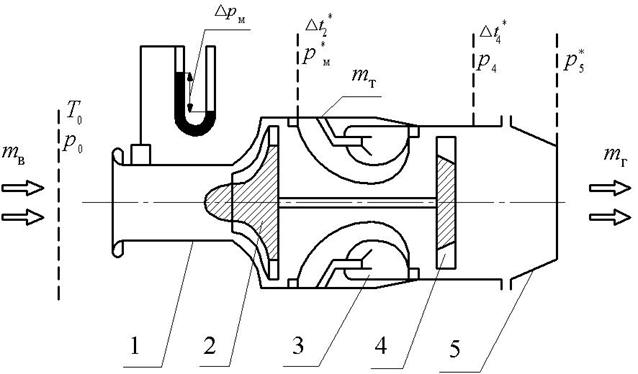
Рис. 1.1. Схема ТРД ТС-20 с контрольными сечениями:
1 – входное устройство с мерным участком, 2 – компрессор,
3 – камера сгорания, 4 – турбина, 5 – реактивное сопло
Последующее расширение газа в турбине и реактивном сопле с понижением температуры газа позволяет провести исследование зависимости удельной теплоемкости и показателя адиабаты продуктов сгорания различного состава от температуры: c = f(Т),k = f(Т).
При проведении эксперимента устанавливаются следующие параметры:
1. Давление р0 в окружающей среде, измеряется барометром в мм рт.ст.
2. Температура окружающей среды t0, измеряется спиртовым термометром в градусах Цельсия.
3. Перепад давления Dрм в мерном участке входного устройства, измеряется водяным пьезометром в мм вод.ст.
4. Полное давление 

5. Полная температура 

6. Статическое давление р4 за турбиной, измеряется по избыточному давлению с помощью образцового манометра (100 делений шкалы соответствуют избыточному давлению 
7. Полная температура 

8. Полное давление р5 * на срезе сопла, измеряется по избыточному давлению с помощью образцового манометра (100 делений шкалы соответствуют избыточному давлению 
9. Объемный расход топлива 
10. Частота вращения ротора турбокомпрессора п, измеряется с помощью тахометра ДТЭ-2 и частотомера ИЧ-6 (fп).
При выполнении лабораторной работы проводятся три эксперимента при различных режимах работы двигателя, отличающихся расходом топлива и числом оборотов ротора.
Результаты экспериментов вносятся в таблицу опытных данных (табл. 1.2).
| Режим | fп | р0 | t0 | Dрм |  | D  | р4 | D  | р5 * | fV |
| Гц | мм рт.ст. | о C | мм вод.ст. | делен. | o C | делен. | o C | делен. | Гц | |
| 1. | ||||||||||
| 2. | ||||||||||
| 3. |
4. Обработка результатов эксперимента
1. Прежде всего, необходимо перевести результаты измерений в единицы измерения системы СИ. Для этого используются следующие соотношения для единиц давлений:
1 мм рт.ст.=1 торр=133,6 Па; 1 мм вод.ст.=9,81 Па;
1 кг/см 2 = 9,81×10 4 Па.
Абсолютные давления по сечениям двигателя определяются с привлечением измеренных избыточных давлений
Температуры по сечениям двигателя определяются по формуле
Здесь температура холодного спая принимается tх.сп.= t0, где t0 – температура воздуха в лаборатории.
Частота вращения ротора турбокомпрессора п равна
Объёмный расход топлива определяется по формуле

Данные первичной обработки результатов экспериментов вносятся в табл. 1.3.
Данные первичной обработки результатов эксперимента
| Режим | fп | р0 | Т0 | Dрм |  абс. абс. |  | р4 абс. |  | р5 * абс. |  |
 | Па | К | Па | Па | К | Па | К | Па |  | |
| 1. | ||||||||||
| 2. | ||||||||||
| 3. |
2. Необходимыми данными для обработки результатов опытов являются:
а) характеристики керосина ТС-1:
– низшая теплотворная способность Ни = 42914 кДж/кг;
– стехиометрический коэффициент топлива 
– плотность топлива rТ = 0,775 ×10 3 кг/м 3 =0,775 кг/л ;
б) технические характеристики двигателя ТС-20:
– площадь входного устройства в мерном сечении Fм = 109,4×10 -4 м2 ;
– коэффициент полноты сгорания в камере hГ =0,97;
– коэффициент потерь полного давления в камере сгорания sк.с.= 0,92.
3. Расход воздуха находится по формуле

где удельный объем воздуха 

Здесь Rв = 287 Дж/(кг×K) – газовая постоянная воздуха.
Учитывая, что 


Здесь 
Скорость воздуха в мерном сечении определяется как

Здесь 
4. Массовый расход топлива равен


6. Коэффициент избытка воздуха в камере сгорания

7. Относительный расход топлива

8. Среднемассовая температура газа 

В (1.48) 

Хорошее совпадение с результатами точного расчета величины 



9. Считая в первом приближении изменение параметров газа в реактивном сопле, протекающим по обратимой адиабате, принимаем 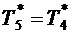


Здесь принимается, что 
10. Массовый состав продуктов горения определяется как

где значения 




Контрольная проверка расчётов исходит из их удовлетворения формуле 
11. Объёмные доли компонентов газовой смеси ri определяются по формуле (1.6), а контрольная проверка расчетов основывается на формуле 
12. Удельная истинная теплоемкость при постоянном давлении для компонентов газовой смеси cрi при температурах Т3, Т4, Т5 определяется по формуле (1.18) или по данным таблицы 1.6 методом интерполяции.
Полученные данные для каждого режима работы двигателя вносятся в табл. 1.4.
Расчётные данные для каждого режима
| Газ | gi | ri | T3 = , K | T4 = , K | T5 = , K |
| cp , кДж/(кг·К) | cp , кДж/(кг·К) | cp , кДж/(кг·К) | |||
| N2 атм | |||||
| О2 | |||||
| СО2 | |||||
| Н2О | |||||
| СО |
13. Удельная газовая постоянная газовой смеси R – по формуле (1.9).
14. Молярная масса газовой смеси m – по формуле (1.7).
15. Удельная истинная теплоемкость при постоянном давлении cр для газовой смеси – по формуле (1.10).
16. Удельная истинная теплоемкость при постоянном объеме cV для газовой смеси – по формуле (1.11).
17. Показатель адиабаты газовой смеси k – по формуле (1.16).
Полученные данные для трёх режимов сводятся в табл. 1.5.
Результаты расчёта для трех режимов работы ТРД
| Режим | aк.с. | m, кг/кмоль | R, кДж/ (кг·К) | T3, K | cp3, кДж/ (кг·К) | cv3, кДж/ (кг·К) | k3 |
Продолжение табл. 1.5
| Режим | T4, K | cp4, кДж/ (кг·К) | cv4, кДж/ (кг·К) | k4 | T5, K | cp5, кДж/ (кг·К) | cv5, кДж/ (кг·К) | k5 |
По результатам расчетов строятся графики зависимостей удельной теплоемкости и показателя адиабаты для продуктов сгорания в виде:
5. Требования к отчёту
Отчёт по лабораторной работе должен включать краткую информацию по теоретической части, схему экспериментальной установки с указанием контрольных сечений проточной части ТРД, таблицы результатов 3-х экспериментов и результатов проведённых расчётов, графики зависимостей
и выводы по работе. В них следует резюмировать полученные данные о массовом и объёмном составе продуктов горения керосина и проанализировать характер протекания зависимостей
При оформлении отчёта следует придерживаться следующих правил:
1. Результаты промежуточных вычислений фиксируются с точностью до 5 значащих цифр (например, р = 101320 Па, Т = 413,15 К, 
2. Вычисления представляются в следующей форме: расчётная формула, числовая подстановка, результат расчёта.
3. У результатов расчёта, представляющих собой размерные величины, обязательно указывается единица измерения.
4. При построении графиков вначале оцениваются диапазоны варьирования параметров и с их учётом наносятся равномерные шкалы, проставляются масштабные числа и с использованием этих масштабов наносятся экспериментальные или расчётные данные. При выборе масштабов должен использоваться предпочтительный ряд чисел: 1; 2; (2,5); 4; 5 и кратные им числа; использование в масштабах чисел 3; 6; 7; 9; 11; 13 и т.д. не допускается.
Истинные массовые теплоёмкости газов в составе продуктов сгорания керосина при постоянном давлении (по спектроскопическим данным [3]) в кДж/(кг×К) представлены в табл. 1.6.
Истинные массовые теплоёмкости газов в составе продуктов сгорания керосина при постоянном давлении (по спектроскопическим данным [3]) в кДж/(кг×К)
Общие указания
Закрепление знаний и приобретение практических навыков по темам:
а) Определение теплового эффекта химической реакции горения и температуры продуктов сгорания;
б) Определение теплоты сгорания углеводородных топлив;
в) Основные положения теории детонации;
г) Основные параметры камер сгорания авиационных ГТД.
2.1. Проверка готовности студентов к выполнению
2.2. Выдача заданий . . 5 мин.
2.3. Выполнение расчётов по названным темам. .мин.
2.4. Анализ полученных результатов расчётовмин.
2.5. Контрольный опрос и подведение итогов занятий мин.
Практическое занятие № 1
Тема: «Определение теплового эффекта химической реакции горения и температуры продуктов сгорания»
1. Основные сведения
Горением называют физико-химический процесс, при котором химическое превращение вещества сопровождается интенсивным выделением энергии и тепло — и массообменом с окружающей средой. Горение может начаться самопроизвольно в результате самовоспламенения (когда, например, температура окружающей среды оказывается равной или больше температуры воспламенения вещества) либо быть инициированным зажиганием (например, в авиационных двигателях при использовании дугового разряда свечи или пламени из специального воспламенителя).
Уравнение первого закона термодинамики для процесса, сопровождающегося химическими превращениями, в дифференциальной форме имеет следующий вид:

где 



В термохимии под тепловым эффектом реакции понимается величина 




Для изохорно-изотермического процесса работа расширения равна нулю (



Для изобарно-изотермической реакции уравнение первого закона термодинамики принимает следующий вид

или в интегральной форме

Здесь 


Поскольку внутренняя энергия и энтальпия являются функциями состояния вещества (


На основании этого постулата русский химик в 1840 году сформулировал закон: тепловой эффект реакции, состоящей из нескольких промежуточных стадий, не зависит от этих промежуточных стадий или их последовательности, а полностью определяется начальным и конечным состояниями системы.
Закон Гесса может быть выражен также следующим образом: если система посредством ряда химических превращений совершает круговой процесс при неизменных температуре и объёме или при неизменных температуре и давлении, то алгебраическая сумма тепловых эффектов должна быть равна нулю.
В качестве примера рассмотрим следующую задачу.
1. Определить тепловой эффект реакции неполного сгорания углерода при постоянном давлении

если известны тепловые эффекты при 


На основании закона Гесса можно написать:

При определении параметров продуктов химической реакции, представляющих смесь различных газов (компонентов), используют следующие законы:
— Дальтона (давление смеси р равно сумме парциальных давлений её компонентов)

— Амага (объём смеси V равен сумме парциальных объёмов её компонентов)

— уравнение состояния для идеального газа

где т – масса газа, кг; R – газовая постоянная, 
Для газа массой 1 кг это уравнение принимает вид:

где 


Состав смеси задаётся объёмными (молярными) или массовыми долями.
Объёмной долей 

Отсюда получаем, что сумма объёмных долей компонентов смеси равна единице:

Массовой долей 


Отсюда получаем, что сумма массовых долей компонентов смеси равна единице:

Пересчёт объёмных долей в массовые и обратно производится на основании закона Авогадро (отношение объёмов компонентов в смеси равно отношению количества молекул этих компонентов):
а) известны массовые доли компонентов, необходимо определить их объёмные доли


б) известны объёмные доли компонентов, необходимо определить их массовые доли

Если известны объёмные доли компонентов смеси, то её молярная масса находится по формуле:

Газовая постоянная для каждого из компонентов смеси определяется формулой:


Газовая постоянная смеси рассчитывается по одной из формул:

Парциальное давление компонентов смеси рассчитывается из условия, что температура каждого компонента 

В качестве примера рассмотрим следующие задачи:
Задача 1. Атмосферный воздух содержит приблизительно 23 % (по массе) кислорода О2 (молярная масса 

а) для кислорода
б) для азота
или
Задача 2. Чему равна молярная масса воздуха при условиях, указанных в задаче 1?
Задача 3. Продукты сгорания керосина в авиационном ГТД имеют следующий состав в массовых долях:
Определить газовую постоянную и плотность продуктов сгорания, а также парциальное давление отдельных газов, если 
1. Находим молярные массы компонентов смеси, используя их химические формулы:
2. Определяем газовые постоянные компонентов смеси;
3. Находим газовую постоянную смеси газов – продуктов сгорания
4. Из уравнения состояния для 1 кг смеси газов определяем плотность
5. Рассчитывается молярная масса смеси газов
6. Определяется парциальное давление компонентов, составляющих смесь:
Задача 4. Давление в баллонах кислородной системы самолета р1=4 МПа, температура кислорода t=20оС. Определить:
— массу кислорода в баллонах, если их суммарный объём равен V=48 л.;
— какое количество кислорода надо заправить в баллоны, чтобы повысить его давление до 15 МПа.
1. Из уравнения состояния находим массу кислорода в баллонах:

где 


2. Из уравнения состояния, написанного для исходной массы и для требуемой, получаем
Задача 1. Определить тепловой эффект 

если известны тепловые эффекты образования реагирующих веществ:
— углекислого газа 
— водяного пара 
— метана 
Буквой (г) обозначены агрегатные состояния реагирующих веществ.
Задача 2. Продукты сгорания керосина в авиационном ГТД имеют следующий состав в массовых долях:
Определить газовую постоянную и плотность продуктов сгорания, а также парциальное давление отдельных газов, если 
3. Контрольные вопросы для зачета по практическому занятию № 1
1. Уравнение состояния идеального газа для 1 кг газообразного вещества, где оно было использовано?
2. Дайте определение процесса горения.
3. Напишите и поясните уравнение первого закона термодинамики для изохорно-изотермической химической реакции.
4. Напишите и поясните уравнение первого закона термодинамики для изобарно-изотермической химической реакции.
5. Дайте формулировку закона Гесса и пример его использования.
Отчёт о работе должен содержать:
— условия задач №1 и №2;
— алгоритм решения задач;
— результаты решения задач.
Практическое занятие № 2
Тема: «Определение теплоты сгорания углеводородных топлив»
1. Основные сведения.
Топливом называют горючие вещества, применяемые для получения при их сжигании тепловой энергии; основная составная часть – углерод С. Топливо для авиационных двигателей может быть в виде жидкости или газа
Практически все жидкие топлива пока получают путём переработки нефти. Сырую нефть нагревают до 300…370оС, после чего полученные пары разгоняют на фракции, конденсирующиеся при различной температуре tк: сжиженный газ (выход около 1%), бензиновую (около 15 %, tк=30…180оС), керосиновую (около 17%, tк=120…135оС), дизельную (около 18%, tк=180…350оС). Жидкий остаток с температурой начала кипения 330…350оС называется мазутом. Указанные фракции служат исходным сырьём для получения смазочных материалов и топлив для двигателей внутреннего сгорания и газотурбинных двигателей – бензина, керосина, дизельных топлив и т. д.
Сжиженный газ, получаемый при первичной переработке нефти согласно ГОСТ с изменениями от 01.03.84 г. и 01.07.86 г., выпускают в виде технического пропана (не менее 93% 

при 20оС давление паров пропана составляет около 0.8, а бутана – около 0.2 МПа. Поэтому эти газы транспортируют в жидком виде в баллонах под небольшим давлением (менее 2 МПа).
К газообразным топливам относится прежде всего природный газ, основным компонентом которого является метан 



АСКТ представляет собой смесь предельных углеводородов от этана 




Под теплотой сгорания понимается количество теплоты, выделяющейся при полном сгорании единицы топлива. Теплоту сгорания твердого и жидкого топлива обычно относят к 1 кг, а газообразного – к 1 м3 (в нормальных условиях: температура 0оС, давление 760 мм рт. ст.=1.01325
Продукты сгорания пробы топлива остаются в калометрической бомбе и охлаждаются в ней до комнатной температуры. При этом вода, образующаяся при сгорании водорода и содержащаяся во влажном топливе, оказывается в жидком виде. Если в результате сгорания вода получается в виде жидкости, теплота сгорания называется высшей — 
В технических устройствах вода обычно выбрасывается вместе с продуктами сгорания в виде пара. Если в результате сгорания вода получается в виде пара, теплота сгорания называется низшей — 


Процесс сгорания углеводородных топлив заключается в распаде составляющих его сложных соединений на простые молекулы и группы атомов и в окислении входящих в их состав углерода и водорода кислородом воздуха.
Высшая теплота сгорания может быть определена по формуле

где 



Например, для нормального топлива – авиационного керосина: 

Низшая теплота сгорания топлива находится по формуле:

где 



При наличии кислорода и серы (в зависимости от месторождения нефти) авиационные керосины марки ТС-1 и РТ имеют 
В случае задания химической формулы углеводородного топлива доля углерода и водорода определяется в зависимости от молярной массы С и Н.
Например, метан, химическая формула 




Высшая теплота сгорания метана может быть определена по формуле:
а низшая теплота сгорания метана равна
Отклонение от значения, приведенного в таблице 1, составляет
2. Порядок выполнения работы.
1. Задается вид топлива из таблицы 1.
2. Определяется атомная масса газа и доли углерода и водорода в топливе.
3. Рассчитывается газовая постоянная по формуле:




4. Определяются высшая 

5. Производится оценка содержания примесей в топливе на основе величины отношения табличной величины 

3. Контрольные вопросы к практическому занятию № 2
1. Укажите состав и основные характеристики газообразного топлива.
2. Укажите состав и основные характеристики жидкого топлива.
3. Что называется теплотой сгорания топлива?
4. Напишите и поясните формулу Менделеева Дмитрия Ивановича для определения теплоты сгорания топлива.
4. Оформление отчёта:
1. Основные характеристики заданного топлива.
2. Алгоритм и результаты расчета высшей и низшей теплоты сгорания топлива.
Теплофизические свойства газовых топлив, авиакеросина ТС-1
ГОРЕНИЕ И ОКИСЛЕНИЕ
|/ак идёт горение в примусе и керосинке. Наиболее яр — ким примером химических реакций, идущих при участии кислорода воздуха, является горение — тот процесс, с помощью которого мы получаем тепло и свет. Какое бы
Топливо мы ни сжигали — уголь или дрова, керосин или бензии, спирт или светильный газ — главная химическая реакция при горении их одна и та же: углерод и водород, входящие в состав молекул топлива, соединяются с кислородом воздуха и образуют углекислоту и воду. Общеизвестно, что керосинка даёт жёлтое, светящее пламя, а примус — голубое или фиолетовое, почти не светящее пламя. В обоих случаях топливо одно и то же — керосин. Почему же это происходит?
Керосин — это смесь различных углеводородов, соединений углерода с водородом. Для примера возьмём один из углеводородов керосина — нонан, имеющий состав СуНго. При горении нонан соединяется с кислородом и образуются углекислота и вода. Начальное и конечное состояния этого процесса можно изобразить химическим уравнением:
С9Н20 + 1402 — 9 С02 + 10 Н20 (пар) + теплота,
Написав такое уравнение, мы допустили, что углеводород сгорает полностью. Это и происходит в исправном примусе. В примусе керосин поступает в горелку под давлением. Испаряясь в нагретой горелке й вырываясь сильной струёй через форсунку, керосин хорошо перемешивается с воздухом. Смесь получается настолько богатой кислородом, что керосин сгорает полностью. Кроме того, пары керосина, проходя через раскалённую часть горелки, не только нагреваются, но и химически изменяются: сложные молекулы углеводородов при температуре 400—500 градусов распадаются на более простые, сгорающие легче. Этот распад обычно сопровождается выделением небольшого количества твёрдого углерода — кокса; кокс постепенно засоряет горелку, поэтому время от времени её нужно «прожигать».
Мы знаем, что керосинка всегда даёт копоть или сажу, то-есть очень мелкие частицы угля. Значит, в керосинке идёт неполное сгорание керосина. Керосин испаряется с поверхности фитиля и только тут смешивается с воздухом. Количество воздуха внутри пламени оказывается недостаточным. Поэтому и образуются мельчайшие раскалённые частички угля, от которых ярко светится пламя.
Почему дрова и каменный уголь, сгорая, дают пламя, а древесный уголь горит без пламени? Различные виды твёрдого топлива сгорают по-разному: дрова и каменный
Уголь образуют при горении пламя, а древесный уголь пламени не даёт. Какова же разница между ними?
Древесная масса и каменный уголь — смеси сложных веществ, богатых углеродом. Они содержат также кислород и водород. При нагревании дров и каменного угля сложные вещества расщепляются на более простые и в то же время более летучие вещества. Эти вещества, сгорая, и образуют пламя. Дрова дают большее пламя, чем каменный уголь: они образуют больше летучих веществ.
Древесный же уголь получают неполным сожжением дерева. Хороший древесный уголь — это почти чистый углерод; к нему примешаны только минеральные — вещества, дающие после сгорания золу. Поэтому древесный уголь не образует летучих продуктов и горит без пламени.
Все жидкие вещества и горючие газы, разлагающиеся при высокой температуре с выделением летучих продуктов, при горении образуют пламя. Твёрдые вещества, не способные давать летучие продукты разложения, горят без пламени. При неполном горении всегда образуется дым, состоящий из твёрдых частичек несгоревшего угля и газообразных продуктов горения — окиси углерода, углекислоты, водяных паров.
Почему керосиновая лампа коптит, а рано закрытая печка даёт угар. Мы можем управлять химическими реакциями, заставлять их протекать нужным нам образом. Примеры этому легко найти в нашем быту.
Керосиновая лампа стала коптить. Ясно, что если выделяется копоть, горение идёт не полно. Мы убавили фитиль — копоть перестала образовываться. Почему? Потому, что мы изменили условия горения. Убавив фитиль, мы уменьшили скорость испарения керосина. Количество же поступающего в лампу воздуха осталось прежним. Поэтому горение стало более полным.
А почему рано закрытая печь даёт угар? — Потому, что нарушается режим горения и вместо одной реакции идёт другая. При недостатке воздуха, поступающего в печь, горение идёт не до конца: вместо углекислоты, СО2, образуется окись углерода или, как её иначе называют, угарный газ СО. Угарный газ невидим, так как, в отличие от дыма, он не содержит твёрдых частиц. Он очень ядовит.
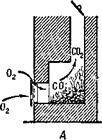
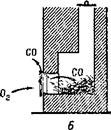
Окись углерода образуется и при открытой трубе, но так как приток кислорода в печь достаточный, она сгорает и образует углекислоту, уходящую в трубу
(рис. 7, А). При закрытой же трубе продукты горения выходят через печную дверцу в помещение. Если в печи осталось слишком много раскаленного угля, то притока воздуха хватает только на образование окиси углерода и в комнате появляется угар (рис. 7, £).
Рис. 7. А нормальное горение при открытой трубе; Б — образование угарного газа при большом количестве угля и закрытой трубе.

Чем отличается горение в печи от горения в живом организме? В печке сгорает топливо. Для организма топливом служит пища. И в организме и в печке углеродистые вещества сгорают, превращаясь в углекислоту и в воду.
В этом — сходство.
Разница же состоит в том, что в печке горение происходит при высокой температуре, а в живом организме — при низкой и значительно медленнее.
В печах, особенно промышленного типа — доменных, стекольных и др., температура превышает 1000 градусов. Тело человека имеет в среднем температуру 36,6 градуса. Химики установили, что повышение температуры на 10 градусов почти удваивает скорость реакции. Значит, горение в печи идёт во много раз быстрее, чем в организме.
Однако дело не только в этом. При высокой температуре реакция может протекать совсем иным путём. При 1000 градусов некоторая часть молекул кислорода (около 1,5 процента) распадается на атомы: 02^20. Значит, горение при высоких температурах можно объяснить тем, что с топливом вступают в реакцию свободные атомы кислорода, число которых по мере их расходования пополняется путём распада, диссоциации, новых молекул кислорода. Но в живых организмах молекулы кислорода не могут распадаться на атомы. Каким же образом происходит горение в организмах?
Общую теорию таких процессов разработал в конце прошлого столетия русский академик А. Н. Бах. Рядом опытов с простыми углеродистыми соединениями и с веществами, содержащимися в животных и растительных организмах, А. Н. Бах доказал, что при обыкновенной температуре к молекулам этих веществ присоединяются целые молекулы кислорода. При этом образуются такие соединения, которые способны окислять другие вещества так же легко, как и атомарный кислород. Эти соединения, называемые перекисями, являются промежуточными продуктами окисления.
Как же построены молекулы перекисей и какими свойствами они обладают?
Познакомимся сначала с простейшей перекисью — перекисью водорода Н202. Строение её изображается формулой Н—О—О—Н. Перекись водорода неустойчива, при хранении она медленно разлагается на воду и кислород: Н202=Н20+0. Значит, один из атомов кислорода в перекиси «подвижен»,«активен». Поэтому перекись водорода является хорошим окислителем.
В организмах животных и растений перекиси водорода нет, но с группой атомов —О—О—, характерной для перекисей, могут быть связаны атомы углерода органических соединений. Такие перекиси называют перекисями органических соединений, и они обнаружены в живых организмах. Им-то и принадлежит та исключительная роль в процессах медленного окисления в организме, на которую указал А. Н. Бах.
В организмах животных окисление пищевых материалов происходит в крови. В красных кровяных тельцах находится сложное белковое вещество, гемоглобин, окрашивающий кровь в красный цвет. В состав гемоглобина входит железо, придающее ему способность соединяться с кислородом. При дыхании гемоглобин окисляется (в лёгких) и превращается в оксигемоглобин. Сам оксигемоглобин не является настоящей перекисью, так как он отдаёт весь присоединённый кислород, а не половину, как это делают истинные перекиси. Но он легко превращает в перекиси некоторые пищевые вещества, попадающие в кровь, отдавая им свой кислород, и вновь переходит в гемоглобин. Кислород расходуется на окисление пищевых материалов, на выработку энергии, необходимой для поддержания жизни.
Есть ли разница между горением и окислением? По
Сходству с горением топлива естественно считать горением все химические процессы, протекающие с выделением тепла и света. Слово «горение» описывает внешние признаки и только одну сторону химической реакции — превращение химической энергии в тепловую и световую.
Но для химика описания только этой стороны реакции недостаточно. Он хочет знать, что происходит с каждым из атомов, входящих в состав вещества, как эти атомы изменяются во время реакции. И вот если с этой стороны посмотреть на реакции, происходящие при горении, то оказывается, что всегда какой-либо из атомов сгорающей молекулы увеличивает свою положительную валентность. Например, при сгорании СО в С02 положительная валентность углерода возрастает с 2 до 4, так как атом углерода оказывается связанным уже не с одним, а с двумя атомами кислорода. Углерод при горении окисляется. Поэтому мы называем окислением реакцию, в которой како й-л ибо элемент увеличивает свою положительную валентность.
А что делается при окислении с самим окисляющим веществом? В нашем примере окисляющим веществом служит кислород воздуха, простое вещество, которому мы условились (стр. 22) приписывать до реакции нулевую валентность. Входя в состав молекулы СОг, атом кислорода становится двухвалентным отрицательным. Реакцию, в которой атом каког о-л ибо элемента увеличивает свою отрицательную валентность, называют восстановлением. Следовательно, кислород воздуха, окисляя углерод СО, сам при этом восстанавливается. Из нашею примера мы видим, чго окисление и восстановление—два процесса — близнеца: они всегда сопровождают друг друга и невозможны один без другого.
Всякое ли окисление протекает как горение? Железо, окисляясь, ржавеет. Но разве мы можем сказать, что при этом железо горит. Конечно, нет. Разве в живом организме окисление сопровождается выделением света? — Нет, происходит только выделение тепла. Значит, окисление не всегда сопровождается горением. Но, как правило, все процессы горения являются окислением.
Могут ли горение и окисление происходить без кислорода? Окисляемый атом вовсе не обязательно должен отдавать свои валентные электроны именно атому кислорода. Очень легко это происходит и с другими элементами. Вернёмся к опыту, описанному на стр. 12. Железо, которое мы погружаем в раствор медного купороса,— простое вещество с нулевой валентностью. Железо активнее меди и вытесняет из раствора медь. В этой реакции вытеснения атом железа отдаёт атому меди 2 электрона и сам приобретает валентность + 2. Значит, и здесь железо окисляется! Атом же меди, забрав у атома железа 2 электрона, изменяет валентность с + 2 до нуля, восстанавливается.
Точно так же можно рассмотреть и реакцию между серой и железом (стр. 9). Оба они — простые вещества с нулевой валентностью. После реакции валентность железа + 2, а серы — 2, следовательно, железо окислилось, а сера восстановилась. Вспомним, что реакция между серой и железом сопровождается выделением тепла и света, то-есть горением, хотя кислород в ней и не участвует. Значит, не только окисление, но и горение может происходить без участия кислорода.
Почему железо ржавеет, а золото и серебро — нет? Из всех металлов наиболее широко используется в технике и в быту железо. Большим недостатком железа служит то, что оно легко соединяется с кислородом воздуха и водой, ржавеет. Так как ржавчина непрочно связана с поверхностью металла, она легко стирается, распыляется, приводя к большим потерям металла. Ржавление и подобные ему процессы разрушения металлов называют кор — роз и е й.
Подсчитано, что в результате коррозии во всём мире ежегодно теряется больше 30 миллионов тонн металлов. Это настоящее бедствие. Поэтому химики и физики упорно работают над вопросами борьбы с коррозией.
Ржавчина — это смесь водной закиси железа Ре (ОН)г, окиси железа Ре203, окалины Ре304 и некоторых других веществ. То, что железо окисляется уже при низкой температуре, объясняется его значительной химической активностью.
Другое дело — серебро, золото, платина и другие благородные металлы. Их активность очень мала. Ядра их атомов цепко удерживают валентные электроны и поэтому трудно окисляются. Соединения этих металлов непрочны, они легко распадаются с выделением свободных металлов. Хлористое и бромистое серебро, например, разлагается на свету. На этой реакции основана вся фотокинопромышленность [23]).
Неустойчивость солей серебра можно доказать интересным опытом. Подогреем в стаканчике нашатырный спирт (это — водный раствор аммиака) до 50—60 градусов и нальём в него при перемешивании несколько капель раствора ляписа (азотнокислого серебра). Затем добавим несколько капель формалина или раствора виноградного сахара — глюкозы. Через несколько минут на стенках стаканчика образуется серебряное зеркало, а в растворе появится тёмная муть. Формалин или глюкоза восстанавливают серебро из его соли. Эта реакция используется для изготовления зеркал.
Итак, мы познакомились с составом воздуха и отметили особую роль кислорода в природе, которую ему обеспечивает его большая химическая активность. Но очень многие реакции с участием кислорода шли бы совсем иначе, а некоторые — не были бы даже возможны, если бы на помощь кислороду при его воздействии на другие вещества не приходила вода. Вода, подобно кислороду, играет в природе громадную роль и обладает многими очень важными свойствами. Их мы и рассмотрим в следующем разделе.
http://pandia.ru/text/78/382/680.php
http://msd.com.ua/ximiya-vokrug-nas/gorenie-i-okislenie/