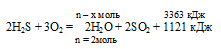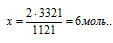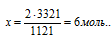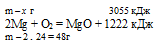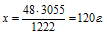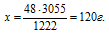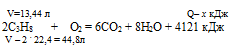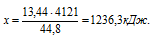Напишите уравнения реакций горения сероводорода: а) при недостатке кислорода, б) в избытке кислорода.
Ваш ответ
Похожие вопросы
- Все категории
- экономические 43,289
- гуманитарные 33,621
- юридические 17,900
- школьный раздел 607,151
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Вычисление количества теплоты, количества и массы веществ реакций горения сероводорода, пропена и магния
Задача 1.8.
При полном сгорании сероводорода в избытке кислорода выделилось 3363 кДж теплоты. Согласно термохимическому уравнению:
2Н2S + 3О2 = 2Н2O + 2SO2 + 1121 кДж
количество вещества образовавшейся воды составляет:
1) 1 моль; 2) 2 моль; 3) 4 моль; 4) 6 моль.
Дано: Количество выделившейся теплоты: Q = 3363 кДж.
Найти: количество вещества образовавшейся воды: n(H2O) = ?
Р е ш е н и е:
I способ
Для выбора верного ответа удобнее всего провести расчет искомой в задаче величины и сравнить ее с предлагаемыми вариантами. Расчет по термохимическому уравнению ничем не отличается от расчета по обычному уравнению реакции. Над реакцией мы указываем данные в условии и искомые величины, под реакцией — их соотношения согласно коэффициентам. Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
Для вычисления количества вещества образовавшейся воды составляем пропорцию:
х моль сероводорода дают 3363 кДж (по условию)
2 моль сероводорода дают 1121 кДж (по уравнению)
Сравнивая полученный ответ с предложенными вариантами, видим, что подходит ответ № 4.
При решении данной задачи в условиях ЕГЭ можно было не составлять термохимическое уравнение. Рассмотрим этот способ.
II способ
Согласно определению теплоты образования 1121 кДж выделяется при полном сгорании 2 моль H2S, следовательно, можно составить пропорцию:
1211 кДж выделяется при сгорании 2 моль H2S
3363 кДж выделяется при сгорании х моль H2S
Подходит ответ № 4.
Ответ: n(H2O) = 6 моль.
Задача 1.9
При горении магния в кислороде выделилось 3055 кДж теплоты. Согласно термохимическому уравнению:
2Мg + О2 = МgО + 1222 кДж
масса сгоревшего магния равна:
1) 24 г; 2) 60 г; 3) 120 г; 4) 240 г.
Дано: Количество выделившейся теплоты: Q = 3055 кДж.
Найти: масса сгоревшего магния: m(Mg) = ?
Решение:
I способ
Для выбора верного ответа удобнее всего провести расчет искомой в задаче величины и сравнить ее с предлагаемыми вариантами. Расчет по термохимическому уравнению ничем не отличается от расчета по обычному уравнению реакции. Над реакцией мы указываем данные в условии и искомые величины, под реакцией — их соотношения согласно коэффициентам. Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
Для вычисления количества вещества образовавшейся воды составляем пропорцию:
х г магния дают 3055 кДж (по условию)
48г магния дают 1222 кДж (по уравнению)
Сравнивая полученный ответ с предложенными вариантами, видим, что подходит ответ № 3.
При решении данной задачи в условиях ЕГЭ можно было не составлять термохимическое уравнение. Рассмотрим этот способ.
II способ
Согласно определению теплоты образования 1222 кДж выделяется при полном сгорании 48 г Mg, следовательно, можно составить пропорцию:
1222 кДж выделяется при сгорании 48 г Mg
3055 кДж выделяется при сгорании х г Mg
Видим, что подходит ответ № 3.
Ответ: m(Mg) = 120 г.
Задача 1.10.
При сгорании 2 моль пропена выделяется 4121 кДж теплоты. При сгорании 13,44 л пропена (н.у.) выделяется:1) 2472,6 кДж; 2) 1236,ЗкДж; 3) 8242кДж; 4) 1373 кДж.
Дано: Количество выделившейся теплоты: Q = 4121 кДж.
Найти: количество теплоты Q= х кДж = ?
Решение:
I способ
Для выбора верного ответа удобнее всего провести расчет искомой в задаче величины и сравнить ее с предлагаемыми вариантами. Расчет по термохимическому уравнению ничем не отличается от расчета по обычному уравнению реакции. Над реакцией мы указываем данные в условии и искомые величины, под реакцией — их соотношения согласно коэффициентам. Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
Для вычисления количества вещества образовавшейся воды составляем пропорцию:
44,8 л пропена дают 4121 кДж (по условию)
13,44 л пропена дают х кДж (по уравнению)
Сравнивая полученный ответ с предложенными вариантами, видим, что подходит ответ № 2.
При решении данной задачи в условиях ЕГЭ можно было не составлять термохимическое уравнение. Рассмотрим этот способ.
Согласно определению теплоты образования 4121 кДж выделяется при полном сгорании 44,8 л пропена, следовательно, можно составить пропорцию:
4121 кДж выделяется при сгорании 44,8 л пропена
х кДж выделяется при сгорании 13,44 л пропена
Сероводород
Сероводород
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1 о .
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
http://buzani.ru/zadachi/ege-khimiya/950-termokhimicheskie-uravneniya-zadacha-1-8-1-10
http://chemege.ru/serovodorod/