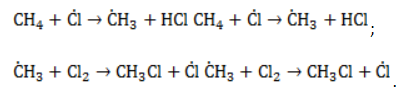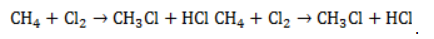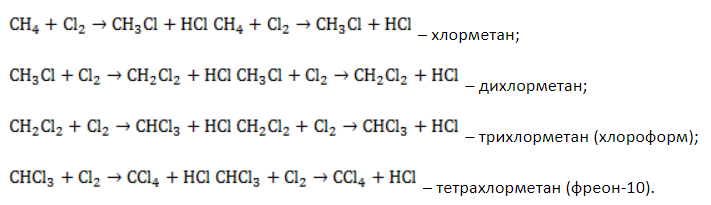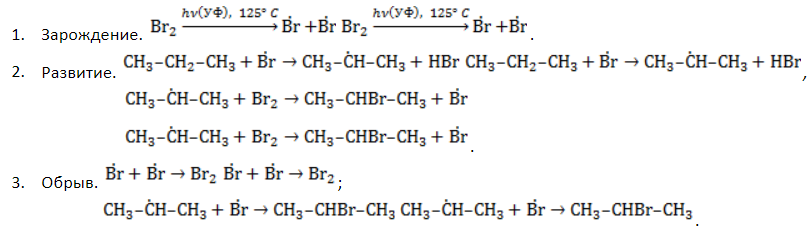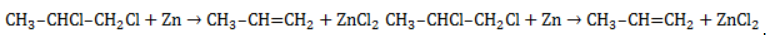Галогенирование алканов на примере пропана
Галогенирование – процесс присоединения к молекуле органического соединения атома галогена – это одно из химических взаимодействий, в которых участвуют углеводороды ряда алканов. Благодаря общности структуры молекул у всех членов гомологического ряда реакции с галогеном обладают единым характером. При этом галогенирование пропана и следующих за ним в гомологическом ряду соединений имеет особенности, связанные с наличием в молекулах вторичных, третичных и четвертичных атомов углерода.
Краткая характеристика алканов
К простейшим органическим соединениям относятся ациклические насыщенные, или предельные углеводороды (алканы). Их отличают следующие структурные особенности:
- неразветвленные (прямые) или разветвленные молекулы, не содержащие циклических образований;
- все химические связи в молекуле – одинарные.
Общая формула имеет вид 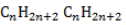
Механизм замещения у алканов носит радикальный характер, так как разрыв слабополярной связи C-H протекает с образованием пары свободных радикалов – нейтральных частиц, имеющих по одному неспаренному электрону. Атом водорода может замещаться галогеном, нитрогруппой или сульфогруппой.
Галогенирование алканов
Реакция свободно-радикального замещения (обозначается символом SR – от англ. substitution radical reaction) водородного атома в молекуле алкана атомом галогена называется галогенированием. Ее инициирование требует воздействия ультрафиолетового облучения или повышенной температуры. Реакция носит цепной характер, так как в каждом ее акте образуются свободные радикалы, генерирующие следующий акт.
Замещение фтором – фторирование – чрезвычайно экзотермический процесс, сопровождающийся взрывом и разрушением молекулы алкана. Реакция с участием йода, наоборот, является эндотермической и обратимой – в ходе ее происходит восстановление продукта реакции йодоводородом, поэтому прямое йодирование неэффективно. Практический интерес представляют реакции алканов с хлором и бромом.
Стадии галогенирования
Удобнее всего рассмотреть, какой механизм имеет реакция хлорирования алканов, на примере метана. При облучении или нагреве реакционной смеси реакция инициируется, и далее цепная реакция протекает в несколько стадий.
- Зарождение цепи – распад молекулы хлора на активные радикалы:
- Развитие цепи. Взаимодействуя с молекулой метана
, радикал
отщепляет от нее атом водорода с образованием метил-радикала
, который, в свою очередь, расщепляет другую молекулу хлора. Эти элементарные акты повторяются многократно, образуя новые радикалы и развивая цепную реакцию:
- Обрыв цепи. Цепной процесс прекращается, когда радикалы реагируют между собой:
В общем виде уравнение галогенирования метана хлором записывается в форме:
Процесс замещения не ограничивается образованием хлорметана, на молекулы которого также воздействуют радикалы 
Выход продуктов зависит от мольного соотношения реагентов и условий реакции. Так, при эквимолярном количестве метана и хлора и температуре 440° C соотношение молярных долей продуктов в процентах составляет около 39:41:19:1.
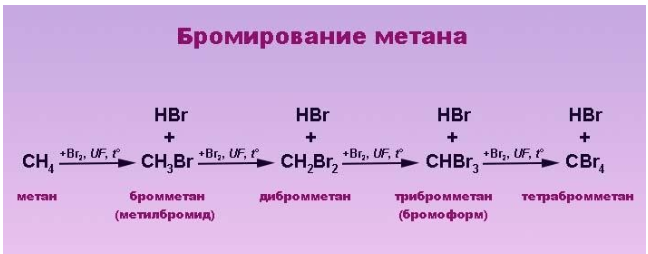
Реакция бромирования отличается меньшим выделением энергии и протекает медленнее, так как его реакционная способность ниже, чем у хлора.
Региоселективность
Начиная с пропана 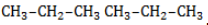
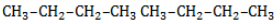
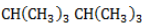
Селективность зависит от следующих факторов:
- Активность реагента. Чем активнее галоген, тем слабее проявляется избирательность при замещении водорода. Так, при взаимодействии алкана с хлором региоселективность значительно меньше, чем в реакциях с бромом, или не наблюдается.
- Температура. Нагревание ведет к снижению селективности.
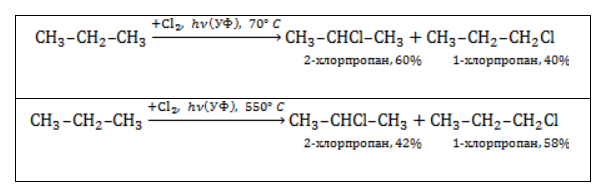
Хлорирование и бромирование пропана
В реакции пропана с хлором при низкой температуре селективная направленность выражена слабо. Несмотря на то, что образующиеся в ходе реакции радикалы 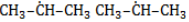
При нагревании радикалы хлора атакуют первичные атомы даже более активно, так как на разрыв их связи с водородом затрачивается меньше энергии.
При бромировании пропана региоселективность вследствие меньшей активности брома достигает высоких значений:
Бромирование протекает аналогично реакции с участием простейших алканов с преимущественным замещением водорода у вторичных атомов:
Продуктом этой реакции является 2-бромпропан.
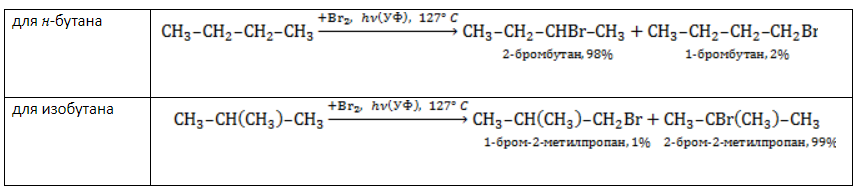
Галогенирование бутана
В реакциях бутана с хлором селективность не играет заметной роли. Даже при низкой температуре соотношение продуктов хлорирования может быть различным:
Бромирование бутана демонстрирует большую селективность:
Реакция отщепления
Активные двухвалентные металлы (как правило, магний или цинк) отщепляют от молекул дигалогеналканов атомы хлора или брома, если они замещают водород у двух соседних атомов углерода. Между последними образуется двойная связь. Продуктом такой реакции является алкен.
Пример реакции дегалогенирования алканов – отщепление цинком атомов хлора от 1,2-дихлорпропана с образованием пропилена (пропена) и хлорида цинка:
Применение галогеналканов
Хлорированные и бромированные алканы применяются в качестве промежуточных соединений в различных отраслях, таких как синтез высокомолекулярных соединений, производство лаков, красок и растворителей. Хлоралканы служат сырьем для фторалканов, которые нельзя получить прямым фторированием.
Токсичность галогеналканов тем меньше, чем активнее входящий в их состав галоген. Поэтому фторалканы наиболее безопасны. Фторсодержащие фреоны широко используются в качестве вспенивателей, хладагентов и пропеллентов.
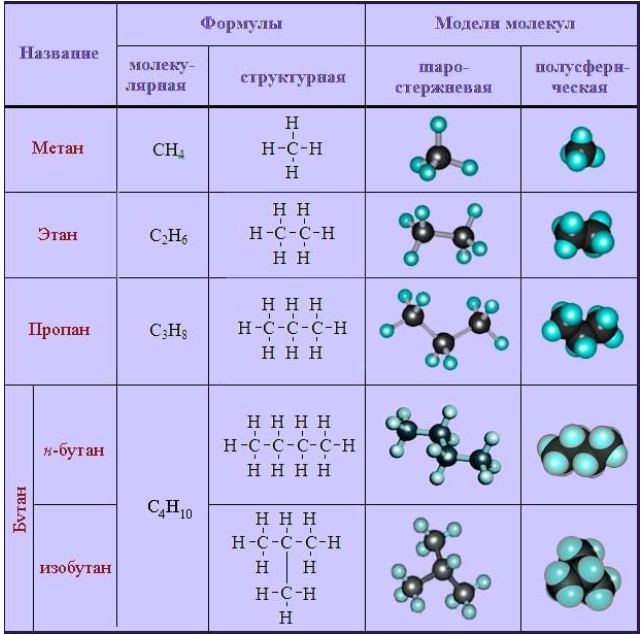
Алканы. Свойства алканов.
Алканы – насыщенные (предельные) углеводороды. Представителем этого класса является метан (СН4). Все последующие предельные углеводороды отличаются на СН2 – группу, которая называется гомологической группой, а соединения – гомологами.
Строение алканов.
Каждый атом углерода находится в sp 3 – гибридизации, образует 4 σ— связи (1 С-С и 3 С-Н). Форма молекулы в виде тетраэдра с углом 109,5°.
Связь образуется посредством перекрывания гибридных орбиталей, причем максимальная область перекрывания лежит в пространстве на прямой, соединяющей ядра атомов. Это наиболее эффективное перекрывание, поэтому σ-связь считается наиболее прочной.
Изомерия алканов.
Для алканов свойственна изомерия углеродного скелета. Предельные соединения могут принимать различные геометрические формы, сохраняя при этом угол между связями. Например,
Различные положения углеродной цепи называются конформациями. В нормальных условиях конформации алканов свободно переходят друг в друга с помощью вращения С-С связей, поэтому их часто называют поворотными изомерами. Существует 2 основные конформации – «заторможенное» и «заслоненное»:
Изомерия углеродного скелета алканов.
Количество изомеров возрастает с увеличением роста углеродной цепи. Например у бутана известно 2 изомера:
Для пентана – 3, для гептана – 9 и т.д.
Если у молекулы алкана отнять один протон (атом водорода), то получится радикал:
Физические свойства алканов.
В нормальных условиях – С1-С4 – газы, С5-С17 – жидкости, а углеводороды с количеством атомов углерода больше 18 – твердые вещества.
С ростом цепи повышается температура кипения и плавления. Разветвленные алканы имеют более низкие температуры кипения, чем нормальные.
Алканы нерастворимы в воде, но хорошо растворяются в неполярных органических растворителях. Легко смешиваются друг с другом.
Получение алканов.
Синтетические методы получения алканов:
1. Из ненасыщенных углеводородов — реакция «гидрирования» протекает под воздействием катализатора (никель, платина) и при температуре:
2. Из галогенпроизводных – реакция Вюрца: взаимодействие моногалогенаклканов с металлическим натрием, в результате чего получаются алканы с удвоенным числом углеродных атомов в цепи:
3. Из солей карбоновых кислот. При взаимодействии соли с щелочи, получаются алканы, которые содержат на 1 атом углерод меньше по сравнению с исходной карбоновой кислотой:
4. Получение метана. В электрической дуге в атмосфере водорода:
В лаборатории метан получают так:
Химические свойства алканов.
В нормальных условиях алканы – химически инертные соединения, они не реагируют с концентрированной серной и азотной кислотой, с концентрированной щелочью, с перманганатом калия.
Устойчивость объясняется прочностью связей и их неполярностью.
Соединения не склонны к реакциях разрыва связи (реакция присоединения), для них свойственно замещение.
1. Галогенирование алканов. Под воздействием кванта света начинается радикальное замещение (хлорирование) алкана. Общая схема:
Реакция идет по цепному механизму, в которой различают:
А) Инициирование цепи:
Суммарно можно представить в виде:
2. Нитрование (реакция Коновалова) алканов. Реакция протекает при 140 °С:
Легче всего реакция протекает с третитичным атомом углерода, чем с первичным и вторичным.
3. Изомризация алканов. При конкретных условиях алканы нормального строения могут превращаться в разветвленные:
4. Крекинг алканов. При дейсвии высоких температур и катализаторов высшие алканы могут рвать свои связи, образуя алкены и алканы более низшие:
5. Окисление алканов. В различных условиях и при разных катализаторах окисление алкана может привести к образованию спирта, альдегида (кетона) и уксусной кислоты. В условиях полного окисления реакция протекает до конца – до образования воды и углекислого газа:
Применение алканов.
Алканы нашли широкое применение в промышленности, в синтезе нефти, топлива и т.д.
Алканы. Химические свойства. Радикальное замещение на примере реакции галогенирования
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
На уроке будет рассмотрена тема: «Алканы. Химические свойства. Радикальное замещение на примере реакции галогенирования». Вы узнаете много нового о химических свойствах алканов. Рассмотрите, что представляет собой радикальное замещение, используя для примера реакцию галогенирования.
http://www.calc.ru/Alkany-Svoystva-Alkanov.html
http://interneturok.ru/lesson/chemistry/10-klass/predelnye-uglevodorody/alkany-himicheskie-svoystva-radikalnoe-zameschenie-na-primere-reaktsii-galogenirovaniya


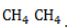 , радикал
, радикал 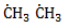 , который, в свою очередь, расщепляет другую молекулу хлора. Эти элементарные акты повторяются многократно, образуя новые радикалы и развивая цепную реакцию:
, который, в свою очередь, расщепляет другую молекулу хлора. Эти элементарные акты повторяются многократно, образуя новые радикалы и развивая цепную реакцию: