Систематический анализ катионов IV, V, VI групп
Систематический анализ катионов IV, V, VI групп
Анализ смеси начинают с предварительных наблюдений и испытаний.
Прежде всего обращают внимание на цвет раствора и определяют рН. По цвету раствора можно сделать вывод о наличии или отсутствии катионов Cr +3 , Fe +3 , Cu +2 , Ni +2 , Co +2 .
Низкое значение рН раствора может быть обусловлено присутствием сильно гидролизующихся солей висмута, ртути, железа. Если величина рН заметно не изменяется после осторожной нейтрализации, то можно предположить, что могут присутствовать какие–либо из этих катионов. Если анализируемый раствор имеет щелочную реакцию, то могут присутствовать [Cu(NH3)4] 2+ , [Co(NH3)4] 2+ . Сурьма и олово в этом случае могут находиться в виде анионов соответствующих кислот.
Предварительные испытания
В отдельных порциях раствора обнаруживают ионы Fe 2+ , Fe 3+ .
Отделение катионов IV группы от катионов V и VI групп.
15 – 20 капель исследуемого раствора помещают в пробирку, добавляют несколько капель H2O2 для окисления ионов марганца(II) и ионов сурьмы(III), затем избыточное количество 2н. раствора гидроксида натрия (до щелочной реакции), нагревают в течение 3-5 минут и тщательно перемешивают стеклянной палочкой. Избыток пероксида водорода удаляют кипячением. Полученную смесь центрифугируют, получают осадок 1 и раствор 1.
Осадок 1 Раствор 1
Отделение ионов Al +3 и Sn(IV) в виде гидроксидов
К раствору 1 добавляют небольшими порциями кристаллический NH4Clи упаривают раствор до небольшого объема. Центрифугируют полученную смесь и получают осадок 2 и раствор 2.
Осадок 2 Раствор 2
Обнаружение ионов алюминия и олова(IV)
Осадок 2 обрабатывают 2н. раствором HCl. Полученный раствор, содержащий ионы Al +3 и [SnCl6]‾ 2 делят на две части и в одной из них обнаруживают ионы алюминия, в другой – олова.
Обнаружение ионов алюминия
К 5-7 каплям испытуемого раствора добавляют 3-5 капель 2н. CH3COOH, и
5-7 капель алюминона. Смесь осторожно нагревают, перемешивают и добавляют раствор аммиака до щелочной реакции, а затем 4 капли 2н раствора карбоната аммония. Выпадает красный осадок или появляется красная окраска.
Алюминий можно обнаружить с помощью 8-оксихинолина (условия проведения реакции см. качественные реакции).
Обнаружение олова (IV)
Металлический магний и металлическое железо восстанавливают олово(IV) до Sn(II):
[SnCl6]‾ 2 + Mg = Sn 2+ + 6Cl ‾ + Mg 2+ или
[SnCl6]‾ 2 + Fe = Sn 2+ + 6Cl ‾ + Fe 2+
Реакции протекают в кислой среде. Образовавшиеся в результате восстановления ионы Sn 2+ можно обнаружить по реакции восстановления Bi 3+ .
Обнаружение ионов Zn 2+
Раствор 2 нагревают с концентрированным раствором Na2CO3 до полного удаления аммиака. Полученную смесь центрифугируют, получают осадок 3 и раствор 3.
Осадок 3 Раствор 3
Осадок 3 обрабатывают 2н. раствором HCl, в полученном растворе открывают цинк реакцией с дитизоном или какой либо другой качественной реакцией (условия проведения реакций см. качественные реакции на ионы цинка).
Обнаружение CrO4 ‾2
Желтая окраска раствора 3 указывает на присутствие CrO4 ‾2 . Подтвердить это можно реакцией образования надхромовой кислоты: Добавляют к исследуемому раствору 6н. раствора серной кислоты до кислой реакции, затем несколько капель 3% -ного раствора пероксида водорода и эфира. Смесь осторожно встряхивают, синяя окраска слоя эфира подтверждает присутствие хрома.
Обнаружение и отделение ионов сурьмы(V)
Осадок 1 обрабатывают при слабом нагревании небольшим количеством 2н. раствора азотной кислоты в присутствии 3%-ного раствора пероксида водорода. Смесь центрифугируют, получают осадок 4 и раствор 4.
Осадок 4 Раствор 4
H2SbO3 Fe 3+ , Mn 2+ , Mg 2+ , Cu 2+ , Cd 2+ , Ni 2+ , Co 2+ , Hg 2+ , Bi 3+
Осадок 4 обрабатывают сероводородной водой, вследствие образования Sb2S5, осадок окрашивается в оранжево-красный цвет.
Отделение катионов V группы от катионов IV группы
К раствору 4 добавляют при нагревании концентрированный раствор NH4OH, смесь центрифугируют, получают осадок 5 и раствор 5.
Осадок 5 Раствор5
Mn(OH)2, Fe(OH)2 Аммиакаты Ni 2+ , Co 2+ , Hg 2+ ,Cu 2+ , Cd 2+
Отделение и обнаружение ионов Mg 2+
К осадку 5 добавляют 2н. раствор NH4Cl (для растворения гидроксида магния) и 3%-ный раствор H2O2 (для окисления ионов марганца), Полученную смесь центрифугируют, отделяют раствор 6 от осадка 6.
Осадок 6 Раствор 6
В растворе 6 обнаруживают ионы магния гидрофосфатом натрия в присутствии аммиака и хлорида аммония.
Отделение и обнаружение ионов Mn(VII)
Осадок 6 обрабатывают 2н. раствором HNO3 . Смесь центрифугируют, получают осадок 7 и раствор 7.
Осадок 7 Раствор 7
Осадок 7 промывают дистиллированной водой и обрабатывают при нагревании 3н. раствором HNO3 и концентрированным раствором H2O2. К полученному раствору добавляют 1-2 крупинки висмутата натрия. В присутствии Mn(VII) раствор приобретает фиолетово-розовую окраску вследствие образования MnO4 ‾ .
Обнаружение Bi 3+
К раствору 7 добавляют 2н. раствора NH4OH до появления осадка BiOCl, затем добавляют несколько капель 2н. раствора HCl и кипятят. Затем смесь центрифугируют, получают осадок 8 и раствор 8.
Осадок 8 Раствор 8
BiOCl (не исследуется)
Осадок 8 обрабатывают раствором станнита натрия. Осадок чернеет вследствие образования металлического висмута.
Разрушение аммиакатов катионов VI группы
и отделение ионов Cu 2+ , Hg 2+
К раствору 5 добавляют до кислой реакции 2н. раствор H2SO4, затем при нагревании добавляют концентрированный раствор Na2S2O3. Полученную смесь центрифугируют.
Осадок 9 Раствор 9
Отделение и обнаружение ионов Cu 2+
Осадок 9 обрабатывают при нагревании 2н. раствором HNO3, смесь центрифугируют, получают осадок 10 и раствор 10.
Осадок 10 Раствор 10
HgS (не исследуется) Cu 2+
В растворе 10 открывают ионы Cu 2+ реакцией с раствором аммиака по синему окрашиванию раствора вследствие образования [Cu(NH3)4] 2+ .
Обнаружение ионов Co 2+ , Ni 2+ , Cd 2+
Раствор 9 делят на три части. В одной из них открывают кобальт реакцией с NH4SCNили KSCN. Во второй аликвоте открывают никель реакцией с диметилглиоксимом, а в третьей – при рН = 0,5 осаждают желтый осадок CdS сероводородом.
Лабораторная работа №4. Аналитическая посуда и весы. Основные правила работы с ними
1 Теоретическая часть
В практике количественного анализа для измерения объёма жидкости применяют различную измерительную посуду: мерные колбы, пипетки, бюретки, пробирки, мерные цилиндры.
Мерные колбы рассчитаны на объемы 5, 10, 25, 50, 100, 200, 250, 500, 1000, 2000 см 3 . Они могут быть калиброваны на вливание и выливание, могут иметь обычную или пришлифованную пробку. Колбы, откалиброванные на вливание, имеют одну, на выливание – две кольцевые отметки: одну на объем вливаемого раствора, вторую – на объем выливаемого раствора, равный номиналу колбы. Это объясняется тем, что при выливании часть раствора остается на стенках колбы.
Навеску твердого вещества пересыпают в мерную колбу через сухую чистую воронку, причем высыпать навеску рекомендуется понемногу во избежание застревания частиц вещества в трубке воронки. Не следует начинать обмывание воронки водой прежде, чем вся навеска из неё не высыплется в колбу. Остатки вещества в воронке тщательно без потерь смывают небольшими порциями воды. После этого заполняют колбу до 1/3 или ½ вместимости растворителем и перемешивают до полного растворения.
Заполнение мерных колб, особенно последними порциями раствора или растворителя, проводят осторожно, по каплям, чтобы не добавить излишки растворителя, до совмещения нижнего края мениска раствора с отметкой на колбе (см. рисунок 1а). В случае окрашенных растворов (см. рисунок 1б) совмещают с отметкой верхний край мениска (нижний плохо виден).
 |
Рисунок 1 – Вид совмещенного края мениска с отметкой на колбе для неокрашенных прозрачных растворов (а), для окрашенных растворов (б)
Бюретки применяют для титрования и отмеривания точных объемов раствора. В зависимости от назначения различают объемные, весовые, газовые, поршневые и микробюретки. В простейшем виде она представляет собой трубку с делениями, в нижней части которой имеется кран или резиновая трубка с капилляром, снабженная зажимом Мора. Бюретки выпускают двух классов точности, отклонение в объеме у бюреток первого класса точности равно половине цены деления, у второго класса – цене деления. Перед работой бюретку промывают титрантом и заполняют её выше нулевой отметки, затем сливают титрант по каплям до совмещения края мениска с нулевым делением. Бюретку устанавливают на нуль только после того, как в носике бюретки или капилляре не осталось пузырьков воздуха. Титровать необходимо от нулевой отметки, от других отметок не рекомендуется, так как шкала может быть неравномерной. Заполнение бюретки титрантом производят через воронку или с помощью специальных приспособлений.
Пипетки предназначены для отмеривания точного объёма выливаемой жидкости. В зависимости от формы, наличия градуировки и объема выпускаются в восьми исполнениях. Из градуированных пипеток можно сливать любой произвольный объём в пределах её емкости. Неградуированные рассчитаны на один строго определенный объем жидкости. Допустимые отклонения объема пипеток зависят от класса точности и равны у пипеток первого класса точности половине цены деления, второго класса – цене деления. Пипетки рекомендуется заполнять растворами с помощью специальных резиновых груш. Пипетка при отборе жидкости должна находиться в строго вертикальном положении, при этом уровень жидкости располагают на уровне глаз наблюдателя. Раствор сливают из пипетки, касаясь её кончиком стенки заполняемого сосуда. Иногда замедляют скорость сливания раствора, закрывая часть верхнего отверстия пипетки пальцем. Выдувать остатки раствора из пипетки нельзя.
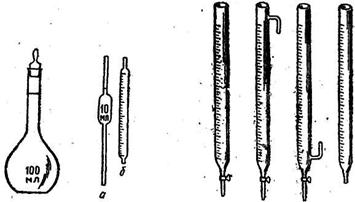 |
Рисунок 2 – Мерная колба; Пипетки; Бюретки
Для не очень точных объёмных измерений применяют цилиндры, мензурки (см. рисунок 3), мерные пробирки.
Цилиндры выпускают с носиком и с пришлифованной пробкой и градуируют на наливание или отливание; допустимые отклонения у первых достигают 1-2% объёма, у вторых – вдвое больше. Мензурки градуируют на отливание, допустимое отклонение у них равно 5% объёма. Мерные пробирки выпускают номинального объёма от 5 до 25 см 3 , они имеют крайне не высокую точность градуировки. Их используют для отмеривания объёмов растворов вспомогательных веществ, не учитывающихся при вычислении анализа.
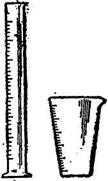 |
Рисунок 3 – Мерные цилиндры и мензурки
Кроме стеклянной посуды в лабораторной практике применяется фарфоровая посуда (см. рисунок 4)
1 – чашки; 2 – стаканы; 3 – тигли с крышками; 4 – воронки Бюхнера;
5 – ступки с пестиком; 6 – лодочки; 7 – треугольники.
Рисунок 4 – Фарфоровая посуда
Весы и техника взвешивания
Весы предназначены для измерения массы вещества. В зависимости от требуемой точности в лабораториях пользуются либо техническими или технохимическими, либо аналитическими весами. Технические и технохимические весы позволяют производить взвешивание с погрешностью до ±0,01 г с предельной нагрузкой до десятка килограммов (технические весы) и до 1 кг (технохимические). У аналитических весов различной конструкции предельная нагрузка изменяется от 20 до 200 г и погрешность взвешивания составляет ±0,0001 г.
В лабораторной практике применяют разнообразные технические и технохимические весы. Более совершены последние; они имеют арретирное и балансировочное устройства, повышающие надежность и стабильность показаний весов. К весам прилагается набор гирь, помещенный в футляр, – разновес. Масса гирь-разновесок разная – от 10 мг до 500 г; она обозначена цифрами на каждой гирьке.
Лабораторные технохимические весы Т-200. Перед началом работы весы (см. рисунок 5) устанавливают на ровной поверхности стола по отвесу 6, вращая установочные винты 8, и проверяют правильность работы весов. Для этого поворачивают ручку арретира 9 и наблюдают за колебанием стрелки 5: если она отклоняется вправо и влево на одинаковое число делений, весы работают правильно. Если отклонение в одну сторону немного больше, чем в другую, подвинчивают балансировочные гайки 3 на концах коромысла. Если разница в отклонении вправо и влево значительная, проверяют правильность сборки весов и чистоту их деталей – призм, чашек и т. д.
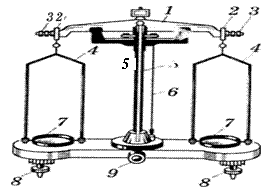 |
1 – коромысло; 2 – серьга; 3 – балансировочные гайки; 4 – стремена;
5 – стрелка; 6 – отвес; 7 – чашки; 8 – установочные винты; 9 – арретир.
Рисунок 5 – Лабораторные технохимические весы Т-200
Взвешиваемый предмет помещают на левую чашку весов, а разновески – на правую. Сначала ставят крупную разновеску, подходящую к массе предмета, затем последовательно заменяют ее или добавляют более мелкие разновески, добиваясь состояния равновесия; при этом разница в колебаниях стрелки вправо и влево не должна быть более одного деления. Подсчитывают массу всех разновесок на чашке, записывают ее и сразу же укладывают гирьки в футляр, еще раз проверяя суммарную массу.
При взвешивании на технических весах следует строго соблюдать общие правила, гарантирующие правильность взвешивания.
1. Все действия с предметом и гирьками можно проводить только при арретированных весах (ручка 9 повернута влево до упора).
2. Нельзя взвешивать предметы, имеющие температуру, отличную от комнатной.
3. Нельзя взвешивать сыпучие вещества непосредственно на чашке весов – следует помещать их в сухой стакан, тигель, бюкс или на часовое стекло.
4. Весы и гирьки необходимо содержать в чистоте и постоянно готовыми к работе.
Важными характеристиками аналитических весов являются их чувствительность, а также цена деления шкалы. Чувствительность определяется числом делений шкалы, на которое отклоняется стрелка при нагрузке массой 1 мг, и выражается в делениях шкалы на миллиграмм (дел/мг). С увеличением массы взвешиваемого предмета чувствительность весов уменьшается.
Ценой деления шкалы называют груз, необходимый для смещения стрелки шкалы на одно деление. Цена деления обратно пропорциональна чувствительности весов.
Равновесное положение стрелки ненагруженных весов называют нулевой точкой . При нагруженных весах это положение соответствует точке равновесия. Определение нулевой точки необходимо проводить перед началом каждого взвешивания.
Чтобы получать правильные результаты при взвешивании и не вывести из строя весы, необходимо соблюдать ряд общих правил взвешивания.
1. Перед началом взвешивания проверяют состояние весов и устанавливают нулевую точку так, как это описано в указаниях по технике взвешивания.
2. Взвешиваемый предмет и гирьки помещают на чашки весов, а также снимают их только при закрытом арретире; открывать и закрывать арретир нужно медленно и плавно.
3. Предмет и гирьки помещают в центр чашки. Нельзя взвешивать предмет, имеющий температуру, отличную от температуры весовой комнаты. Разновески берут только пинцетом и ставят не на рабочий стол, а только на весы или в футляр, где они хранятся.
4. Нельзя взвешивать влажные и грязные предметы. Сыпучие вещества нельзя помещать непосредственно на чашку весов или взвешивать на листе бумаги; взвешиваемое вещество должно быть только в бюксе, стаканчике или на часовом стекле. Жидкости, выделяющие пары, а также гигроскопические вещества взвешивают только в закрытом бюксе.
5. Для ускорения взвешивания на аналитических весах рекомендуется предварительное взвешивание на технических весах, с точностью до 0,1 г.
Титриметрический метод анализа
Лабораторная работа №5. Количественное определение вещества методом кислотно — основного титрования
1 Теоретическая часть
Кислотно — основное титрование
Метод основан на реакции между кислотами и основаниями и в общем виде может быть представлен уравнением: H 3 O + + ОН – → 2 H 2 O .
Учебное пособие: Химический анализ катионов
| Название: Химический анализ катионов Раздел: Рефераты по химии Тип: учебное пособие Добавлен 09:27:33 06 июля 2009 Похожие работы Просмотров: 21521 Комментариев: 19 Оценило: 4 человек Средний балл: 4.5 Оценка: неизвестно Скачать | |
| 2 | Анализ смеси катионов первой группы. |
| 3 | Проведение частных реакций катионов второй аналитической группы. |
| 4 | Анализ смеси катионов второй аналитической группы. |
| 5 | Решение задач на правило произведения растворимости. |
| 6 | Проведение частных реакций катионов третьей аналитической группы. |
| 7 | Анализ смеси катионов третьей аналитической группы. |
| 8 | Составление уравнений окислительно-восстановительных реакций. |
| 9 | Проведение частных реакций катионов четвертой аналитической группы. |
| 10 | Анализ смеси катионов четвертой аналитической группы. |
| 11 | Проведение частных реакций анионов первой, второй, третьей аналитической групп. |
| 12 | Анализ сухой соли. |
| 13 | Определение кристаллизационной воды в кристаллогидратах. |
| 14 | Вычисления в весовом анализе. |
| 15 | Приготовление рабочего раствора щелочи и стандартного раствора щавелевой кислоты. |
| 16 | Определение нормальности и титра раствора щелочи |
| 17 | Определение содержания серной кислоты в растворе. |
| 18 | Приготовление рабочего раствора перманганата калия и установление нормальной концентрации и титра по щавелевой кислоте. |
| 19 | Определение содержания железа в соли Мора. |
| 20 | Выполнение расчетов эквивалентов окислителя и восстановителя. |
| 21 | Приготовление рабочего раствора нитрата серебра и установление нормальной концентрации. |
| 22 | Определение содержания хлорида натрия в растворе. |
Раздел I . Качественный анализ
Тема 1.1 Классификация катионов и анионов. Первая аналитическая группа катионов
Лабораторная работа №1.
«Аналитические реакции катионов 1 аналитической группы
Цель работы: изучение характерных реакций наиболее распространенных катионов.
Оборудование : пробирки, держатель, спиртовка, фильтровальная бумага, индикаторная бумага, стеклянные палочки, соли калия, соли натрия, соли аммония, гексанитрокобальтит натрия, гидротартрат натрия, дигидроантимонат калия, гидроксид натрия.
Перед выполнением лабораторной работы необходимо усвоить материал:Классификация катионов и анионов. Общая характеристика катионов первой аналитической группы. Значение катионов первой аналитической группы в осуществлении химико-технологического контроля.
Частные реакции катионов первой аналитической группы. Реакции катионов натрия (действие дигидроантимоната калия; реакция окрашивания пламени); калия (действие дигидротартрата натрия и кобальтинитрита натрия (гексанитрокобальтата натрия), реакция окрашивания пламени); аммония (действие щелочей, реактив– Несслера, реакция разложения аммонийных солей).
Данная группа катионов не имеет группового реагента.
Приготовление анализируемых растворов солей.
К 10 мл. дистиллированной воды добавим 1г. соли, тщательно перемешаем.
Опыт №1. Реакции катионов калия.
При добавлении двух-трех капель реактива к такому же количеству раствора соли калия образуется желтый кристаллический осадок.
К двум-трем каплям раствора добавьте раствор реактива, затем потрите стеклянной палочкой о стенки пробирки. Через некоторое время появляется белый кристаллический осадок калиевой соли.
Ионы калия окрашивают пламя в фиолетовый цвет.
Опыт №2. Реакции ионов натрия.
После добавления раствора реактива к исследуемому раствору следует потереть стеклянной палочкой стенки пробирки. Образуется белый кристаллический осадок натриевой соли.
Ионы натрия окрашивают пламя в желтый цвет.
Опыт №3. Реакции катионов аммония.
Реакции с едкими щелочами (гидроксид натрия).
Щелочи при нагревании выделяют из растворов солей аммония газообразный аммиак, который можно обнаружить по характерному запаху, а также с помощью влажной фильтровальной бумаги, пропитанной раствором фенолфталеина.
В присутствии газообразного аммиака индикаторная бумага изменяет окраску.
Результаты проведенных опытов занесите в таблицу
| Определяемый | Среда | Условия | Реактив | Наблю- | Уравнение |
| ион | реакции | даемое | реакции | ||
| явление |
Лабораторная работа №2.
«Анализ смеси катионов 1 аналитической группы
Цель работы: закрепление знаний, полученных при изучении свойств катионов; выработка навыков и умений систематического анализа катионов.
Оборудование : пробирки, держатель, спиртовка, фильтровальная бумага, индикаторная бумага, стеклянные палочки, анализируемый раствор, реактив Несслера, гидротартрат натрия, дигидроантимонат калия.
Перед выполнением работы, необходимо усвоить материал:
Частные реакции катионов первой аналитической группы. Реакции катионов натрия (действие дигидроантимоната калия; реакция окрашивания пламени); калия (действие дигидротартрата натрия и кобальтинитрита натрия (гексанитрокобальтата натрия), реакция окрашивания пламени); аммония (действие щелочей, реактив – Несслера, реакция разложения аммонийных солей). Систематический ход анализа смеси катионов первой аналитической группы.
Предварительные испытания. При анализе смеси катионов всех аналитических групп, прежде всего необходимо обратить внимание на окраску и реакцию раствора. Отсутствие окраски дает возможность предположить, что в растворе нет ионов: Cr 3+ , Fe 3 +, Cu 2+ , Co 2+ , Ni 2+ . Нейтральная реакция раствора показывает на отсутствие катионов: Sn 2 +, Sn 4 +, Bi 3 + Hg 2 +
Затем в отдельных пробах раствора проводят реакции с серной и хлороводородной кислотами, а также с хлоридом олова.
Если при прибавлении к отдельной пробе анализируемого раствора серной кислоты осадка не образуется, то в растворе отсутствуют катионы: Pb 2 +, Sr 2+ , Ba 2+ и, вероятно, Ca 2 +.
Если не выпадает осадок при пробе с HCl, то можно сделать вывод об отсутствии Ag+, Hg 2+ и, возможно, Pb 2 +.
Если же при прибавлении к отдельной пробе порции раствора NaOH и SnCl2 не появляется черный осадок то в растворе отсутствуют катионы Bi 3 +, Hg 2+ , [Hg2 ] 2 +.
Ход анализа смеси катионов 1 группы обусловлен следующими факторами:
– присутствие катиона NH4 + мешает открытию ионов Na + и K +;
– реакции обнаружения катиона NH4 + реактивом Несслера и действием щелочи при нагревании специфичны.
Предварительное обнаружение. Обнаружение NH4 + проведите реактивом Несслера.
К 1–2 мл. исследуемого раствора добавьте 1–2 капли реактива.
Систематический анализ. Если в анализируемом растворе обнаружены ионы NH4 + , они мешают обнаружению ионов Na + и K + их отделяют.
Для удаления ионов NН4 + раствор выпарьте и прокалите до исчезновения белого «дыма», добавляя к сухому остатку 1–2 капли концентрированной НС1. Полноту удаления ионов NН, + проверьте на предметном стекле реактивом Несслера, прибавляя к 1–2 каплям реактива крупинку сухого остатка. При отсутствии ионов NН, + сухой остаток растворите в нескольких каплях воды. Полученный раствор исследуйте на присутствие ионов Na + и K + с помощью реактивов на эти катионы – гидротартратом натрия (NaHC4 H4 O6) и дигидроантимонатом калия(KH2 SbO4 .)
Полученные данные занесите в таблицу:
| Что делали | Что наблюдали | Уравнения реакций | Вывод |
Тема 1.2 Вторая аналитическая группа катионов
Лабораторная работа №3.
«Проведение частных реакций катионов 2 аналитической группы
Цель работы: выявить катионы калия, натрия, аммония.
Оборудование : пробирки, держатель, спиртовка, фильтровальная бумага, водяная баня, растворы нитрата серебра и нитрата свинца, соляная кислота, раствор иодида калия, аммиак, этиловый спирт, дист. вода, раствор уксусной кислоты, гидроксид натрия.
Перед выполнением лабораторной работы необходимо усвоить материал:
Общая характеристика второй аналитической группы катионов. Значение катионов второй группы в проведении химико-технологического контроля
Групповой реактив и условия его применения. Гидролиз солей. Произведение растворимости (ПР), условие образования осадков. Частные реакции катионов второй группы. Реакции катионов бария (действие группового реактива – карбоната аммония, серной кислоты, хромата калия; реакция окрашивания пламени); кальция (действие группового реактива – карбоната аммония, оксалата аммония; реакция окрашивания пламени); магния (действие группового реактива – карбоната аммония, гидрофосфата натрия, щелочей).
Групповой реагент – раствор Н Cl .
Приготовление анализируемых растворов солей.
К 10 мл. дистиллированной воды добавим 1г. соли, тщательно перемешаем.
Опыт №1. Реакции катионов серебра.
Реакция с хлоридами. В четыре пробирки поместите по 3–4 капли раствора нитрата серебра и столько же 2 М НС1. Что при этом наблюдаете? Напишите уравнения реакции.
Реакция с иодидами. В четыре пробирки поместите по 3–4 капли раствора нитрата серебра и по 2–3 капли раствора йодистого калия. Наблюдайте образование осадка. Отметьте цвет осадка. Что при этом наблюдаете? Напишите уравнения реакции.
Реакция с гидроксидами. В две пробирки поместите по 3–4 капли раствора нитрата серебра. Прибавьте в одну пробирку 3–4 капли раствора гидроксида натрия, а в другую – 3 капли разбавленного раствора аммиака. Рассмотрите образовавшиеся осадки. Отметьте их цвет. Прилейте во вторую пробирку избыток аммиака. Объясните причину исчезновения осадка. Что при этом наблюдаете? Напишите уравнения реакции.
Опыт №2. Реакции катионов свинца.
Реакция с хлоридами. Поместите в пробирку 3–4 капли раствора нитрата свинца и 3–4 капли этилового спирта, 2–3 капли 2н раствора НС1. Рассмотрите выпавший осадок. Прилейте к нему 5–6 капель дистиллированной воды и перемешайте. Изменилось ли количество осадка? Нагрейте содержимое пробирки на водяной бане. Что при этом происходит? Почему? Охладите раствор до комнатной температуры. Что вы наблюдаете в пробирке? Добавьте несколько капель – этанола. Объясните, почему вновь наблюдается выделение РЬС12 из раствора. Что при этом наблюдаете? Напишите уравнения реакции.
Реакция с гидроксидами. К 3–4 каплям раствора нитрата свинца медленно, по каплям, прибавляйте раствор гидроксида натрия. Рассмотрите выпавший осадок и проследите за его растворением. Напишите уравнения реакций.
Реакция с иодидами. Поместите в пробирку 2–3 капли раствора нитрата свинца. Прибавьте 1 мл дистиллированной воды, 3 капли раствора иодида калия и несколько капель разбавленного раствора уксусной кислоты. Нагрейте пробирку на водяной бане, а затем охладите полученный раствор под струей воды. Что при этом наблюдаете? Кристаллы какого вещества выпадают в осадок? Напишите уравнения реакции.
Результаты проведенных опытов занесите в таблицу
| Определяемый | Среда | Условия | Реактив | Наблю- | Уравнение |
| ион | реакции | даемое | реакции | ||
| явление |
Лабораторная работа №4.
«Анализ смеси катионов 2 аналитической группы»
Цель работы: научиться выявлять катионы 2 группы из смеси.
Оборудование: анализируемый раствор, 2н НС1 и С2 Н5 ОН, 0,1М НС1, вода, иодид калия, К2 СгО7, концентрированный раствор аммиака, концентрированная азотная кислота, водяная баня, спиртовка, держатель, пробирки, фильтровальная бумага, индикаторная бумага.
Перед выполнением лабораторной работы необходимо усвоить материал:
Частные реакции катионов второй группы. Реакции катионов бария (действие группового реактива – карбоната аммония, серной кислоты, хромата калия; реакция окрашивания пламени); кальция (действие группового реактива – карбоната аммония, оксалата аммония; реакция окрашивания пламени); магния (действие группового реактива – карбоната аммония, гидрофосфата натрия, щелочей).Систематический ход анализа смеси катионов второй аналитической группы.
Ход анализа смеси катионов 2 группы обусловлен следующими факторами:
• растворимость хлоридов в воде различна (наибольшей является растворимость хлорида свинца, которая сильно увеличивается при повышении температуры);
• осадок хлорида серебра растворяется в аммиаке с образованием комплекса, а осадок хлорида ртути при взаимодействии с раствором аммиака чернеет с выделением металлической ртути;
• практически нет реактива, позволяющего открывать тот или иной катион 2 группы в присутствии других катионов.
К 15 каплям анализируемого раствора прибавьте двойной объем 2н НС1 и С2 Н5 ОН. Полученную смесь отфильтруйте.
Осадок промойте 2–3 раза 0,1М НС1, а затем обработайте несколькими каплями кипящей воды. Промывную жидкость исследуйте на присутствие РЬ 2+ реакцией с иодидом калия или с К2 СгО7 . Если ионы РЬ 2+ обнаружили, то осадок обработайте кипящей водой до полного удаления РЬС12 (до прекращения образования желтого осадка при действии иодидом калия или с К2 СгО7 на промывные воды). Осадок на фильтре после удаления РЬС12 обработайте концентрированным раствором аммиака. Для разрушения комплекса к фильтрату но каплям прибавляйте концентрированную азотную кислоту до кислой реакции. Выпадение белого осадка или образование мути свидетельствует о присутствии в анализируемом растворе ионов Аg + .
Результаты проведенных опытов занесите в таблицу
| Что делали | Что наблюдали | Вывод (уравнения реакций) |
Практическая работа №5.
«Вычисление произведения растворимости»
Цель работы: научиться вычислять произведения растворимости.
Оборудование: разработка п\р.
Перед выполнением работы необходимо усвоить материал:
Произведение растворимости. Условия образования осадков.
Произведение растворимости – это произведение активностей ионов малорастворимого электролита в его насыщенном растворе. При данной температуре эта величина постоянная.
Произведение растворимости малорастворимых веществ при 25 °
| Соединение | ПР |
| BaCrO4 | 2,0•10- 10 |
| CaCO3 | 4,8•10- 9 |
| CaCrO4 | 7,0•10- 9 |
| CaC2 O4 | 2,6•10- 9 |
| CaSO4 | 9,1•10– 6 |
| Ca3 (PO4 )2 | 2,0•10- 29 |
| Mg(OH)2 | 5,0•10- 12 |
| PbI2 | 1,1•10- 9 |
| PbCl2 | 1,7•10- 5 |
| PbCrO4 | 1,8•10- 14 |
| PbSO4 | 2,2•10- 8 |
| Pb3 (PO4 )2 | 7,9•10- |
| SrSO4 | 3,2•10- |
Пример: Произведение растворимости иодида свинца при 20 °С равно 8•10- 9 . Вычислите растворимость соли (моль/дм 3 и г/дм 3 ) при указанной температуре.
Решение Обозначим искомую растворимость через х (моль/дм 3 ). Тогда в насыщенном растворе PbI2 содержится х моль/дм 3 ионов Pb 2+ и 2х моль/дм 3 ионов I — Откуда:
ПР(PbI2 ) = [Pb 2+ ] [I — ] 2 = х(2х) 2 = 4х 3 ,
х= 3 ПР(PbI2 )/4 = 3 810 -9 /4 = 1,3• 10- 3 моль/дм 3 .
Поскольку мольная масса РbI 2 равна 461 г./моль, то растворимость PbI 2 , выраженная в г/дм 3 , составит 1,3•10- 3 •461 = 0,6 г/дм 3 .
Пример: Вычислите растворимость Pb3 (PO4 )2 и выразите ее в моль/дм 3 и г/дм 3 , если ПР [Pb3 (PO4 )2 ] = 1,50•10- 32 .
ПР[Pb3 (PO4 )2 ] = [Pb 2+ ] 3 [PO 3 4 — ] 2 . Растворимость малорастворимого вещества состава Аа Вb равна: ПР(Аа Вв )/а а вв
тогда растворимость Pb3 (PO4 )2 составит:
ПР [Pb3 (PO4 )2 ]/33. 22 =51, 50.10–32/ 108=51, 3810 -34 = =1,68•10- 7 моль/дм Чтобы выразить растворимость в г/дм 3 следует полученную величину (моль/дм 3 ) умножить на мольную массу Pb3 (PO4 )2 , т.е. на 811 г./моль. Тогда растворимость Pb3 (PO4 )2 составит: 1,68•10 -7 •811=
Пример: Может ли образоваться осадок Mg(OH)2 , если смешать равные объемы 0,5 М раствора MgCl2 и 0,1 М раствора NaOH?
Решение При сливании двух равных объемов суммарный объем раствора увеличится вдвое, а концентрация уменьшится вдвое, то есть концентрация раствора MgCl2 будет равной 0,5/2 = 0,25 моль/дм 3 , а концентрация NaOH – равной 0,1/2 = 0,05 моль/дм 3 .
Находим произведение концентраций ионов [Mg 2 +] [OH — ] 2 = 0,25•0,05 2 = = 6,25•10- 4 . Сопоставляя полученную величину 6,25•10- 4 с табличным значением ПР = 5,00•10- 12 , находим, что рассчитанное произведение концентраций ионов превышает ПР [Mg(OH)2 ], т.е. раствор пересыщен и осадок должен образоваться.
Пример: Вычислите растворимость PbSO4 и выразите ее в моль/дм 3 и г/дм 3 , если
ПР(PbSO4 ) = [Pb 2+ ] [SO 2 4 — ] = 2,2•10- 8 .
Растворимость PbSO4 = [Pb 2+ ] = [SO 2- ] = ПР (PbSO4 ) = 1,48•10 — 4 моль/дм 3 .
M(PbSO4 ) = 303 г./моль. Растворимость PbSO4 составит:
1,48•10- 4 •303 = 4,48•10- 2 г/дм 3 .
Пример: Растворимость гидроксида магния Mg(OH)2 при 18 °С равна 1,7•10 -4 моль/дм 3 . Найдите произведение растворимости Мg(OH)2 при этой температуре.
Решение При растворении каждого моля Mg(OH)2 в раствор переходит 1 моль ионов Mg 2 + и вдвое больше ионов OH — Следовательно, в насыщенном растворе Mg(OH)2 :
[Mg 2 +] = 1,7•10- 4 моль/дм 3 ; [OH — ] = 3,4•10- 4 моль/дм 3 .
ПР(Mg(OH)2 ) = [Mg 2 +] [OH-] 2 = 1,7•10- 4 (3,4•10- 4 ) 2 = 1,96•10- 11

Лабораторная работа №6.
«Проведение частных реакций катионов 3 аналитической группы
Цель работы: выявить катионы кальция, бария и стронция.
Оборудование: растворы солей кальция, бария, стронция (хлориды), серная кислота,
К 4 [Fе (СN)6 ], К2 СгО4, концентрированный раствор аммиака, раствор хлорида аммония, раствор сульфата кальция, К2 Сг2 07, СН3 СООNa, микроскоп, часовое стекло, пробирки, водяная баня, спиртовка, держатель, проволока, пробирки.
При подготовке к лабораторной работе необходимо усвоить материал:
Общая характеристика третьей аналитической группы катионов. Значение катионов третьей аналитической группы в осуществлении химико-технологического контроля.
Сущность окисления-восстановления. Амфотерность. Групповой реактив и условия его применения Частные реакции катионов третьей аналитической группы. Реакции катионов железа (III) (действие группового реактива – сульфида аммония, щелочей, гексацианоферрата (II) калия, роданида аммония); марганца (действие группового реактива – сульфида аммония, щелочей, реакция окисления марганца висмутатом натрия), хрома (действие группового реактива – сульфида аммония, щелочей, реакция окисления хрома перекисью водорода), цинка (действие группового реактива – сульфида аммония, щелочей, сероводорода), алюминия (действие группового реактива – сульфида аммония, щелочей, гидроксида аммония, хлорида аммония).
Опыт №1. Реакции иона кальция .
Реакция с сульфатами. Реакцию можно провести микрокристаллоскопическим способом. Для этого смешайте на предметном стекле капли растворов СаС12 и Н2 S04 , осторожно подсушите раствор на стекле до появления белой каймы. Под микроскопом посмотрите форму образовавшихся кристаллов и зарисуйте в лабораторной тетради. Напишите уравнения реакций.
Реакция на окрашивание пламени. При помощи нихромовой проволоки с петлей на конце захватите кристаллик хлорида кальция и внесите его в бесцветное пламя спиртовки. Отметьте окраску пламени.
Реакция с гексацианоферратом ( II ) калия К 4 [ F е(С N )6 ]. В две пробирки поместите по 3–4 капли раствора СаС12 , прибавьте 2–3 капли раствора аммиака и 3–5 капель раствора хлорида аммония. Смесь нагрейте до кипения, затем прибавьте 8–10 капель насыщенного раствора К 4 [Fе(СN)6 ]. Что наблюдаете? Напишите уравнения реакции.
Опыт №2. Реакции иона стронция.
Реакция с сульфатами . К 4 -5 каплям раствора SгС12 добавьте столько же гипсовой воды – насыщенный раствор СаS04 . Раствор нагрейте на водяной бане. Что наблюдаете? Отметьте цвет осадка.
Реакция на окрашивание пламени. В пламя спиртовки внесите несколько кристалликов SгС12 и отметьте цвет пламени. Что наблюдаете
Опыт №3. Реакция иона бария.
Реакция с сульфатами. В четыре пробирки поместите по 2–3 кайли раствора ВаС12 , прибавьте по несколько капель гипсовой воды. Какой осадок при этом образуется? Почему? Напишите уравнение реакции.
Реакция с хроматами. В две пробирки поместите по 3–4 капли раствора ВаС12 , добавьте 3–4 капли раствора К2 Сг04 , нагрейте на водяной бане. Что наблюдаете? Напишите уравнения реакции.
Осадок образуется и при действии дихромата калия К2 Сг2 07 . Для этого в три пробирки поместите по 4–5 капель раствора ВаС12 , прибавьте по 4–5 капель раствора дихромата калия К2 Сг2 07 и ацетата натрия СН3 СООNa, нагрейте. Рассмотрите выпавший осадок. Проверьте, растворяется ли он при действии минеральных кислот, уксусной кислоты и щелочи. Напишите уравнения реакции.
Реакция на окрашивание пламени. В пламя внесите несколько кристалликов ВаС12 . Зафиксируйте цвет пламени.
Результаты проведенных опытов занесите в таблицу
| Определяемый | Среда | Условия | Реактив | Наблю- | Уравнение |
| ион | реакции | даемое | реакции | ||
| явление |
Лабораторная работа №7.
«Анализ смеси катионов 3 аналитической группы»
Цель работы: научиться выявлять катионы 3 группы из смеси.
Оборудование: анализируемый раствор, 2 м СН3 СООNa, раствор К2 Сг2 07, раствор Nа2 С03, 2М СН3 СООН, раствор СаS04 , раствор (NH4 )2 S04 , (NН4 )2 С2 04 , концентрированный NН3, водяная баня, спиртовка, хим. стаканчики, стеклянные палочки, пробирки, держатель.
При подготовке к лабораторной работе необходимо усвоить материал:
Реакции катионов железа (III) (действие группового реактива – сульфида аммония, щелочей, гексацианоферрата (II) калия, роданида аммония); марганца (действие группового реактива – сульфида аммония, щелочей, реакция окисления марганца висмутатом натрия), хрома (действие группового реактива – сульфида аммония, щелочей, реакция окисления хрома перекисью водорода), цинка (действие группового реактива – сульфида аммония, щелочей, сероводорода), алюминия (действие группового реактива – сульфида аммония, щелочей, гидроксида аммония, хлорида аммония). Систематический ход анализа смеси катионов третьей аналитической группы.
Ход анализа смеси катионов З группы обусловлен следующими факторами:
• ион бария мешает обнаружению катионов стронция и кальция;
• после удаления катионов бария оранжевый цвет центрифугата за счет присутствия ионов Сг2 О7 затрудняет открытие катионов стронция кальция;
• дробный ход анализа при открытии катионов З аналитической группы нецелесообразен.
Систематический анализ. К 15 каплям анализируемого горячего раствора прибавьте 2 м СН3 СООNa (рН 5–6) и по каплям – раствор К2 Сг2 07 до появления оранжевой окраски, смесь перемешайте стеклянной палочкой, нагрейте до кипения и дождитесь его осаждения. Осадок отбросьте, в растворе проверьте полноту осаждения Ва 2+ , прибавляя 1 каплю раствора СН3 СООNа и 1–2 капли раствора К2 Сг2 07.
К раствору прилейте насыщенный раствор Nа2 С03 , до рН =10 и нагревайте 7–10 минут на кипящей водяной бане. Нагревание способствует полноте осаждения Са 2+ и Sг 2+ в виде карбонатов. Карбонаты отделите отстаиванием и раствор отбросьте. Осадок промойте горячей водой до белого цвета осадка на фильтре. Осадок растворите в горячей 2М СН3 СООН, прибавляя ее по каплям. В полученном растворе откройте Sг 2+ , прибавляя к 3–4 каплям его 5–6 капель насыщенного раствора СаS04 и нагревая до кипения. Появление белого осадка или мути после полного охлаждения смеси указывает на присутствие Sг 2+ , если же осадок или муть образуются в момент приливания СаS04 , то возможно, что выпадает из раствора недоосажденный Ва 2+ в виде ВаS04 .
После обнаружения ионов Sг 2+ их нужно отделить от Са 2+ . Для этого к раствору, содержащему Sг 2+ , Са 2+ и избыток СН3 СООН, прибавьте равный объем насыщенного раствора (NH4 )2 S04 , выдержите на кипящей водяной бане 10 минут и центрифугируйте. Осадок SгS04 отбросьте. Раствор, содержащий ионы Са 2+ проанализируйте, для чего его разделите на две части. В одной части проведите обнаружение реакцией с (NН4 )2 С2 04 в присутствии 2 М СН3 СООН. Ко второй части прибавьте 2–3 капли 4 М NН4 С1, концентрированный NН3 (рН > 10), К4 [Fе(СN)6 ] и нагрейте. Образование белых осадков говорит о присутствии ионов Са 2+.
Результаты проведенных опытов занесите в таблицу
| Что делали | Что наблюдали | Вывод (уравнения реакций) |
Практическая работа №8.
«Составление уравнений окислительно-восстановительных реакций».
Цель работы: закрепить умение решать уравнения окислительно – восстановительных реакций.
Оборудование: разработка п\р.
Перед выполнением практической работы необходимо проработать материал:
Сущность окисления-восстановления. Составление уравнений окислительно-восстановительных реакций методом электронного баланса. Амфотерность
Тема 1.4 Четвертая аналитическая группа катионов
Лабораторная работа №9.
«Проведение частных реакций катионов 4 аналитической группы
Цель работы: выявить катионы алюминия, хрома и цинка.
Оборудование: растворы хлоридов алюминия, хрома и цинка, гидроксид натрия, хлорид аммония, раствор нитрата кобальта, сульфат алюминия, раствор Н2 02 , азотная кислота, Сг2 (S04 )3 , 2 М Н2 S04 , КМn04 , раствор К3 [Fе(СN)6 ], раствором нитрата пинка Zn(NO3 )2 , часовое стекло, пробирки, водяная баня, спиртовка, держатель, проволока, пробирки.
Перед выполнением лабораторной работы необходимо усвоить материал:
Общая характеристика катионов четвертой аналитической группы. Значение катионов четвертой аналитической группы в осуществлении химико-технологического контроля.
Групповой и подгрупповой реактивы и условия их применения. Частные реакции катионов четвертой аналитической группы. Реакции катионов серебра (действие группового реактива – сероводорода, соляной кислоты, хромата калия); свинца (действие группового реактива – сероводорода, соляной кислоты, иодида калия); меди (действие группового реактива – сероводорода, гидроксида аммония, реакция окрашивания пламени).
Опыт №1. Реакции иона алюминия
Реакция с гидроксидом. К 2–3 каплям раствора А1С13 прибавьте 2 капли гидроксида натрия. Растворите осадок в избытке щелочи. Прилейте к полученному раствору равный объем насыщенного раствора NН4 С1 и нагрейте реакционную смесь на водяной бане. Что наблюдаете? Напишите уравнения реакций.
Образование тенаровой сини. Возьмите полоску фильтровальной бумаги и смочите ее разбавленным раствором нитрата кобальта Со(N03 )2 и раствором сульфата алюминия А12 (S04 )3 . После подсушивания сожгите полоску. Рассмотрите оставшийся пепел, отметьте цвет. Окраска пепла объясняется образованием алюмината кобальта Со(АIO2 )2 , называемого тенаровой синью. Реакцию следует проводить под тягой.
Опыт №2. Реакции иона хрома.
Реакция с гидроксидом . К 3–4 каплям раствора хлорида хрома СгС13 прибавьте 2 М раствор NаОН до растворения образовавшегося осадка. Обратите внимание на цвет осадка и образовавшегося комплекса. Нагрейте полученный раствор на водяной бане. Что при этом происходит? Напишите уравнения реакций.
Реакция с пероксидом . К 2–3 каплям раствора СгС13 прибавьте 3–4 капли 3‑процентного раствора Н2 02 , затем 4 капли 8 М раствора NаОН. Нагрейте реакционную смесь на водяной бане. Что при этом происходит? Напишите уравнения реакции?
Реакция с перманганатом . Налейте в пробирку по 4–5 капель растворов сульфата хрома Сг2 (S04 )3 , 2 М Н2 S04 и КМn04 . Нагрейте реакционную смесь в течение нескольких минут на водяной бане. Что наблюдаете?
Опыт №3. Реакции иона цинка.
Реакция с гидроксидом. Поместите в пробирку 2–3 капли раствора ZпС12 . Прибавьте каплю раствора щелочи. Напишите уравнение реакции. Растворите осадок в избытке щелочи, затем попытайтесь вновь осадить Zп(ОH)2 прибавлением концентрированного раствора NН4 С1. Если осадок гидроксида цинка не образуется, то объясните, почему.
Реакция с гексацианоферратом ( II ) калия . В две пробирки поместите по 2–3 капли раствора ZпСI2 . Затем прибавьте в первую пробирку 2–3 капли раствора К3 [Fе(СN)6 ]. Рассмотрите выпавший осадок.
Получение ринманоевой зелени. Возьмите полоску фильтровальной бумаги и смочите ее раствором нитрата пинка Zn(NO3 )2 и разбавленным раствором нитрата кобальта Со(NO3 )2 . После подсушивания сожгите полоску. Рассмотрите оставшийся пепел. Окраска пепла объясняется образованием цинката кобальта СоZп02 , который называют ринмановой зеленью (в ходе реакции также выделяется диоксид азота N02 – газ бурого цвета и газообразный кислород). Реакцию следует проводить под тягой.
Результаты проведенных опытов занесите в таблицу
| Определяемый | Среда | Условия | Реактив | Наблю- | Уравнение |
| ион | реакции | даемое | реакции | ||
| явление |
Лабораторная работа №10.
«Анализ смеси катионов 4 аналитической группы»
Цель работы: научиться выявлять катионы 4 группы из смеси.
Оборудование: анализируемый раствор, NаОН, раствора Н2 О2 , кристаллический NН4 С1, 2 М НС1, ализарин, 1 М H2 SO4, К4 [Fe(CN)6 ], азот. кислота, смесь эфира с изоамиловым спиртом,водяная баня, спиртовка, хим. стаканчики, стеклянные палочки, пробирки, держатель.
Перед выполнением лабораторной работы необходимо усвоить материал:
Групповой и подгрупповой реактивы и условия их применения. Частные реакции катионов четвертой аналитической группы. Реакции катионов серебра (действие группового реактива – сероводорода, соляной кислоты, хромата калия); свинца (действие группового реактива – сероводорода, соляной кислоты, иодида калия); меди (действие группового реактива-сероводорода, гидроксида аммония, реакция окрашивания пламени).Систематический ход анализа смеси катионов четвертой аналитической группы.
Ход анализа смеси катионов 4 группы обусловлен следующими факторами:
• в результате действия на катионы 4 группы избытка щелочи в присутствии пероксида водорода все ионы переменной степени окисления находятся в растворе в высшей степени окисления; при этом катионы Сг 3+ превращаются в.анионы СrO4 2-;
• амфотерный гидроксид хрома Сг(ОН)3 не растворяется в избытке щелочи в присутствии ионов Zn 2 – (в ходе реакции образуется цинкат хрома Сг.2 (Zn02 )3 , нерастворимый в избытке осадителя NаОН; для предотвращения этого процесса в раствор добавляют пероксид водорода);
• различная способность алюминат-, хромат- и цинкат-ионов взаимодействовать с солями аммония (осаждение ионов алюминия в виде А1 (ОН)3 );
• предварительный анализ смеси катионов 4 группы можно проводить дробным методом: катион А1 3+ открыть реакцией с ализарином; катион Сг 3+ – окислением до Н2 СrO6 пероксидом водорода; катион Zn 2+ – при помощи дитизона; окончательную проверку наличия тех или иных катионов проводят систематическим ходом анализа (см. схему).
Систематический анализ. К 15 каплям исследуемого раствора прибавьте 20%-ный раствор NаОН до растворения выпавших в осадок гидроксидов, несколько капель 3%-ного раствора Н2 О2 , перемешайте и нагрейте. Если в исследуемом растворе присутствует хром (111), то нагревайте до полного перехода цвета раствора из зеленого в желтый. Избыток Н2 02 удалите кипячением. Раствор теперь содержит комплексные ионы алюминия, цинка и хрома. Для отделения катионов алюминия к раствору небольшими порциями при перемешивании прибавляйте кристаллический NН4 С1 до запаха выделяющегося аммиака. Смесь нагрейте. При наличии в растворе соли алюминия выпадает осадок его гидроксида.
Осадок I отделите осаждением, промойте 2–3 раза холодной водой и растворите в горячей 2 М НС1 (раствор II).
Обнаружение АI 3+ . В растворе II откройте А1 3+ реакцией с ализарином.
Обнаружение Zn 2+ . К отдельной пробе раствора I прибавьте 1 М H2 SO4 до кислой реакции и обнаруживайте ионы Zn 2+ реакцией с К4 [Fe(CN)6 ].
Обнаружение Сг 3+ . Желтый цвет раствора 1 говорит о присутствии в нем Сг04 2- и, следовательно, ионов Сг 3+ в исследуемом растворе. Для подтверждения этого проведите реакцию перевода ионов Сг04 2- в Н2 СгО6 Для этого к раствору прибавьте серную и азотную кислоты и смесь эфира с изоамиловым спиртом, а затем пероксид водорода до появления синего окрашивания, обусловленного образованием пероксидного соединения надхромовой кислоты Н2 Сг06 .
Результаты проведенных опытов занесите в таблицу
| Что делали | Что наблюдали | Вывод (уравнения реакций) |
Тема 1.5. Анионы. Анализ сухой соли
Лабораторная работа №11.
«Проведение частных реакций анионов 1,2,3 аналитической групп»
Цель работы: выявить анионы1,2,3 аналитических групп.
Оборудование: сульфат натрия, хлорид бария, нитрат серебра, карбонат натрия, соляная кислота, фосфат натрия, хлорид натрия, бромид калия, иодид калия, нитрат свинца, сульфид натрия, ацетат натрия, серная кислота, хлорид железа (III), спиртовка, держатель пробирки.
Перед выполнением лабораторной работы необходимо проработать материал:
Классификация анионов. Значение анионов в осуществлении химико-технологического контроля.
Частные реакции анионов первой группы. Реакции сульфат-иона (действие хлорида бария); сульфит-иона (действие хлорида бария, окислителей: растворов иода или перманганата калия); карбонат-иона (действие хлорида бария, кислот).
Частые реакции анионов второй группы. Реакции хлорид-иона (действие нитрата серебра); сульфид-иона (действие нитрата серебра, соляной кислоты).
Частные реакции анионов третьей группы. Реакции нитрат-иона (действие сульфата железа (II) в кислой среде); нитрит-иона (действие перманганата калия в кислой среде).
Опыт №1. Анионы первой аналитической группы
Реакция с хлоридом бария. В три пробирки поместите но 2–3 капли раствора Nа2 S04 и столько же ВаС12 . Рассмотрите выпавшие осадки. Напишите уравнения реакции.
Реакция с нитратом серебра . В четыре пробирки поместите по 3–5 капель раствора Nа2 S04 и столько же капель раствора АI(N03 )3 . Рассмотрите выпавший осадок. Напишите уравнения реакции.
Реакция с хлоридом бария. К 3–4 каплям раствора Nа2 С03 прибавьте несколько капель раствора ВаС12 . Рассмотрите выпавший осадок. Какой состав он имеет? Прилейте к осадку 3–4 капли 2 Л/ НС1. Что при этом происходит? Напишите уравнение реакции.
Реакция с кислотами . Налейте в пробирку 5–6 капель Nа2 СО3. В пипетку наберите известковую воду и опустите на дно пробирки. Быстро прилейте в пробирку 5–6 капель 2 М НС1. Наблюдайте за изменениями, происходящими с известковой водой в пипетке. Объясните это явление. Напишите уравнения реакций.
Реакция с нитратом серебра . Поместите в 2 пробирки но одной кайле раствора Nа2 С03 и по 1 капле нитрата серебра. Рассмотрите выпавший осадок. Напишите уравнения реакций.
Реакция с хлоридом бария. В пробирку внесите 2–3 капли раствора Nа3 РО4 и прибавьте столько же капель раствора ВаС12 Рассмотрите выпавший осадок. Напишите уравнение реакции.
Реакция с нитратом серебра. К одной капле раствора Nа3 РО4 добавьте 1 каплю раствора нитрата серебра. Рассмотрите выпавший осадок. Напишите уравнение реакции.
Опыт №2. Анионы второй аналитической группы
Реакция с нитратом серебра . К 2–3 каплям раствора NaС1 прибавьте равный объем раствора нитрата серебра. Напишите уравнения реакций.
Реакция с нитратом серебра. В пробирку внесите 2–3 капли раствора КВг. Прибавьте 1–2 капли раствора нитрата серебра. Напишите уравнения реакций.
Реакция с нитратом серебра . В пробирку внесите 2–3 капли раствора КI, прибавьте 1–2 капли раствора нитрата серебра. Напишите уравнения реакций.
Реакция с нитратом свинца. В пробирку внесите 2–3 капли раствора К1, прибавьте 1–2 капли раствора нитрата свинца. Напишите уравнение реакции.
Реакция с нитратом серебра. В пробирку внесите 2–3 капли раствора Nа2 S, прибавьте 1–2 капли нитрата серебра. Отметьте цвет осадка. Напишите уравнения реакций.
Опыт №3. Анионы третьей аналитической группы.
Реакция с кислотами. К 6–7 каплям раствора СН3 СООNа добавьте 3 капли концентрированной Н2 S04 и осторожно нагрейте реакционную смесь. Обратите внимание на запах выделяющихся паров из пробирки. Что выделяется? Объясните явление.
Реакция с хлоридом железа ( III ). В пробирку поместите 5–6 капель раствора FеС13 , прибавьте столько же капель раствора СН3 СООNа, разбавьте смесь 1–2 мл воды и нагрейте до кипения. Наблюдайте за изменениями, происходящими в пробирке. Отметьте цвет осадка.
Результаты проведенных опытов занесите в таблицу
| Определяемый | Среда | Условия | Реактив | Наблю- | Уравнение |
| ион | реакции | даемое | реакции | ||
| явление |
Лабораторная работа №12.
«Анализ сухой соли»
Цель работы: научиться определять состав сухой соли.
Оборудование: анализируемый образец, Na2 В4 07 , гидрофосфатом натрия-аммония, серная кислота, вода, уксусная кислота, 2 М растворы соляной, азотной, концентрированная НС1, концентрированная азотная кислота, царская водка, 30% раствор щелочи, 25% раствор аммиака, иодид калия, перманганат калия, стеклообразная бусинка, спиртовка, держатель пробирки.
Перед выполнением лабораторной работы необходимо проработать материал:
Частные реакции анионов первой группы. Реакции сульфат-иона (действие хлорида бария); сульфит-иона (действие хлорида бария, окислителей: растворов иода или перманганата калия); карбонат-иона (действие хлорида бария, кислот).
Частые реакции анионов второй группы. Реакции хлорид-иона (действие нитрата серебра); сульфид-иона (действие нитрата серебра, соляной кислоты).
Частные реакции анионов третьей группы. Реакции нитрат-иона (действие сульфата железа (II) в кислой среде); нитрит-иона (действие перманганата калия в кислой среде).
Систематический ход анализа соли.
Установление состава твердого вещества осуществляется в два этапа.
Анализ анионов имеет свои особенности. В отличие от катионов, анионы обычно не мешают обнаружению друг друга. Поэтому многие из них обнаруживают дробным методом в порциях исследуемого раствора. К систематическому ходу анализа прибегают лишь в наиболее сложных случаях, например, при наличии в растворе анионов-восстановителей или окислителей.
Если в ходе анализа смеси катионов групповые реагенты служат для последовательного отделения групп, то при анализе смеси анионов они используются лишь для предварительного обнаружения той или иной группы. Это значительно облегчает работу, т. к. отсутствие хотя бы одной из групп позволяет не производить реакций на относящиеся к ней анионы.
Ход анализа смеси анионов 1–3 аналитических групп
(без ионов-восстановителей SO3 2- , S2 O3 2- , S 2- и NO2 — ).
Опыт 1. Кислая реакция анализируемого раствора указывает на отсутствие в нем анионов летучих и неустойчивых кислот, например, CO3 2- и некоторых других.
Опыт 2. Проба на анионы I группы и обнаружение иона SO 4 2- .
Если раствор кислый, нейтрализуют его раствором Ba(OH)2 .
Ионы Ba 2+ образуют с сульфат-ионами белый осадок сульфата бария, нерастворимый в кислотах. Этим сульфат бария отличается от солей бария других анионов.
Выполнение: к 2–3 каплям нейтрального или слабощелочного раствора прибавляют 3–4 капли группового реагента BaCl2 . Выпадение осадка указывает на присутствие анионов 1‑й группы. К осадку прибавляют 3–4 капли 2 н соляной кислоты. Нерастворимость его в 2 н хлороводородной кислоте – признак присутствия иона SO4 2- .
Отличить сульфат бария от других солей можно также по его способности к образованию смешанных кристаллов с KMnO4 , имеющих розовый цвет.
Выполнение: к 2–3 каплям исследуемого раствора прибавляют 2 капли 2 н раствора соляной кислоты, 5 капель 0,01 н раствора KMnO4 и затем раствор BaCl2 . Образуется осадок. Далее прибавляют раствор H2 O2 для восстановления избытка KMnO4 , при этом раствор бесцвечивается, а осадок окрашивается в розовый цвет.
Опыт 3. Проба на анионы 2‑й группы и их обнаружение.
Выполнение: к 2–3 каплям исходного раствора добавляют 3–4 капли раствора AgNO3 – реагента на 2‑ю группу. Образование осадка и его нерастворимость в 2 н азотной кислоте подтверждает присутствие анионов второй аналитической группы.
Если анионы 2‑й группы присутствуют, то добиваются полного осаждения их раствором нитрата серебра, осадок отделяют центрифугированием и промывают. Используют его для обнаружения ионов Cl — , Br — , I — .
a) Растворение хлорида серебра и обнаружение иона Cl — .
Выполнение: прибавляют к осадку 20–30 капель раствора карбоната аммония с массовой долей (NH4 )2 CO3 12% и взбалтывают в течение 1 мин. При этом хлорид серебра растворяется с образованием [Ag(NH3 )2 ] Cl, но только частично; бромид и иодид серебра остаются в осадке. Отделяют центрифугированием осадок, центрифугат делят на две порции. К одной из них прибавляют несколько капель азотной кислоты (появление мути AgCl указывает на присутствие хлорид-иона). К другой порции центрифугата прибавляют несколько капель раствора бромида калия. Интенсивное помутнение раствора из-за выделения бромида серебра также указывает на присутствие хлорид-иона.
Отцентрифугированный осадок промывают и исследуют, как описано ниже.
Переведение ионов Cl — , Br — , I — в раствор, обнаружение Br — и I — .
Выполнение: к осадку добавляют 5–6 капель воды и немного цинковой пыли. Тщательно перемешивают содержимое пробирки палочкой в течение 1 мин. Осадок (т.е. свободное серебро и избыток цинка) отделяют центрифугированием и отбрасывают.
2–3 капли полученного центрифугата подкисляют 2 н серной кислотой и обнаруживают ионы I — и Br – действием хлорной воды в присутствии бензола (или бензидина). Ион Br – можно обнаружить также реакцией с фуксинсернистой кислотой, а ион I — – реакцией с нитритом натрия в присутствии крахмала.
Реакция на Br — с фуксинсернистой кислотой.
Пары брома дают с фуксинсернистой кислотой сине-фиолетовое окрашивание. Реакция позволяет обнаруживать ион Br — в присутствии ионов Cl — и I — , которые не окрашивают реактив.
Выполнение: к 2–3 каплям испытуемого раствора на часовом стекле прибавляют 4–5 капель хромовой кислоты с массовой долей H2 CrO4 25% для окисления ионов Br – до свободного брома.
На внутреннюю поверхность другого часового стекла прикрепляют фильтровальную бумагу, пропитанную фуксинсернистой кислотой (т.е. раствором фуксина, обесцвеченным гидросульфитом натрия NaHSO3 в присутствии HCl). Накрывают первое стекло вторым и в течение 10 мин нагревают газовую камеру на водяной бане. Бумага окрасится в сине-фиолетовый цвет.
Реакция на I — с нитритом натрия в присутствии крахмала:
Выделившийся йод обнаруживают по посинению крахмала.
Выполнение: к 1–2 каплям исследуемого раствора добавляют столько же раствора нитрита натрия NaNO2 , подкисляют 2 н серной кислотой и добавляют 1–2 капли крахмального раствора. Синяя окраска адсорбционного соединения йода с крахмалом при нагревании исчезает, при охлаждении снова появляется.
Выполнение: 5–6 капель исследуемого раствора помещают в склянку прибора для обнаружения газов и приливают 6–8 капель 2 н HCl. Помутнение известковой воды указывает на присутствие иона CO3 2- .
Выполнение: к 2 каплям анализируемого раствора прибавляют избыток молибденовой жидкости, нагревают на горячей бане; при необходимости добавляют несколько кристаллов нитрата аммония и дают постоять. В присутствии иона PO4 3 – выпадает желтый осадок (NH4 )3 H4 [P(Mo2 O7 )6 ].
Выполнение: к 3–4 каплям исследуемого раствора прибавляют 2 капли 2 н раствора NH4 OH, 3 капли насыщенного раствора хлорида аммония и в течение 2–3 мин нагревают на водяной бане. В присутствии аниона SiO3 2 – выпадает белый студенистый осадок кремниевых кислот.
Выполнение: на чистое и сухое часовое стекло (капельную пластинку) помещают 3–4 капли раствора дифениламина в концентрированной серной кислоте, вносят в него стеклянной палочкой немного исследуемого раствора и перемешивают. В присутствии NO3 – появится интенсивно-синяя окраска.
Опыт 8. Обнаружение иона ВО 2- .
Выполнение: отбирают в тигель или фарфоровую чашку 5–6 капель анализируемого раствора, выпаривают досуха, дают остыть, приливают к сухому остатку 2–3 капли концентрированной серной кислоты и немного этанола Смесь поджигают. В присутствии иона BO2 – пламя имеет зеленый цвет.
Результаты проведенных опытов занесите в таблицу
| Что делали | Что наблюдали | Вывод (уравнения реакций) |
Раздел II . Количественный анализ
Тема 2.1 Методы количественного анализа
«Вычисление в количественном анализе»
Концентрацией раствора называется содержание растворенного вещества в определенной массе или известном объеме раствора или растворителя.
Пример 1. Вычислите: а) массовую долю (ω, %); б) молярную (С, моль/дм 3 ), в) молярную концентрацию эквивалента (С (1/z, А)); г) моляльную (Сm ) концентрации раствора Н3 РО4 , полученного при растворении 18 г. кислоты в 282 см 3 воды, если плотность его 1,031 г./см 3 . Чему равен титр (Т, г/см 3 ) этого раствора?
(А)) показываетwа) Массовая доля растворенного вещества А (число грамм (единиц массы) вещества, содержащееся в 100 г. (единиц массы) раствора.

или
где m(A) – масса растворенного вещества, г; mр-ля – масса растворителя, г; mр-ра масса раствора, г; Vр-ра – объем раствора, см3 ; ρр-ра – плотность раствора, г/см 3 .
Так как массу воды 282 см 3 можно принять равной 282 г. (т. к. плотность воды равна 1г/см 3 ), то масса полученного раствора 18 + 282 = 300 г. и, следовательно,
б) молярная концентрация, или молярность, показывает число молей (υ) растворенного вещества, содержащих в 1 л раствора:
в) молярная концентрация эквивалента (С (1/z, А)), или нормальность, показывает число моль эквивалентов растворенного вещества А, содержащихся в 1 дм 3 раствора:
или С (1/z, А)=С(А) · z, где z – эквивалент. Так как z = 3, тогда М (1/3, Н3 РО4 ) = М/3 = 97,99/3 = 32,66 г./моль,
г) моляльная концентрация, или моляльность, показывает число молей растворенного вещества А, содержащихся в 1 кг растворителя:
где mрастворителя = mр-ра – m(А), отсюда
д) титром раствора называется число граммов растворенного вещества А в 1 см 3 (мл) раствора:


Тема 2.2 Гравиметрический (весовой) метод анализа
Лабораторная работа №13.
«Определение кристаллизационной воды в кристаллогидратах»
Цель работы: научиться определять кристаллизационную воду в кристаллогидратах.
Оборудование: порошок голубого сульфата меди (II), бюкс, весы аналитические, сушильный шкаф, спиртовка, металлическая сетка.
Перед выполнением лабораторной работы необходимо проработать материал:
Аналитические и технохимические весы и правила взвешивания на них. Операции весового анализа: подготовка вещества к анализу, взятие
и растворение навески, высушивание и прокаливание осадка. Посуда и оборудование весового метода анализа.
Основные операции в гравиметрическом анализе
Взятие навески аналитической пробы.
Необходимое количество растворимого вещества отвешиваем на аналитических весах с точностью до четырех десятичных знаков.
После взятия навески приступаем к её растворению в растворителе.
Количество растворителя должно соответствовать концентрации раствора определяемого компонента. Навеску растворяют при слабом нагревании, не доводя до кипения во избежание разбрызгивания. Хорошо растворимое вещество растворяем без нагревания, на холоду.
Берем осадитель, образующий наименее растворимый осадок. Для этого берем избыток осадителя (в 1,5–2 раза больше, чем необходимо).
Выдерживаем раствор с осадком при повышенной температуре. Когда раствор над осадком становится прозрачным, проводим пробу на полноту осаждения. Для этого, к раствору, осторожно по стенке, добавляем осадитель, если в растворе не образуется мути, значит осаждение полное. Если снова произошла реакция, то проводим повторное осаждение.
Фильтрование и промывание.
Отделяем осадок от сопутствующих веществ. Сливаем раствор на приготовленный фильтр по стеклянной палочке.
Перевод осадка в гравиметрическую форму.
Фильтр с осадком подсушивают. Осадок осторожно снимают, или сжигают фильтр, отделяя осадок от золы.
Взвешивают получившийся осадок.
Опыт №1. Определение содержания кристаллизационной воды в кристаллогидрате (сульфате меди ( II )).
Взвешиваем пустой бюкс, в него добавляем несколько грамм голубого сульфата меди (II). Снова взвешиваем бюкс с порошком (результаты взвешивания фиксируем до четвертого знака после запятой).
Сушку навески можно проводить с помощью сушильного шкафа или методом прокаливания.
1. Помещаем навеску в сушильный шкаф (при t=80–90 0 С) на 1 час. Взвешиваем. Затем помещаем навеску в сушильный шкаф на 10–20 минут и взвешиваем. Данную операцию проводим до тех пор, пока масса навески не перестанет изменяться больше, чем на 0,00052г.
2. Помещаем навеску в бюксе на металлическую решетку, а снизу ставим спиртовку. Прокаливаем навеску до того, пока порошок не станет бесцветным. Его взвешиваем. Затем снова прокаливаем и взвешиваем до тех пор, пока масса навески не перестанет изменяться больше, чем на 0,00052г.
массу воды m (воды) = m(навески до высушивания) – m (после высушивания)
% потери = m (воды) / m(навески до высушивания) *100%
Данные опыта занесите в таблицу:
| m (навески до высушивания) | m (после 1 высушивания) | m (после 2 высушивания) | m (после 3 высушивания) | m (после высушивания) | m (воды) | % потери | вывод |
Практическая работа №14.
«Вычисление в весовом анализе»
Цель работы: научиться проводить вычисления в весовом анализе.
Оборудование: разработка п\р.
Перед выполнением лабораторной работы необходимо проработать материал:
Вычисления в весовом анализе.
Тема 2.3 Объемный метод анализа. Метод нейтрализации. Теория индикаторов
Лабораторная работа №15.
«Приготовление рабочего раствора щелочи и стандартного раствора щавелевой кислоты»
Цель работы : научиться готовить рабочий раствор щелочи и стандартный раствор щавелевой кислоты.
Оборудование: Реактивы. Гидроксид натрия NаОН(к). Щавелевая кислота Н2 С2 04 • 2Н2 0 (к). Хлороводородная кислота НС1, 0,1М раствор, фенолфталеин – спиртовой 0,1%-й раствор. Метиловый оранжевый, 0,1%-й раствор.
Посуда. Колбы мерные (100, 250 мл). Пипетка (20 мл). Бюретка (25 мл). Колба коническая (250–300 мл). Цилиндр мерный (100 мл.) Весовой стаканчик. Воронка.
Перед выполнением лабораторной работы необходимо проработать материал:
Сущность и методы объемного анализа. Способы выражения концентрации растворов (нормальная концентрация, титр, титр по определяемому веществу) и вычисления в объемном анализе.
Стандартизация раствора NaOH основана на титровании точной навески щавелевой кислоты Н2 С2 04 • 2Н2 0 или аликвоты стандартного раствора щавелевой кислоты раствором гидроксида натрия в присутствии фенолфталеина. Точная концентрация раствора гидроксида натрия может быть установлена также по титрованному раствору хлороводородной кислоты. Стандартный раствор гидроксида натрия готовят разбавлением концентрированного бескарбонатного раствора щелочи.
Выполнение работы. Препарат гидроксида натрия, хранящийся на воздухе, всегда содержит некоторое количество воды и карбоната натрия. Чтобы использовать раствор NaOH в качестве титранта, необходимо предварительно удалить карбонат.
С этой целью готовят почти насыщенный раствор гидроксида натрия. Карбонат натрия вследствие малой растворимости в концентрированном растворе NаОН выпадает в осадок. После отстаивания раствора чистый слой жидкости над осадком тщательно декантируют и разбавляют дистиллированной водой, не содержащей С02 , до необходимой концентрации.
По другому методу карбонат-ионы из раствора NаОН осаждают в виде ВаС03 , добавляя к раствору щелочи раствор хлорида бария.
Раствор гидроксида натрия, не содержащий карбоната, можно приготовить растворением в воде очищенного металлического натрия. Однако этот способ небезопасен из-за возможности возгорания и взрыва.
Бескарбонатный раствор гидроксида натрия можно приготовить также растворением его в небольшом объеме безводного этилового спирта. После отделения осадка карбоната натрия, нерастворимого в спирте, раствор NаОН разбавляют необходимым объемом воды, свободной от С02 .
Во избежание образования карбоната при хранении растворы гидроксида натрия защищают от атмосферного углекислого газа. Сосуды снабжают специальными поглотительными трубками с натронной известью (аскаритом).
Одним из указанных способов готовят 250 мл 0,1М раствора гидроксида натрия.
Опыт №1. Приготовление рабочего раствора щелочи
Стандартизация раствора щелочи по титрованному раствору хлороводородной кислоты. Предварительно вымытую бюретку ополаскивают 2–3 раза малыми порциями (3–5 мл) приготовленного раствора NаОН. Заполняют бюретку раствором щелочи и закрывают ее пробкой, снабженной трубкой с натронной известью.
Отбирают аликвоту (20 мл) стандартного раствора хлороводородной кислоты в коническую колбу для титрования вместимостью 250–300 мл и приливают 1–2 капли метилового оранжевого. Титруют раствором щелочи сначала быстро, а под конец – по каплям до перехода розовой окраски в желтую. При титровании с метиловым оранжевым удобно пользоваться свидетелем. Для его приготовления в коническую колбу для титрования вносят с помощью мерного цилиндра 40 мл дистиллированной воды, 1 каплю метилового оранжевого и 1–2 капли 0,1М раствора хлороводородной кислоты.
Молярную концентрацию раствора щелочи рассчитывают по формуле
С(NaОН) = с(НС1) К(НС1)/К(NаОН),
где К(НС1) – объем пипетки, которой дозировалась хлороводородная кислота; К(NаОН) – объем щелочи, израсходованный на титрование кислоты.
Если значения молярной концентрации NаОН по результатам трех титрований различаются не больше чем на 0,2–0,3%, берут в качестве наиболее вероятного значения среднее арифметическое. При больших расхождениях проводят повторное титрование.
Опыт 2 . Приготовление стандартного раствора щавелевой кислоты
Для приготовления 100 см 3 0,1 н. раствора H2 C2 O4 рассчитывают навеску по формуле
Молярная масса эквивалента H2 C2 O4 • 2H2 O в рассматриваемой реакции равна 63 г./моль.
Рассчитанную навеску H2 C2 O4 *2H2 O взвешивают на аналитических весах, переносят в мерную колбу вместимостью 100 см 3 и растворяют при перемешивании в дистиллированной воде, доводя объем до метки. 0,1 н. раствор щавелевой кислоты можно приготовить из фиксанала.
Результаты опыта занесите в таблицу:
| Что делали | Что наблюдали | Расчеты | Вывод (уравнения реакций) |
Лабораторная работа №16.
«Определение нормальности и титра раствора щелочи»
Цель работы: научиться определять нормальность и титр раствора щелочи.
Оборудование: Реактивы. Хлороводородная кислота НС1, 0,1М раствор. Фенолфталеин, спиртовой 0,1%-й раствор. Метиловый оранжевый, 0,1°/.-и раствор.
Посуда. Колба мерная (100 мл). Пипетка (20 мл). Бюретка (25 мл). Колба коническая (250–300 мл). Стаканчик весовой (бюкс).
Перед выполнением работы необходимо проработать материал:
Титрование, титрованные растворы. Измерительная посуда объемного анализа и ее назначение.
Сущность метода нейтрализации, его индикаторы; интервал перехода индикатора, показатель титрования; выбор индикатора, кривые титрования. Способы приготовления стандартных растворов.
Определение основано на титровании смеси NаОН и Nа2 С03 стандартным раствором хлороводородной кислоты с двумя индикаторами – фенолфталеином и метиловым оранжевым, применяемыми последовательно.
При титровании раствора, содержащего эти вещества, хлороводородной кислотой в присутствии фенолфталеина происходят реакции
NaОН + НС1 = NаС1 + Н2 0
Обесцвечивание фенолфталеина указывает на то, что обе реакции полностью завершились, и вместо исходных веществ в растворе имеются NаС1 и NаНС03 . Бесцветный раствор, содержащий NаНС03 , имеет слабощелочную реакцию, при добавлении метилового оранжевого, он окрашивается в желтый цвет, и, если продолжить титрование кислотой, будет происходить реакция NаНС03 + НС1 = NаС1 + Н2 С03
Изменение желтой окраски на оранжевую свидетельствует о том, что реакция полностью закончилась.
Разность объемов хлороводородной кислоты потраченных на титрование смеси с метиловым оранжевым и фенолфталеином, соответствует половине количества карбоната натрия, присутствующего в растворе. Удваивая эту разность, поручают объем кислоты, эквивалентный количеству всего карбоната. Вычитая указанную разность из объема, израсходованного на титрование смеси NаОН и NаС03 с фенолфталеином, находят объем кислоты, эквивалентный количеству гидроксида натрия.
Выполнение работы. Анализируемый раствор в мерной колбе вместимостью 100 мл разбавляют до метки свежи – прокипяченной и охлажденной под краном дистиллированной водой. Пипетку вместимостью 20 мл 2–3 раза ополаскивают этим раствором, после чего дозируют аликвоту в коническую колбу вместимостью 250–300 мл, добавляют 5–8 капель 0,1%-го раствора фенолфталеина и быстро титруют кислотой, чтобы избежать заметного поглощения углекислого газа из воздуха. До 12–15 мл титрование проводят быстро, перемешивая раствор, а под конец титрант добавляют по каплям до обесцвечивания. Записывают отсчет по бюретке, прибавляют в колбу 1–2 капли метилового оранжевого и продолжают титрование до перехода окраски из желтой в оранжевую. Производят второй отсчет по бюретке.
Массу каждого из компонентов анализируемой смеси рассчитывают по формулам
Результаты опыта занесите в таблицу:
| Что делали | Что наблюдали | Расчеты | Вывод (уравнения реакций) |
Лабораторная работа №17.
«Определение содержания серной кислоты в растворе»
Цель работы: научиться определять содержание серной кислоты в растворе.
Оборудование: Реактивы. Этилендиаминтетраацетат натрия (ЭДТА), 0,01М раствор. Хлорид бария ВаС12 , раствор, содержащий хлорид магния (растворяют 0,5 г ВаС12 * 2Н2 0 и 0,1 г МgС12 *6Н2 0 в 250 мл воды). Аммиачный буферный раствор. Хлороводородная кислота НС1 (конц). Эриохром черный Т или смесь индикаторная – эриохром черный Т и N301 в соотношении 1: 100 (по массе). Бумага индикаторная, лакмусовая.
Посуда. Колбы мерные (100 и 250 мл). Пипетка (20 мл). Бюретки (25 мл). Колба коническая (250–300 мл). Цилиндр мерный (100 мл).
Перед выполнением работы необходимо проработать материал:
Титрование, титрованные растворы. Измерительная посуда объемного анализа и ее назначение.
Сущность метода нейтрализации, его индикаторы; интервал перехода индикатора, показатель титрования; выбор индикатора, кривые титрования. Способы приготовления стандартных растворов.
Определение основано на том, что сульфат-ионы осаждают раствором хлорида бария, взятым в избытке; остаток непрореагировавшего хлорида бария оттитровывают стандартным раствором ЭДТА в присутствии эриохрома черного Т. Четкий переход окраски происходит только при наличии в растворе ионов магния. С этой целью в осадитель сульфат-ионов (хлорид бария) вводится соль магния.
Опыт №1. Анализируемый раствор доводят до метки дистиллированной водой в колбе вместимостью 100 мл. В колбу для титрования отбирают пипеткой 20 мл анализируемого раствора, добавляют 80 мл воды и 3 капли хлороводородной кислоты (плотностью 1,17 г./см 3 ). Нагревают раствор до кипения, кипятят 2–3 мин для удаления диоксида углерода, добавляют пипеткой 20 мл раствора хлорида бария и перемешивают. Раствор охлаждают. Добавляют цилиндром 10 мл аммиачного буферного раствора и на кончике шпателя индикатор для получения интенсивной красно-фиолетовой окраски раствора. Титруют из бюретки раствором ЭДТА до перехода окраски из красно-фиолетовой в чисто синюю (Ух ).
Опыт №2 . Для проведения опыта в коническую колбу вносят 100 мл дистиллированной воды, 3 капли хлороводородной кисло ты (плотностью 1,17 г./см 3 ). Нагревают раствор до кипения, кипятят 2–3 мин, добавляют той же пипеткой 20 мл раствора хлорида бария и перемешивают. Раствор охлаждают. Добавляют 10 мл аммиачного буферного раствора и на кончике шпателя индикатора. Оттитровывают раствор ЭДТА до перехода окраски из красно-фиолетовой в чисто синюю. Определяют объем У2 .
Разность объемов ЭДТА (У2 – Ух ) эквивалентна содержанию сульфат-ионов во взятой пробе.
Массу сульфат-ионов в пересчете на S03 рассчитывают по формуле:
Результаты опыта занесите в таблицу:
| Что делали | Что наблюдали | Расчеты | Вывод (уравнения реакций) |
Тема 2.4 Метод окисления – восстановления
Лабораторная работа №18.
«Приготовление рабочего раствора перманганата калия и установление нормальной концентрации и титра по щавелевой кислоте»
Цель работы: научиться готовить стандартный раствор перманганата калия и определять его концентрацию и титр (по щавелевой кислоте) в растворе.
Оборудование: раствор щавелевой кислоты, 2Н серная кислота, КМnO4, пробирки, хим. стаканы, спиртовка, оборудование для титрования, весы аналитические.
Перед выполнением работы необходимо проработать материал:
Сущность окислительно-восстановительных методов и их значение в проведении химико-технологического контроля Эквиваленты окислителей и восстановителей, их определение и использование в расчетных задачах.
Перманганатометрия и ее сущность.
Опыт №1. Приготовление рабочего раствора перманганата калия
Опыт №2. Стандартизация раствора перманганата калия по щавелевой кислоте
Хорошо вымытую бюретку с краном промойте раствором перманганата калия и подготовьте к титрованию.
Ополосните пипетки раствором щавелевой кислоты и перенесите 10,00 мл его к коническую колбу. Прибавьте 8–10 мл 2Н серной кислоты, нагрейте до 70–80 (но не доводите до кипения). При этом щавелевая кислота разлагается, раствор титруйте перманганатом калия. Раствор перманганата калия приливайте медленно, по каплям, при непрерывном взбалтывании жидкости. Каждую последующую каплю добавляйте лишь после того, как обесцветилась предыдущая. В начале обесцвечивание будет проходить медленно, но затем, по мере образования сульфата марганца, играющего роль катализатора – ускоряется. Титрование прекратите, когда р-р будет бледно розовым и не исчезнет окраска в течение 1–2 минут.
Титрование повторите 2–3 раза и вычислите концентрацию и титр перманганата калия.
С(КМnO4 )= V (щав. кисл.)* С (щав. кисл)/ V(КМnO4 )
Результаты опыта занесите в таблицу:
| Что делали | Что наблюдали | Расчеты | Вывод (уравнения реакций) |
Лабораторная работа №19.
«Определение содержания железа в соли Мора»
Цель работы: научиться определять концентрацию железа (в соли Мора) в растворе.
Оборудование: раствор соли Мора, 2Н серная кислота, КМnO4, пробирки, хим. стаканы, спиртовка, оборудование для титрования, весы аналитические.
Перед выполнением работы необходимо проработать материал:
Сущность окислительно-восстановительных методов и их значение в проведении химико-технологического контроля Эквиваленты окислителей и восстановителей, их определение и использование в расчетных задачах.
Иодометрия и ее сущность.
В мерную колбу возьмем немного раствора соли Мора, доведем её объем до метки 100 мл дистиллированной водой и перемешайте.
Ополосните полученным раствором пипетку, и перенесите 10 мл этого раствра в коническую колбу, подкислите его 8–10 мл 2Н раствором серной кислоты и на холоде (т. к. при нагревании Fe +2 окисляется до Fe +3 ) титруйте раствором перманганата калия до появления неисчезающей слабо-розовой окраски раствора.
Титрование повторите 2–3 раза.
Вычислите кол-во железа, содержащегося в соли Мора по формулам:
С (соли Мора)= V(средний объем перманганата* С (перманганата калия)/V (соли калия пошедшего на титрование) Мора)
м (Fe)= С (соли Мора)* М эквивалента соли Мора * V (соли Мора, в литрах)
Результаты опыта занесите в таблицу:
| Что делали | Что наблюдали | Расчеты | Вывод (уравнения реакций) |
Практическая работа №20.
«Выполнение расчетов эквивалентов окислителя и восстановителя»
Цель работы: научиться вычислять эквиваленты окислителей и восстановителей.
Оборудование: разработка п\р.
Перед выполнением работы необходимо проработать материал:
Эквиваленты окислителей и восстановителей, их определение и использование в расчетных задачах.
Тема 2.5 Методы осаждения и комплексонообразования
Лабораторная работа №21.
«Приготовление рабочего раствора нитрата серебра и установление нормальной концентрации».
Цель работы: научиться готовить рабочий раствор нитрата серебра и определять его нормальную в растворе.
Оборудование: Реактивы. Нитрат серебра АgN03 (к). Хромат калия К2 Сг04 , 5%-й раствор. Посуда. Колбы мерные (100, 500 мл). Пипетка (20 мл). Пипетка дифференциальная (5 мл). Бюретка (25 мл). Колба коническая (250 – 300 мл). Стаканчик весовой (бюкс). Воронка стеклянная.
Перед выполнением лабораторной работы необходимо проработать материал:
Сущность методов осаждения. Аргентометрия (метод Мора), условия применения метода и его значение в проведении химико-технологического контроля.
Сущность метода комплексонообразования и его значение в осуществлении химико-технологического контроля.
Раствор нитрата серебра готовят по навеске препарата АgN03 . Стандартизация раствора АgNO3 основана на титровании аликвоты стандартного раствора хлорида натрия раствором нитрата серебра. В качестве индикатора применяется хромат калия.
Выполнение работы. Рассчитывают массу навески АgNO3 , необходимую для приготовления 500 мл 0,01М раствора нитрата серебра.
Навеску препарата АgN03 взвешивают на технических весах и количественно переносят в мерную колбу вместимостью 500 мл, растворяют и доводят до метки дистиллированной водой. Так как концентрация раствора АgN03 изменяется при хранении, ее периодически проверяют по «х.ч.» NаС1 методом отдельных навесок или методом пипетирования.
Готовят 0,01М раствор хлорида натрия (первичный стандарт) путем растворения навески хлорида натрия в мерной колбе вместимостью 100 мл. Аликвоту полученного раствора NaCl пипеткой на 20 мл переносят в колбу для титрования, прибавляют 1 мл 5% – го раствора К2 Сг04 и титруют рабочим раствором АgN03 , при энергичном перемешивании раствора с осадком.
Титрование заканчивают, когда чисто желтый цвет жидкости со взмученным в ней осадком приобретает грязноватый красно-бурый оттенок.
Содержимое колбы после окончания титрования сливают в специально предназначенный для этого сосуд.
Результаты опыта занесите в таблицу:
| Что делали | Что наблюдали | Расчеты | Вывод (уравнения реакций) |
Лабораторная работа №22.
«Определение содержания хлорида натрия в растворе»
Цель работы: научиться определять концентрацию хлорида натрия в растворе.
Оборудование: Приборы и реактивы. Мерная колба вместимостью 50 мл. Бюретка вместимостью 10 мл. Пипетка вместимостью 5 мл. Растворы: нитрата серебра (0,1 в., титрованный); хлорида натрия (0,5 н., титрованный); хромата калия (насыщенный).
Перед выполнением лабораторной работы необходимо проработать материал:
Сущность методов осаждения. Аргентометрия (метод Мора), условия применения метода и его значение в проведении химико-технологического контроля.
Сущность метода комплексонообразования и его значение в осуществлении химико-технологического контроля.
Концентрацию растворов некоторых солей можно определить, используя реакции обмена, протекающие с образованием осадков малорастворимых веществ в процессе титрования. Например, для количественного определения хлоридов (или бромидов) металлов можно применить реакцию образования осадка галогенида серебра.
Раствор галогенида титруют раствором нитрата серебра, концентрация которого известна. Для определения конца реакции к раствору галогенида добавляют в качестве индикатора каплю насыщенного раствора хромата калия К2 Сг04 . Хромат калия с нитратом серебра дает малорастворимую соль Аg2 Сг04 темно-красного цвета. Но растворимость хромата серебра значительно больше, чем хлорида серебра. Поэтому хромат серебра начинает выпадать в осадок только после практически полного осаждения ионов хлора. Внешне это проявляется в начинающемся побурении ранее белого осадка, что и служит признаком конца реакции между хлоридом натрия и нитратом серебра.
Выполнение работы. В мерную колбочку вместимостью 50 мл поместите некоторое количество раствора хлорида натрия. Довести объем раствора хлорида натрия до метки, прибавляя к нему из промывалки дистиллированную воду. Воду прибавлять отдельными порциями, каждый раз перемешивая раствор круговыми движениями колбы. Последние капли воды добавлять пипеткой до тех пор, пока нижний уровень мениска жидкости не совпадет с меткой на шейке колбы. После этого плотно закрыть колбу пробкой и хорошо перемешать раствор, перевертывая колбу.
Бюретку вместимостью 10 мл промыть небольшим объемом титрованного 0,1 н. раствора нитрата серебра. Укрепить бюретку в штативе и через воронку налить в нее тот же раствор нитрата серебра несколько выше нулевого деления. (Кончик бюретки также должен быть заполнен.) Выпуская избыток раствора через нижний конец бюретки, довести уровень жидкости в бюретке до нуля.
В коническую колбочку емкостью 50 мл сухой пипеткой внести 5 мл приготовленного раствора хлорида натрия и налить из промывалки приблизительно такой же объем воды. Туда же добавить одну каплю насыщенного раствора индикатора – хромата калия. Провести ориентировочное титрование. Для этого в колбочку с раствором хлорида натрия добавлять из бюретки небольшими порциями (по 0,5 мл) раствор нитрата серебра. Раствор при этом нужно все время перемешивать круговыми движениями колбочки. Необходимо уловить момент, когда чисто-желтый цвет жидкости с осадком перейдет в буроватый. В этот момент нужно прекратить титрование и определить объем израсходованного раствора нитрата серебра.
Повторить титрование еще три раза, но более точно, добавляя последние порции раствора нитрата серебра по каплям. Перед каждым титрованием колбочку для раствора хлорида натрия необходимо тщательно вымыть и сполоснуть дистиллированной водой, а уровень раствора нитрата серебра довести до нуля.
Выразите массу нитрата серебра из формулы в предыдущей 21 лабораторной работе.
Результаты опыта занесите в таблицу:
| Что делали | Что наблюдали | Расчеты | Вывод (уравнения реакций) |
Тема 2.6 Физико-химические методы анализа
1. При электролизе водного раствора нитрата серебра в течение 50 мин при токе силой 3А на катоде выделилось серебро массой 9,6 г. Определите выход по току (т, %).
2. При электролизе водного раствора нитрата никеля(II) (ш = 50%) массой 113,30 г. на катоде выделился металл массой 14,75 г. Определите объем газа (н.у.), выделившегося на аноде и массу оставшегося нитрата никеля(II) после электролиза.
3. После электролиза водного раствора хлорида натрия получили раствор, в котором содержится NaOH массой 20 г. Газ, выделившийся на аноде, полностью прореагировал с раствором иодида калия массой 332 г. Определите содержание иодида калия (w, %) в растворе.
4. При электролизе водного раствора хлорида калия на катоде выделился водород объемом 13,44 дм 3 (н.у.). Газ, выделившийся на аноде, полностью окислил раскаленную медную проволоку массой 38,4 г. Определите мольную массу меди.
5. Электролиз водного раствора сульфата калия проводили при токе силой 5 А в течение 3 ч.
Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде?
6. При электролизе водных растворов сульфата магния и хлорида меди(II), соединенных последовательно с источником тока, на одном из катодов выделился водород массой 0,25 г. Вычислите массу веществ, выделившихся на других электродах.
7. Какая масса серной кислоты, образуется в анодном пространстве при электролизе водного раствора сульфата натрия, если на аноде выделился кислород объемом 1,12 дм 3 (н.у.)? Вычислите массу вещества, выделившегося на катоде.
8. Электролиз водного раствора сульфата цинка проводили в течение 5 ч, при этом на аноде выделился кислород объемом 6 дм 3 (н.у.). Вычислите силу тока (электроды инертные).
9. Электролиз водного раствора нитрата серебра проводили при токе силой 2А в течение 4 ч. Составьте электронные уравнения процессов, происходящих на инертных электродах. Какая масса металла выделилась на катоде и каков объем газа (н.у.), выделившегося на аноде?
10. Электролиз водного раствора сульфата некоторого металла проводили при токе силой 6 А в течение 45 мин, в результате чего на катоде выделился металл массой 5,49 г. Вычислите эквивалентную массу металла.
11. Как изменится масса серебряного анода, если электролиз водного раствора нитрата серебра проводили при токе силой 2 А в течение 33 мин 20 с?
12. Электролиз водного раствора иодида натрия проводили при токе силой 6 А в течение 2,5 ч. Вычислите массу веществ, выделяющихся на электродах.
13. Составьте электронные уравнения процессов, происходящих при электролизе водного раствора нитрата серебра с серебряным анодом. Масса анода уменьшается на 5,4 г. Определите расход электричества при этом.
14. При электролизе водного раствора сульфата меди(II) при токе силой 2,5 А в течение 15 мин выделилась медь массой 0,72 г. Составьте электронные уравнения процессов, происходящих на электродах с медным и угольным анодами. Вычислите выход по току (т, %).
15. При электролизе расплава неизвестного вещества массой 8 г на аноде выделился водород объемом 11,2 дм 3 (н.у.). Что это за вещество? Можно ли провести электролиз его водного раствора?
16. При электролизе с инертными электродами 150 см 3 раствора хлорида калия с массовой долей 5 % (р = 1,05 г./см 3 ) током силой 8 А в течение 1 ч 40 мин у анода выделился газ объемом 4,48 дм 3 (н.у.).
17. Определите концентрацию щелочи в образовавшемся растворе (w, %).
Через раствор сульфата цинка(II) в течение 45,03 мин пропускали постоянный ток.
18. Определите силу тока, если известно, что на катоде и аноде выделились одинаковые объемы газов, а масса одного электрода увеличилась на 1,1 г. Электроды инертные.
19. Электролиз 200 см 3 раствора сульфата меди(II) с массовой долей 6% (р = 1,02 г./см 3 ) продолжали до тех пор, пока масса раствора не уменьшилась на 5 г. Какая масса сульфата меди(II) осталась в растворе после электролиза?
20. Через электролизер, заполненный водным раствором хлорида калия пропустили постоянный ток (электроды инертные), в результате чего масса раствора уменьшилась на 3,5 г. Для нейтрализации
оставшегося раствора был израсходован раствор серной кислоты (w = 8%) массой 20,0 г. Какова масса газообразных продуктов, образовавшихся при электролизе?
21. После электролиза водного раствора хлорида калия масса его уменьшилась на 2,16 г. Оставшаяся смесь прореагировала полностью с раствором соляной кислоты (w = 10%) массой 12,6 г.
Найдите массу каждого продукта, образовавшегося при электролизе.
22. При электролизе водного раствора хлорида натрия на катоде выделился водород объемом 13,44 дм 3 (н.у.). Газ, выделившийся на аноде пропущен через горячий раствор едкого калия, при этом образовались хлорид и хлорат калия. Рассчитайте массу образовавшихся солей.
23. Электролиз водного раствора хлорида никеля(II), содержащего соль массой 129,7 г проводили при токе силой 5 А в течение 5,36 ч. Сколько хлорида никеля(II) осталось в растворе и какой объем хлора (н.у.) выделился на аноде?
24. Вычислите массу водорода и кислорода, образующихся при прохождении тока силой 3 А в течение 1 ч через раствор NaNO3 .
25. Определите массу выделившегося железа при прохождении тока силой 1,5 А в течение 1 ч через растворы сульфата железа(II) и хлорида железа(III) (электроды инертные).
26. При прохождении через раствор электролита тока силой 0,5 А за 1 ч выделяется 0,55 г. металла. Определите эквивалентную массу металла.
Примерные вопросы к итоговой аттестации по предмету
1. Методы качественного анализа.
2. Способы выполнения аналитических реакций, типы реакций; чувствительность реакций.
3. Закон действия масс, смещение ионных равновесий, значение теории электролитической диссоциации в качественном анализе.
4. Деление катионов на группы по кислотно-основной классификации.
5. Периодической закон и аналитическая классификация ионов.
6. Гидролиз солей, значение гидролиза в химическом анализе.
7. Определение рН раствора, изменение реакции среды.
8. Произведение растворимости, превращение одних малорастворимых электролитов в другие.
9. Значение реакций окисления-восстановления в качественном анализе.
10. Применение реакций комплексообразования в качественном анализе.
11. Использование органических реагентов в анализе.
12. Классификация анионов.
13. Анализ сухого вещества (основные приемы, этапы).
14. Значение аналитической химии.
15. Аналитическая химия, её задачи и значение. Методы анализа.
16. Правила и техника выполнения лабораторных работ и ведения лабораторного журнала.
17. Классификация катионов.
18. Классификация анионов.
19. Характеристика катионов 1‑й аналитической группы.
20. Систематический ход анализа катионов 1‑й аналитической группы.
21. Характеристика катионов 2‑й аналитической группы.
22. Систематический ход анализа катионов 2‑й аналитической группы.
23. Характеристика катионов 3‑й аналитической группы.
24. Систематический ход анализа катионов 3‑й аналитической группы.
25. Характеристика катионов 4‑й аналитической группы.
26. Систематический ход анализа катионов 4‑й аналитической группы.
27. Характеристика анионов.
28. Систематический ход анализа анионов.
29. Методы количественного анализа. Их краткая характеристика.
30. Весовой метод анализа.
31. Метод нейтрализации.
33. Концентрации растворов. Методы их вычисления.
34. Теория индикаторов.
35. Приготовление стандартных растворов веществ.
36. Метод окисления-восстановления.
39. Методы осаждения.
40. Метод комплексонотитрования.
41. Кривые титрования.
42. Физико-химические методы анализа. Их краткая характеристика.
43. Колориметрический метод.
Примерные задания к итоговой аттестации по предмету
1) Почему открытие катиона калия гидротартратом натрия NaHC4 H4 Og должно проводиться в нейтральной среде? Напишите уравнение реакции.
2) Почему осаждение катиона Na + в виде дигидроантимоната натрия NaH2 Sb04 должно проводиться в нейтральной, а не в кислой или щелочной среде?
3) Почему перед открытием катиона К + необходимо удалить катион NH/?
4) При действии группового реактива на катионы второй группы получаются осадки – хлориды соответствующих катионов: AgCl и РЬС12 . Какова растворимость хлоридов в воде и как это используется в анализе?
5) Какова роль азотной кислоты при открытии катионов серебра?
6) Какие происходят явления, если смесь солей AgCl, AgBr, Agl обработать водным раствором аммиака?
7) Какие продукты реакции образуются при взаимодействии хлорида ртути (I) с раствором аммиака? Укажите их химические формулы.
8) Какие химические соединения получаются при взаимодействии хлорида серебра с избытком раствора аммиака? Напишите их химические формулы.
9) Как можно растворить осадок сульфата бария?
10) Какой осадок выпадает первым, если к исследуемому раствору, содержащему катионы бария, стронция и кальция в равных концентрациях, постепенно приливать раствор серной кислоты?
11) Соли каких катионов окрашивают пламя газовой горелки в желто-зеленый цвет?
12) Какая реакция открытия катиона кальция является селективной?
13) Как проводится открытие катиона бария в присутствии катионов стронция и кальция?
14) Как повысить чувствительность реакции обнаружения катиона кальция серной кислотой?
15) Как можно объяснить аналитический эффект выпадения осадка при добавлении ацетона к гипсовой воде?
16) Как отделить катионы 2 группы от катионов 1 и 3 аналитических групп?
17) Действием какого реагента можно отделить катионы 3 аналитической группы от катионов первой группы?
18) Подберите несколько окислителей, которыми можно окислить катионы Сг 3+ в СгО 2- или в Сг «0, 2- .
19) В какой среде будет протекать окисление катиона Сг 3+ до Сг 6+ при взаимодействии его: а) с пероксидом водорода, б) с перманганатом калия?
20) Сравните А1 (ОН)3 и Zn(OH)2 . Какой из этих гидроксидов выпадает в осадок раньше при осторожном добавлении едкого натра к раствору, содержащему одинаковые концентрации катионов?
21) Почему добавление хлорида аммония способствует растворению Zn(OH)2 ? Приведите уравнения реакций.
22) Подберите окислитель, определите среду и составьте уравнение реакции окисления ионов Мn 2+ в ионы марганцевой кислоты.
23) Какова роль нитрата серебра при окислении катиона Мn 2+ персульфатом аммония (NH4 )2 S2 08 ?
24) Можно ли открыть катион Mg 2+ при одновременном присутствии в растворе катиона. Fe 2 *?
25) В чем состоит сходство в свойствах Fe(OH)2 и Mg(OH)2 ?
26) Наличие каких катионов возможно в растворе, если при действии щелочи на реакционную смесь, содержащую катионы 5 аналитической группы, выпадает белый осадок?
27) Напишите ионно-молекулярное уравнение реакции обнаружения: а) катиона железа (III) в виде берлинской лазури; б) катиона железа (II) в виде турнбулевой сини.
28) Какие из катионов в растворе окрашены?
29) Какие катионы б аналитической гуппы присутствуют в растворе, если: а) при действии раствора щелочи на реакционную смесь образовался голубой осадок, чернеющий при нагревании; б) при действии раствора аммиака образовался синий осадок, растворимый в избытке аммиака с окрашиванием реакционной смеси в желто-бурый (или грязно-желтый) цвет?
30) Какой катион присутствует в растворе, если при добавлении к реакционной смеси роданида аммония с изоамиловым спиртом образуется кольцо, окрашенное в ярко-синий цвет?
31) На какие аналитические группы можно разделить анионы по их отношению к двум реактивам: хлориду бария и нитрату серебра?
32) Почему проводят реакции с хлоридом бария в нейтральной или в слабощелочной среде, а с нитратом серебра в присутствии азот ной кислоты?
33) На какие группы можно разделить анионы на основании их окислительных или восстановительных свойств? Какие реактивы используют в этом случае в качестве групповых?
34) Каким реагентом и в каких условиях можно обнаружить карбонат-анион?
35) Какой из анионов будет осаждаться первым при действии на реакционную смесь, содержащую анионы Г, Вг, С1, нитратом серебра?
36) На чем основано открытие ацетат-ионов раствором хлорида железа (III)?
1. Алексеев В.Н. Количественный анализ. М.: Госхимиздат, 1962.504 с.
2. Барсукова 3. А. Аналитическая химия. М., Высшая школа, 1990.
3. Воскресенский А.Г., Солодкин И. С, Семиколенов Г.Ф. Сборник задач и упражнений по аналитической химии. М., Просвещение, 1999.
4. Гильманшина С.И. Основы аналитической химии. Курс лекций. 2=е изд. – СПб.:Питер, 2006.-224 с.: ил. – (Серия «Учебное пособие»)
5. Жванко ЮН. Аналитическая химия и техно-химический контроль в общественном питании./ Панкратова Г.В., Мамедова З.И. / М., Высшая школа, 2002.
6. Корснман Я.И. Задачник по аналитической химии / П.Т. Суханов; С.П. Калинкина/ Воронеж, 2001. 335 с.
7. Лидин Р.А. Задачи по неорганической химии./ В.А. Молочко, Л.А. Андреева / М.: Высшая школа, 2001. 318 с.
8. Романцева Л.М. Сборник задач и упражнений по общей химии./ З.Л. Лещинская, В.А. Суханова / М.: Высшая школа, 2001.405 с.
9. Толстоусов, СМ. Эфрос. Задачник по количественному анализу. Л.: Химия, 1986. 160 с.
10.Цитович И.К. Курс аналитической химии. Москва, 1985. 399 с.
11.Основы аналитической химии, ч. I, II. Москва, 2006. 378 с.
12.Сборник вопросов и задач по аналитической химии, под редакцией В.Н. Васильева. М.: Высшая школа, 2004. 212 с.
http://libr.aues.kz/facultet/tef/kaf_pt/50/umm/pte_1.htm
http://www.bestreferat.ru/referat-119969.html

 С целью осуществления контроля знаний и проверки уровня усвоения материала, программой предусмотрено проведение итогового контроля знаний.
С целью осуществления контроля знаний и проверки уровня усвоения материала, программой предусмотрено проведение итогового контроля знаний.





















