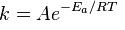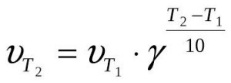Тестовые задания. 2.2.1 Величины, пропорциональные массе (или количеству вещества) рассматриваемого рабочего тела или термодинамической системы
2.2.1 Величины, пропорциональные массе (или количеству вещества) рассматриваемого рабочего тела или термодинамической системы, называются…
2.2.2 Величины, которые не зависят от массы термодинамической системы, называются…
2.2.3 Значение стандартных энергий Гиббса можно определить по уравнению 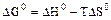
а) стандартное значение энтальпии;
б) стандартное значение энтропии;
в) термодинамическая константа равновесия.
2.2.4 Значение стандартных энергий Гиббса можно определить по уравнению 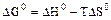
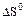
а) стандартное значение энтальпии;
б) стандартное значение энтропии;
в) термодинамическая константа равновесия.
2.2.5 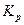
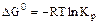
а) стандартное значение энтальпии;
б) стандартное значение энтропии;
в) термодинамическая константа равновесия;
г) универсальная газовая постоянная.
2.2.6 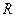
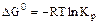
а) стандартное значение энтальпии;
б) стандартное значение энтропии;
в) термодинамическая константа равновесия;
г) универсальная газовая постоянная.
2.2.7 Порядок и знак величины 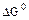
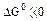
а) равенство сдвинуто вправо, выход продукта велик, константа равновесия имеет большое значение;
б) равенство сдвинуто влево, выход продукта мал, 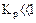
в) существует равновесие.
2.2.8 Порядок и знак величины 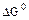
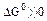
а) равенство сдвинуто вправо, выход продукта велик, константа равновесия имеет большое значение;
б) равенство сдвинуто влево, выход продукта мал, 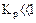
в) существует равновесие.
2.2.9 Порядок и знак величины 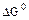
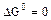
а) равенство сдвинуто вправо, выход продукта велик, константа равновесия имеет большое значение;
б) равенство сдвинуто влево, выход продукта мал, 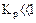
в) существует равновесие;
2.2.10 Значение 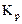
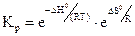
Укажите условия протекания экзотермической реакции:
а) 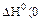
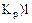
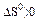
б) 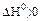
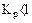
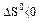
в) 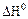
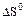
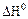
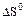
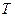
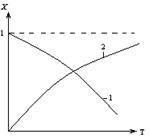
2.2.11 На рисунке представлена зависимость равновесной степени превращения от температуры.
Кривая 1 – это для…
а) экзотермических реакций;
б) эндотермических реакций.
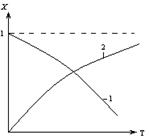
2.2.12 На рисунке представлена зависимость равновесной степени превращения от температуры.
Кривая 2 – это для…
а) экзотермических реакций;
б) эндотермических реакций.
2.2.13 Для определения термодинамической константы равновесия пользуются приближенным уравнением 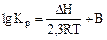
Для экзотермической реакции при повышении температуры 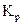
в) остается неизменной.
2.2.14 Для определения термодинамической константы равновесия пользуются приближенным уравнением 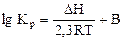
Для эндотермической реакции при повышении температуры 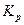
в) остается неизменной.
2.2.15 Для экзотермической реакции с повышением температуры равновесная степень превращения …
в) остается неизменной.
2.2.16 Для эндотермической реакции с повышением температуры равновесная степень превращения…
в) остается неизменной.
2.2.17 Для смещения равновесия слева направо для реакции 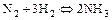
в) изменение давления не влияет на равновесие реакции.
2.2.18 Для смещения равновесия слева направо для реакции
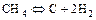
в) изменение давления не влияет на равновесие реакции.
2.2.19 Для смещения равновесия слева направо для реакции
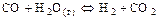
в) изменение давления не влияет на равновесие реакции.
2.2.20 При увеличении концентрации исходных реагентов равновесие смещается в сторону…
а) исходных реагентов;
б) целевых продуктов;
в) увеличение концентрации реагентов не влияет на равновесие.
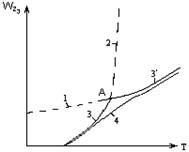 |
Рисунок 2.1 – Зависимость общей скорости
гетерогенного процесса от температуры
2.2.21 На рисунке 2.1 кривая 1 – это…
а) скорость диффузии;
б) скорость химической реакции;
в) общая скорость процесса, теоретическая;
г) общая скорость процесса, установленная экспериментально.
2.2.22 На рисунке 2.1 кривая 2 – это…
а) скорость диффузии;
б) скорость химической реакции;
в) общая скорость процесса, теоретическая;
г) общая скорость процесса, установленная экспериментально.
2.2.23 На рисунке 2.1 кривая 3 – это…
а) скорость диффузии;
б) скорость химической реакции;
в) общая скорость процесса, теоретическая;
г) общая скорость процесса, установленная экспериментально.
2.2.24 На рисунке 2.1 кривая 4 – это…
а) скорость диффузии;
б) скорость химической реакции;
в) общая скорость процесса, теоретическая;
г) общая скорость процесса, установленная экспериментально.
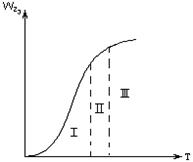 |
Рисунок 2.2 – Зависимость общей скорости
гетерогенного процесса от температуры
2.2.25 На рисунке 2.2 
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.26 На рисунке 2.2 
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.27 На рисунке 2.2 
а) кинетическая область;
б) переходная область;
 |
в) диффузионная область.
Рисунок 2.3 – Зависимость общей скорости гетерогенного
процесса от линейной скорости газового потока
2.2.28 На рисунке 2.3 
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.29 На рисунке 2.3 
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.30 На рисунке 2.3 
а) кинетическая область;
б) переходная область;
 |
в) диффузионная область.
Рисунок 2.4 – Зависимость общей скорости
гетерогенного процесса от температуры
2.2.31 На рисунке 2.4 
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.32 На рисунке 2.4 
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.33 На рисунке 2.4 
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.34 Скорость гетерогенного процесса можно определить по уравнению 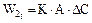
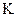
а) коэффициент скорости процесса;
б) поверхность контакта фаз;
в) движущая сила процесса.
2.2.35 Скорость гетерогенного процесса можно определить по уравнению 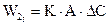
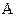
а) коэффициент скорости процесса;
б) поверхность контакта фаз;
в) движущая сила процесса.
2.2.36 Скорость гетерогенного процесса можно определить по уравнению 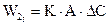
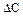
а) коэффициент скорости процесса;
б) поверхность контакта фаз;
в) движущая сила процесса.
2.2.37 Для гетерогенного процесса 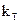
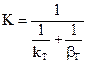
а) коэффициент скорости процесса;
б) коэффициент скорости массоотдачи в газовой фазе, отнесенной к единице поверхности;
в) константа скорости реакции.
2.2.38 Для гетерогенного процесса 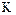
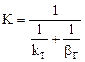
а) коэффициент скорости процесса;
б) коэффициент скорости массоотдачи в газовой фазе, отнесенной к единице поверхности;
в) константа скорости реакции.
2.2.39 Для гетерогенного процесса 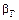
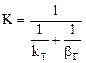
а) коэффициент скорости процесса;
б) коэффициент скорости массоотдачи в газовой фазе, отнесенной к единице поверхности;
в) константа скорости реакции.
2.2.40 Для гетерогенного процесса 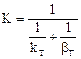
Если 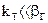
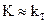
а) в кинетической области;
б) в переходной области;
в) в диффузионной области.
2.2.41 Для гетерогенного процесса 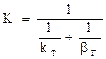
Если 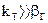
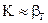
Следовательно, процесс протекает…
а) в кинетической области;
б) в переходной области;
в) в диффузионной области.
2.2.42 Для повышения скорости гетерогенного процесса, протекающего в диффузионной области ( 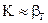
а) увеличивать скорость газового потока, усиливать его турбулизацию;
б) повышать температуру;
в) повышать температуру и применять катализатор.
2.2.43 Для повышения скорости гетерогенного процесса, протекающего в кинетической области ( 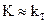
а) увеличивать скорость газового потока, усиливать его турбулизацию;
б) повышать температуру;
в) повышать температуру и применять катализатор.
2.2.44 Для реакции 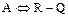
а) целевого продукта;
б) исходного реагента;
в) не изменяется.
2.2.45 Для реакции 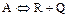
а) целевого продукта;
б) исходного реагента;
в) не изменяется.
Ответы к тестовым заданиям
| Номер вопроса | |||||||||||||||
| 2.2 | а | б | а | б | в | г | а | б | в | а | а | б | б | а | б |
| Номер вопроса | |||||||||||||||
| 2.2 | а | а | б | в | б | а | б | в | г | а | б | в | в | б | а |
| Номер вопроса | |||||||||||||||
| 2.2 | а | б | в | а | б | в | в | а | б | а | в | а | в | а | б |
Дата добавления: 2015-06-22 ; просмотров: 1024 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Скорость гетерогенных процессов
Для установления оптимальных параметров гетерогенных процессов и их аппаратурного оформления и проектирования необходимо прежде всего изучить статику (т.е. равновесие) и кинетику (т.е. скорость) этих процессов. Равновесие в гетерогенных системах зависит от температуры, давления и концентрации как исходных реагентов, так и продуктов реакции, скорость же взаимодействия реагентов, находящихся в разных фазах, зависит не только от скорости химической реакции, но и от многих других факторов (как любой процесс, протекающий на макроуровне). Поэтому в общем виде скорость гетерогенного процесса выражается следующим уравнением
где r – скорость гетерогенного процесса; k – коэффициент скорости процесса; F – поверхность контакта фаз; ∆C – движущая сила процесса. Рассмотрим влияние различных факторов на каждый из параметров, входящих в уравнение (3.1), а также способы увеличения общей скорости процесса
Коэффициент скорости процесса.Коэффициент включает в себя многие факторы, влияющие на скорость гетерогенного процесса. В большинстве практических случаев влияние этих факторов неодинаково. Так, например, химический процесс обычно состоит из нескольких стадий, а его общая скорость определяется скоростью наиболее медленной (лимитирующей) стадии. Поэтому, для интенсификации процесса необходимо прежде всего определить, какая из стадий является наиболее медленной, и ускорить ее. Такими наиболее медленными стадиями, каждая из которых может тормозить весь процесс, являются:
1) химическая реакция;
3) одновременно химическая реакция и диффузия.
В первом случае, скорость диффузии велика по сравнению со скоростью химической реакции; тогда говорят, что процесс протекает в кинетической области. Во втором случае, скорость химической реакции значительно больше скорости диффузии – процесс протекает в диффузионной области (во внешне- или внутридиффузионной). В третьем случае, скорости отдельных стадий соизмеримы, тогда говорят, что процесс протекает в переходной (смешанной) области.
После установления лимитирующей стадии процесса принимают меры, обеспечивающие повышение скорости этой стадии. Так, если процесс протекает в кинетической области, создают условия, ускоряющие химическую реакцию; если процесс протекает в диффузионной области, то ускоряют процесс диффузии; если же процесс протекает в переходной области, то создают условия, повышающие и скорость химической реакции (rх.р.), и скорость диффузии (rФ). Для установления лимитирующей стадии процесса существует несколько приемов. Рассмотрим наиболее важные из них.
Ранее было показано, что температура оказывает сильное влияние на скорость химических реакций. Так при увеличении температуры на 10 °С скорость химической реакции в некоторых случаях возрастает в 2–3 раза. Скорость диффузии газов зависит от температуры в значительно меньшей степени, приближенно эта зависимость выражается уравнением D = aT 2 , (3.2)
где D – коэффициент диффузии; a – постоянный коэффициент. Общая скорость процесса не может превышать самую низкую составляющую ее скорость rф ³ r £ rх.р .
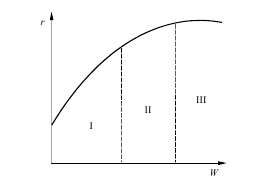
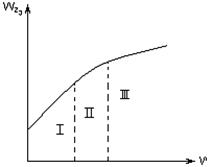
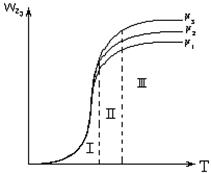
Из уравнения (3.2) следует, что при повышении температуры на 10°С скорость диффузии увеличивается всего на 3…5 %. Это разное влияние температуры используют для определения лимитирующей стадии процесса. Лимитирующая стадия гетерогенного процесса может быть установлена опытным путем. Так, если опыт показывает, что повышение температуры оказывает сильное влияние на скорость процесса, то процесс протекает в кинетической области (рис. 3.2, область I). Если при дальнейшем повышении температуры ее влияние на скорость общего процесса уменьшается, значит процесс перешел в переходную область
Рис.3.2 Зависимость общей скорости процесса r от температуры Т: I- кинетическая область; II – переходная область; III – диффузионная область.
(рис. 3.2, область II). Если же далее при повышении температуры общая скорость процесса практически не изменяется, значит процесс протекает в диффузионной области (рис. 3.2, область III).
Изменение скорости потока также может быть использовано для определения лимитирующей стадии процесса, поскольку она оказывает существенное влияние на скорость внешней диффузии.
Так, на кривой зависимости общей скорости процесса от скорости потока r = f (w) можно выделить три области: диффузионную, переходную и кинетическую. В диффузионной области наблюдается значительное влияние скорости потока (рис.3.3, область I); в переходной области влияние скорости потока невелико (область II) и в кинетической области скорость потока не влияет на скорость процесса (область III).
Рис. 3.3 Зависимость общей скорости процесса r от скорости потока w : I – диффузионная область; II – переходная область; III – кинетическая область
Влияние скорости потока на общую скорость процесса можно проследить также на графике, отражающем зависимость r = f (T), если нанести кривые этой зависимости для различных скоростей потока (рис. 3.4).
Ход кривых r = f (w) подтверждает тот факт, что область III является диффузионной (с увеличением w скорость процесса возрастает), и указывает на способ дальнейшего повышения общей скорости процесса в рассматриваемом случае.
Рис. 3.4 Зависимость общей скорости процесса r от температуры Т и скорости потока w (w1 > βг , из уравнения (3.9) следует 1/К = 1/bг или К = bг., т.е. общая скорость процесса определяется скоростью диффузии (процесс протекает в диффузионной области). Для повышения скорости такого процесса необходимо увеличить коэффициент βг. Обычно это осуществляют путем уменьшения толщины, пограничного слоя газа [δ в уравнении (3.4 а)]. Для этого увеличивают скорость газового потока или усиливают его турбулизацию.
Когда βг 2 / м 3 , а колец размером 100 х100 х10 – 60 м 2 /м 3 .
Рис. 3.7 Реакторы для осуществления химических процессов г – ж: а – башня с насадкой; б – полая башня; 1 – башня, 2 – холодильник; 3 – насос
В полых башнях поверхностью соприкосновения фаз служит поверхность капель, образующихся при разбрызгивании жидкости в башне с помощью различных устройств (рис. 3.7, б). Общая поверхность (поверхность контакта фаз F) определяется по формуле
где F – поверхность, приходящаяся на 1 кг разбрызгиваемой жидкости; ρ – плотность жидкости, г/см 3 ; R – радиус капель, см. Так, если плотность жидкости ρ = 1 г/см 3 , из уравнения (3.10) следует
R, см …………………………….. 1,0 0,1 0,01 0,001
F, м 2 ……………………………. 0,3 3 30 300
В некоторых случаях в системах г – ж процесс осуществляется в барботажных и пенных аппаратах, в которых газ в виде отдельных пузырьков барботирует через слой жидкости. При этом поверхностью контакта служит внутренняя поверхность пузырьков: чем меньше размер пузырьков газа и чем выше слой жидкости, тем больше поверхность F. Для системы г – т увеличение поверхности соприкосновения фаз достигается измельчением твердой фазы. Газообразное вещество приводят в соприкосновение с измельченным исходным веществом самыми разнообразными способами, например, твердые частицы вещества располагают на полках реактора, а поток газа движется над полками. В других случаях тонко измельченное твердое исходное вещество распыляют в потоке газообразного исходного вещества в полом объеме; таким образом сжигают пылевидное топливо в топках паровых котлов. В реакторах с псевдоожиженным (кипящим) слоем поверхность соприкосновения фаз тем больше, чем мельче частицы зернистого материала и чем выше слой этого материала.
Движущая сила процесса.Движущая сила процесса выражается уравнением
где C п.ф. – концентрация исходного вещества в передающей фазе; C з.р – концентрация исходного вещества в той же фазе в зоне реакции.
Из уравнения (3.11) следует, что существуют два способа повышения ∆C за счет увеличения Cп.ф. и снижения C з.р. . Движущая сила процесса возрастает, если увеличить концентрацию исходных реагентов в пере- дающей фазе (Cп.ф. ) или повысить давление, а также если выводить продукты реакции из сферы взаимодействия. Увеличение давления является эффективным способом повышения ∆ С, особенно для системы г – ж, так как в этом случае DС =рг –р * ,
где р г – давление исходного газообразного реагента в газовой фазе; р* – равновесное давление исходного реагента у поверхности жидкости.
При повышении давления процесса рг увеличивается, а р* остается постоянным, следовательно, при увеличении давления растеттакже ∆С .Вывод продуктов из сферы реакции также является эффективным способом увеличения движущей силы и широко используется в самых разнообразных производственных процессах. При выводе продуктов реакции из зоны реакции уменьшается объем реакционной смеси, а Сг (или рг ) соответственно увеличивается. Рост ∆ С за счет снижения р* на практике осуществляется редко. Для систем г – ж это достигается путем уменьшения температуры, так как одновременно понижается равновесное давление вещества над жидкостью (р* ). Однако практические возможности для использования этого приема ограничены, поскольку при понижении температуры сильно уменьшается константа скорости реакции (уравнение Аррениуса) и общая скорость процесса.
Рис.3.8 Изменение движущей силы процесса ∆ С во времени t
По мере протекания реакции концентрация Сг уменьшается, соответственно снижается движущая сила ∆С , а также уменьшается общая скорость процесса, поэтому на практике в целях поддержания высокой скорости процесса его ведут при достаточно большом значении ∆С , ограничивая время пребывания реакционной смеси в реакторе некоторым оптимальным значением tопт (рис. 3.8).
Вопросы для самоконтроля
1. Что такое гомогенные и гетерогенные процессы ?
2. От чего зависит скорость гомогенного процесса?
3. Приведите примеры гомогенных и гетерогенных реакций.
4. Что такое порядок и молекулярность реакции?
5. От каких факторов зависит скорость гетерогенного процесса?
6. Зависимость скорости гетерогенного процесса от поверхности контакта.
7. Зависимость скорости гетерогенного процесса от коэффициента скорости процесса
8. Способы повышения движущей силы гетерогенных процессов.
9. Стадии гетерогенного процесса
10. Способы увеличения поверхности контакта фаз в системах Ж – Т , Г — Ж, Г — Т
Скорость химической реакции — формула, условия и влияющие факторы
Скорость химической реакции — определение довольно древнее, но по-прежнему актуальное, так как является базовым понятием в химической науке и её прикладном значении. Сама возможность влияния человека на скорость и объем химического процесса позволила в свое время сделать резкий прорыв в этой и многих других областях, потому что больше не приходилось дожидаться результата так же долго, сколько он занимает в естественной природной среде.
Соответственно, наличие катализаторов позволяет ученым и сейчас ускорять прогресс науки, достигать поставленных задач. Такой раздел знаний изучает химическая кинетика — наука, определяющая закономерности влияния физических и химических условий на протекание химических реакций.
Скорость химической реакции — изменение количества одного из реагентов за промежуток времени в реакционном пространстве. Эта скорость является фундаментальным понятием химической кинетики. Она измеряется путём изменения концентрации одного из веществ. Как правило, рассчитывается в молях (классическая единица измерения) на литр за единицу времени.
Стоит сказать, что абсолютно все химические реакции рассматриваются только в системе, т. е. в совокупности отдельно взятых веществ и объектов.
Скорость реакции в гомогенной системе
В химии различают гомогенные (одинаковые фазы внешней среды) и гетерогенные (различающиеся фазы окружающей среды) реакции в зависимости от фаз среды.
Реакции в гомогенной системе происходят только в однородной фазе в общем объеме реакционной системы. Реакция происходит исключительно при взаимодействии растворов жидкостей или газов.
Скорость химической реакции в гомогенной системе — это изменение концентрации одного из веществ, участвующих в химической реакции, за единицу времени.
Ниже приведены примеры таких реакций и нужная формула:
NaOH(р-р) + HCl(р-р) = NaCl(р-р) + H2O.
Скорость реакции в гетерогенной системе
В гетерогенных же системах химические реакции протекают только на поверхности раздела разных фаз.
Поверхность раздела фаз — это граничная поверхность между двумя веществами, вступающими в реакцию, в контакт между собой.
Например, при взаимодействии железа с соляной кислотой: Fe + 2HCl → FeCl2 + H2.
Факторы, влияющие на скорость химической реакции
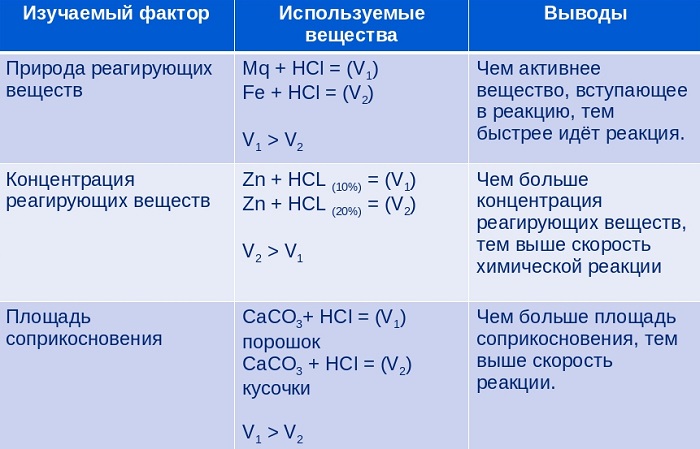
Как ранее было сказано, скорость химической реакции зависит от нескольких параметров:
соотношения концентраций реагентов;
природы взятых реагентов;
площади соприкосновения реагентов;
давления (применимо, если в случае реагентов взяты газообразные вещества).
Температура
Правилом Вант-Гоффа и уравнением Аррениуса определяется скорость взаимодействия реагентов. Сванте Аррениус искал взаимосвязь скорости и температуры. Он установил, что химические процессы поддаются равенству константы скорости:
Еа — min энергия для запуска реакции;
R —постоянная газа;
A — постоянная, указывающая на вероятность возможного взаимодействия молекул.
Удобно пользоваться и правилом Якоба Вант-Гоффа, смысл которого гласит, что увеличивается v реакции от двух до четырех раз при росте температуры на десять градусов (по Цельсию). Для простоты расчётов было создано уравнение:
Соотношение концентраций реагентов
Обусловленность скорости от концентрации реагентов в системе известна в науке, как закон действующих масс. Его открыли Като Гульдберг и Петер Вааге.
Скорость этих реакций выражается уравнением:
v — скорость взаимодействия веществ;
cA и cB — концентрации реагентов;
k —коэффициент скорости.
Катализаторы
Самым распространённым способом изменить скорость реакции является добавление к ней катализатора (ускорителя) или ингибитора (замедлителя).
Основное преимущество таких веществ в том, что они не являются расходным материалом и не влияют на равновесие в продуктах внутри системы.
Для простоты возьмем реакцию разложения пероксида водорода: 2Н2О2 = 2Н2О + О2.
Без дополнительных веществ эта простая реакция протекает довольно медленно, но если добавить оксид марганца (MnO2), то сразу заметим наличие газа (O2).
Природа веществ
Скорость реакции также зависит от природы взятых веществ. Здесь тоже не все так просто, ведь имеет вес почти каждая мелочь этого вещества: характер и прочность кристаллической решетки и химических связей, строение оболочки атомов и расположения на ней электронов (согласно периодическому закону Д. И. Менделеева о порядке веществ в таблице).
Для простоты объяснения приведем пример: согласно строению веществ, натрий (Na) гораздо легче отдает свои электроны, чем олово (Sn), соответственно, реагировать с одним и тем же веществом он будет быстрее.
Площадь соприкосновения реагентов
Что касается смесей твердых и жидких фаз, то тут для увеличения скорости реакции поможет увеличение площади соприкосновения этих веществ.
Приведем пример: если мы возьмем часть щелочного метала в водном растворе, то реакция пойдет достаточно быстро, однако, если мы сделаем из кусочка металла порошок, то скорость взаимодействия увеличится.
Давление
В случае химической реакции, реагентами которой являются газы, то изменить скорость взаимодействия можно увеличением давления в системе, потому что таким образом повышается и концентрация газа. Зависимость скорости от давления будет прямо пропорциональной.
http://poisk-ru.ru/s50765t6.html
http://nauka.club/khimiya/skorost-khimicheskoy-reaktsii.html