Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e310ae7582f95e2 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Как правильно рассчитать значение энергии Гиббса и тепловой эффект реакции
Задача 1117.
Пользуясь данными таблиц приложения, установить, какие из перечисленных восстановителей могут восстановить Fe2О3 до свободного металла: а) Zn; б) Ni; в) Н2S.
Решение:
Уравнения реакций:
ΔG 0 (Fe2O3) = -740,8 кДж/моль; ΔG 0 (NiO) = -211,6 кДж/моль;
ΔG 0 (ZnO) = -320,88 кДж/моль; ΔG 0 (H2S) = 33, кДж/моль;
ΔG 0 (H2O) = -228,8 кДж/моль.
Рассчитаем значение энергии Гиббса для каждой реакции, получим:
ΔG 0 (а) = 3ΔG 0 (ZnO) — ΔG 0 (Fe2O3) = 3(-320,88) – (-740,8) = -221,84 кДж;
ΔG 0 (б) = 3ΔG 0 (NiO) — ΔG 0 (Fe2O3) = 3(-211,6) – (-740,8) = 106 кДж;
=3(-228,8) – [3(33) + (-740,8) = -44,6 кДж.
Так как ΔG 0 (а) и ΔG 0 (в) 0 (б) > 0, то никель не может восстановить Fe2О3 до свободного металла.
Определение теплового эффекта реакции
Задача 1118.
При выплавке железа из магнитного железняка одна из протекающих в доменной печи реакций выражается уравнением: Fe3O4 + СО = 3FeO + СO2. Пользуясь данными таблиц приложения, определить тепловой эффект реакции. В каком направлении сместится равновесие этой реакции при повышении температуры?
Решение:
Уравнение реакции:
ΔH 0 (Fe3O4) = -1014,8 кДж/моль; ΔH 0 (FeO) = -244,5 кДж/моль;
ΔH 0( CO) = -137,2 кДж/моль; ΔH 0 (CO2) = -394,6 кДж/моль.
Рассчитаем тепловой эффект реакции, используя следствие из закона Гесса, получим:
ΔH 0 x.p.= 3ΔH 0 (FeO) + ΔH 0 (CO) – [ΔH 0 (Fe3O4) + ΔH 0 (CO)] =
= [3(-244,5) + (-394,6)] – [(-1014,5) + (-137,2)] = 23,6 кДж.
Термохимическое уравнение будет иметь вид:
Так как реакция эндотермическая, то при повышении температуры, согласно принципу Ле Шателье, равновесие системы сместится вправо, в сторону уменьшения теплоты.
Тепловые эффекты реакций. Закон Гесса
В термохимии количество теплоты Q, которая выделяется или поглощается в результате химической реакции, называется тепловым эффектом. Реакции, протекающие с выделением тепла, называются экзотермическими (Q>0), а с поглощением тепла — эндотермическими (Q 0 – процесс протекает с поглощением теплоты и является эндотермическим.
При расчетах тепловых эффектов химических реакций на основе закона Гесса обычно используют два вида тепловых эффектов — теплоту сгорания и теплоту образования.
Теплотой образования называется тепловой эффект реакции образования данного соединения из простых веществ.
Теплотой сгорания называется тепловой эффект реакции окисления данного соединения кислородом с образованием высших оксидов соответствующих элементов или соединения этих оксидов.
Справочные значения тепловых эффектов и других величин относят обычно к стандартному состоянию вещества.
В качестве стандартного состояния индивидуальных жидких и твердых веществ принимают состояние их при данной температуре и при давлении, равном одной атмосфере, а для индивидуальных газов – такое их состояние, когда при данной температуре и давлении, равном 1,01·10 5 Па (1атм.), они обладают свойствами идеального газа. Для облегчения расчетов справочные данные относят к стандартной температуре 298 К.
Если какой-нибудь элемент может существовать в нескольких модификациях, то в качестве стандартной принимают такую модификацию, которая является устойчивой при 298 К и атмосферном давлении, равном 1,01·10 5 Па (1атм.)
Все величины, относящиеся к стандартному состоянию веществ, отмечают верхним индексом в виде круга: 
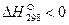
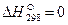
Пользуясь справочными данными стандартных теплот образования веществ, участвующих в реакции, можно легко рассчитать тепловой эффект реакции.
Из закона Гесса следует:
тепловой эффект реакции равен разности между теплотами образования всех веществ, указанных в правой части уравнения (конечных веществ или продуктов реакции), и теплотами образования всех веществ, указанных в левой части уравнения (исходных веществ), взятых с коэффициентами, равными коэффициентам перед формулами этих веществ в уравнении реакции:
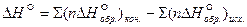
где n – количество молей вещества, участвующих в реакции.
Пример. Рассчитаем тепловой эффект реакции Fe3O4 + CO = 3FeO + CO2. Теплоты образования веществ, участвующих в реакции, составляют: для Fe3O4 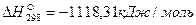
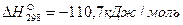
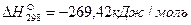
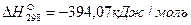
Тепловой эффект реакции
Так как 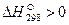
http://buzani.ru/zadachi/khimiya-glinka/1384-termokhimicheskie-protsessy-zadachi-1117-1118
http://helpiks.org/2-34634.html
