Как правильно рассчитать значение энергии Гиббса и тепловой эффект реакции
Задача 1117.
Пользуясь данными таблиц приложения, установить, какие из перечисленных восстановителей могут восстановить Fe2О3 до свободного металла: а) Zn; б) Ni; в) Н2S.
Решение:
Уравнения реакций:
ΔG 0 (Fe2O3) = -740,8 кДж/моль; ΔG 0 (NiO) = -211,6 кДж/моль;
ΔG 0 (ZnO) = -320,88 кДж/моль; ΔG 0 (H2S) = 33, кДж/моль;
ΔG 0 (H2O) = -228,8 кДж/моль.
Рассчитаем значение энергии Гиббса для каждой реакции, получим:
ΔG 0 (а) = 3ΔG 0 (ZnO) — ΔG 0 (Fe2O3) = 3(-320,88) – (-740,8) = -221,84 кДж;
ΔG 0 (б) = 3ΔG 0 (NiO) — ΔG 0 (Fe2O3) = 3(-211,6) – (-740,8) = 106 кДж;
=3(-228,8) – [3(33) + (-740,8) = -44,6 кДж.
Так как ΔG 0 (а) и ΔG 0 (в) 0 (б) > 0, то никель не может восстановить Fe2О3 до свободного металла.
Определение теплового эффекта реакции
Задача 1118.
При выплавке железа из магнитного железняка одна из протекающих в доменной печи реакций выражается уравнением: Fe3O4 + СО = 3FeO + СO2. Пользуясь данными таблиц приложения, определить тепловой эффект реакции. В каком направлении сместится равновесие этой реакции при повышении температуры?
Решение:
Уравнение реакции:
ΔH 0 (Fe3O4) = -1014,8 кДж/моль; ΔH 0 (FeO) = -244,5 кДж/моль;
ΔH 0( CO) = -137,2 кДж/моль; ΔH 0 (CO2) = -394,6 кДж/моль.
Рассчитаем тепловой эффект реакции, используя следствие из закона Гесса, получим:
ΔH 0 x.p.= 3ΔH 0 (FeO) + ΔH 0 (CO) – [ΔH 0 (Fe3O4) + ΔH 0 (CO)] =
= [3(-244,5) + (-394,6)] – [(-1014,5) + (-137,2)] = 23,6 кДж.
Термохимическое уравнение будет иметь вид:
Так как реакция эндотермическая, то при повышении температуры, согласно принципу Ле Шателье, равновесие системы сместится вправо, в сторону уменьшения теплоты.
Согласно термохимическому уравнению Fe3O4 + 4CO = 3Fe + 4CO2 + 15 Кдж при образовании 6 моль Fe3O4 в обратной реакции 1) выделяется 30 кДж 2) выделяется 60 кДж 3) поглощается 30 кДж 4) поглощается 90 ?
Химия | 5 — 9 классы
Согласно термохимическому уравнению Fe3O4 + 4CO = 3Fe + 4CO2 + 15 Кдж при образовании 6 моль Fe3O4 в обратной реакции 1) выделяется 30 кДж 2) выделяется 60 кДж 3) поглощается 30 кДж 4) поглощается 90 кДж P.
S : учитель написал, что правильный вариант ответа — 2).
Требует развернутого решения.
При прямой реакцииFe3O4 + 4CO = 3Fe + 4CO2 + 15 Кдж, Q выделяется, = > ; при обратной3Fe + 4CO2 = Fe3O4 + 4CO — 15Кдж Q будет поглощаться.
Q = n(Fe3O4) * Qмоль = 6 * 15 = 90 Кдж.
В соответствии с термохимическим уравнением : С6Н12О6 + 6О2 = = 6СО2 + 6Н2О + 2800кДж При образовании 12 моль углекислого газа : 1) Выделяется 2800 кДж теплоты ; 2) Поглощается 2800 кДж теплоты ; 3) В?
В соответствии с термохимическим уравнением : С6Н12О6 + 6О2 = = 6СО2 + 6Н2О + 2800кДж При образовании 12 моль углекислого газа : 1) Выделяется 2800 кДж теплоты ; 2) Поглощается 2800 кДж теплоты ; 3) Выделяется 5600 кДж теплоты ; 4) Поглощается 5600 кДж теплоты.
И если можно с пояснением.
Определите, выделяется или поглощается энергия в реакции H2 + Br2 = 2HBr а)при разрыве хим?
Определите, выделяется или поглощается энергия в реакции H2 + Br2 = 2HBr а)при разрыве хим.
Связи в молекулах Н2 поглощается 435, 9 кДж / моль энергии б) при разрыве хим.
Связи в молекулах Вr2 поглощается 192 кДж / моль энергии в) при образовании новой хим.
Связи в молекулах HBr выделяется 360 кДж / моль энергии.
Тепловые эффекты образования хлоридов алюминия и меди(II) соответственно равны 702?
Тепловые эффекты образования хлоридов алюминия и меди(II) соответственно равны 702.
4 кДж / моль 215.
Составьте термохимическое уравнение реакции.
При сгорании 0, 5 моль метана выделяется 440 кДж тепла?
При сгорании 0, 5 моль метана выделяется 440 кДж тепла.
Составьте термохимическое уравнение реакции горения метана.
Количества теплоты , выделяющееся при сгорании 2 моль угля(термохимическое уравнение С + О2 = СО2 + 393 кДж) равно : а) 393кДж б)786 кДж в)1179кДж с)196, 5 кДж д)3930 кДж заранее спасибо , можно с реш?
Количества теплоты , выделяющееся при сгорании 2 моль угля(термохимическое уравнение С + О2 = СО2 + 393 кДж) равно : а) 393кДж б)786 кДж в)1179кДж с)196, 5 кДж д)3930 кДж заранее спасибо , можно с решением.
Рассчитайте теплоту образования оксида алюминия, если при сгорании 5, 4 г алюминия выделяется 167, 37 кДж теплоты : а) 804 кДж / моль б) 3347, 4 кДж / моль в) 1676 кДж / моль г) 167, 4 кДж / моль?
Рассчитайте теплоту образования оксида алюминия, если при сгорании 5, 4 г алюминия выделяется 167, 37 кДж теплоты : а) 804 кДж / моль б) 3347, 4 кДж / моль в) 1676 кДж / моль г) 167, 4 кДж / моль.
При сгорание 0?
5 моль метана выделяется 440 кдж тепла.
Составьте термохимическое уравнение реакции горения метана.
Согласно термохимическому уравнению реакции CH4 + 2O2 = CO2 + 2H2O H = — 802 кДж определите, какой объем диоксида углерода будет выделяться, если при этом выделяется 1604 кДж?
Согласно термохимическому уравнению реакции CH4 + 2O2 = CO2 + 2H2O H = — 802 кДж определите, какой объем диоксида углерода будет выделяться, если при этом выделяется 1604 кДж.
Какая масса железа превратится в железную окалину, если при этом выделилось 112 кДж теплоты, а при образовании 1 моль окалины выделяется 1118 кДж теплоты?
Какая масса железа превратится в железную окалину, если при этом выделилось 112 кДж теплоты, а при образовании 1 моль окалины выделяется 1118 кДж теплоты?
Написать термохимическое уравнение горения алюминия, если при сгорание выделяется 1960 кдж тепла?
Написать термохимическое уравнение горения алюминия, если при сгорание выделяется 1960 кдж тепла.
На этой странице сайта, в категории Химия размещен ответ на вопрос Согласно термохимическому уравнению Fe3O4 + 4CO = 3Fe + 4CO2 + 15 Кдж при образовании 6 моль Fe3O4 в обратной реакции 1) выделяется 30 кДж 2) выделяется 60 кДж 3) поглощается 30 кДж 4) поглощается 90 ?. По уровню сложности вопрос рассчитан на учащихся 5 — 9 классов. Чтобы получить дополнительную информацию по интересующей теме, воспользуйтесь автоматическим поиском в этой же категории, чтобы ознакомиться с ответами на похожие вопросы. В верхней части страницы расположена кнопка, с помощью которой можно сформулировать новый вопрос, который наиболее полно отвечает критериям поиска. Удобный интерфейс позволяет обсудить интересующую тему с посетителями в комментариях.
Fe + h2so4 р = feso4 + h22na + I2 = 2naIzn + h2o = zno + h22na + o2 = na2o2zn + s = znsmg + ca(oh)2 = реакция не идёт2na + cuso4 = na2so4 + cu2zno + c = 2zn + co2al + cuso4 = al2(so4)3 + cucu + hno3 = no + cu(no3)2 + h2o.
Тепловые эффекты реакций. Закон Гесса
В термохимии количество теплоты Q, которая выделяется или поглощается в результате химической реакции, называется тепловым эффектом. Реакции, протекающие с выделением тепла, называются экзотермическими (Q>0), а с поглощением тепла — эндотермическими (Q 0 – процесс протекает с поглощением теплоты и является эндотермическим.
При расчетах тепловых эффектов химических реакций на основе закона Гесса обычно используют два вида тепловых эффектов — теплоту сгорания и теплоту образования.
Теплотой образования называется тепловой эффект реакции образования данного соединения из простых веществ.
Теплотой сгорания называется тепловой эффект реакции окисления данного соединения кислородом с образованием высших оксидов соответствующих элементов или соединения этих оксидов.
Справочные значения тепловых эффектов и других величин относят обычно к стандартному состоянию вещества.
В качестве стандартного состояния индивидуальных жидких и твердых веществ принимают состояние их при данной температуре и при давлении, равном одной атмосфере, а для индивидуальных газов – такое их состояние, когда при данной температуре и давлении, равном 1,01·10 5 Па (1атм.), они обладают свойствами идеального газа. Для облегчения расчетов справочные данные относят к стандартной температуре 298 К.
Если какой-нибудь элемент может существовать в нескольких модификациях, то в качестве стандартной принимают такую модификацию, которая является устойчивой при 298 К и атмосферном давлении, равном 1,01·10 5 Па (1атм.)
Все величины, относящиеся к стандартному состоянию веществ, отмечают верхним индексом в виде круга: 
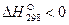
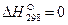
Пользуясь справочными данными стандартных теплот образования веществ, участвующих в реакции, можно легко рассчитать тепловой эффект реакции.
Из закона Гесса следует:
тепловой эффект реакции равен разности между теплотами образования всех веществ, указанных в правой части уравнения (конечных веществ или продуктов реакции), и теплотами образования всех веществ, указанных в левой части уравнения (исходных веществ), взятых с коэффициентами, равными коэффициентам перед формулами этих веществ в уравнении реакции:
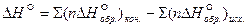
где n – количество молей вещества, участвующих в реакции.
Пример. Рассчитаем тепловой эффект реакции Fe3O4 + CO = 3FeO + CO2. Теплоты образования веществ, участвующих в реакции, составляют: для Fe3O4 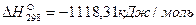
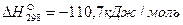
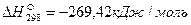
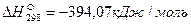
Тепловой эффект реакции
Так как 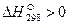
http://himia.my-dict.ru/q/5464932_soglasno-termohimiceskomu-uravneniu-fe3o4-4co-3fe/
http://helpiks.org/2-34634.html







