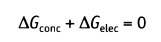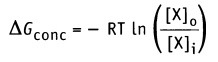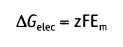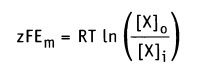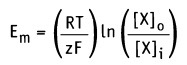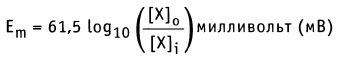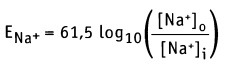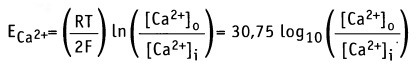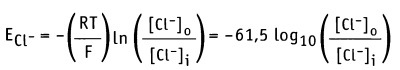Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
Согласно уравнению нернста чем активность
Равновесие между химическими и электрическими движущими силами определяет величину мембранного потенциала покоя. Состояние равновесия достигается, когда различие в свободной энергии этих сил равно нулю (другими словами, когда общий поток = 0):
Изменение свободной энергии, происходящее при движении через мембрану компонента X, можно выразить уравнением:
• R — газовая постоянная (2 кал моль-1 К-1)
• Т — абсолютная температура (К; 37 °С = 307,5 К)
• [Х]0 — концентрация X вне клетки
• [X]i — концентрация X внутри клетки
и изменение свободной энергии, обусловленное транспортом через мембрану заряда, связанного с растворенным компонентом X составляет:
• Em — равновесный потенциал (в вольтах)
• z — валентность иона (электрический заряд)
• F— число Фарадея (2,3 х 104 кал вольт-1 моль-1)
В состоянии равновесия
и после преобразования получаем.
Таким образом, значение равновесного потенциала или потенциала Нернста для одновалентного иона X при 37 °С определяется уравнением:
Если концентрация ионов известна, то уравнение Нернста можно использовать для расчета равновесного мембранного потенциала для каждого иона в отдельности. На рисунке ниже показаны результаты таких расчетов для плазматической мембраны мышечных клеток. Так, для [К+]0 = 4 мМ и [K+]i = 155 мМ значение мембранного потенциала Еm = -98 мВ, если учитывать только поток ионов К+, т. е. Еm = Еk.
Почти во всех покоящихся клетках млекопитающих плазматическая мембрана проницаема для ионов К+. Na+/К+-АТФаза поддерживает трансмембранный ионный градиент и создает внутри клетки относительно высокую концентрацию ионов К+ ([K+]i). При открытии некоторых К+-каналов ионы К+ начинают транспортироваться в направлении градиента концентрации, что приводит к появлению положительного заряда с внешней стороны мембраны и отрицательного с внутренней ее стороны. Этот отрицательный мембранный потенциал, Еm, представляет собой электродвижущую силу, которая препятствует дальнейшему выходу К+ из клетки в направлении градиента (химическая движущая сила). Таким образом, открытие в покоящейся клетке специальных селективных К+-каналов определяет значение отрицательного потенциала покоя, при котором не происходит транспорта К+ через мембрану и величина Еm остается постоянной.
Аналогично потенциал Нернста можно рассчитать и для других ионов. Если мембрана становится более проницаемой для определенных ионов, то мембранный потенциал Еm будет меняться, приближаясь к значению потенциала Нернста для этих ионов (обычно становясь более положительным при деполяризации мембраны).
Например, если плазматическая мембрана становится более проницаемой для ионов Na+, то они будут транспортироваться в направлении своего градиента концентрации. При этом мембрана будет приобретать отрицательный заряд с внешней стороны и положительный заряд с внутренней. В физиологических условиях, в покоящейся клетке, открытие нескольких Na+-каналов, наряду с постоянным притоком зарядов за счет протечки, приведет к поступлению Na+ в клетку, и значение мембранного потенциала покоя сдвинется в более положительную сторону (например, -82 мВ). Напротив, аналогичный расчет в случае ионов К+ показывает, что значение мембранного потенциала покоя составит -89 мВ. В клетках, обладающих меньшей проницаемостью для ионов К+ в результате фоновой утечки ионов Na+ и деполяризующих ионных потоков, величина мембранного потенциала покоя Em смещается в сторону более положительных значений (например, становится равной -50 мВ). При возбуждении клетки электрическим зарядом и открытии Na+ каналов, в состоянии теоретического равновесия между потоком Na+, направленным в клетку, и потоком К+, направленным в противоположную сторону, уровень мембранного потенциала оказывается ближе к ENa, а не к Ек. Согласно уравнению Нернста, равновесный потенциал для Na+ при 37 °С составляет:
Если [Na+]0 = 145 мМ и [Na+]i = 12 мМ (как для клеток мышц), то значение мембранного потенциала составляет Еm = +67 мВ, принимая во внимание транспорт только ионов Na+. Таким образом, суммарный эффект открытия Na+ каналов выражается в установлении потока ионов натрия, направленного в клетку, что приводит к сдвигу отрицательного потенциала покоя Еm до значения +67 мВ.
Аналогичным образом, когда плазматическая мембрана становится более проницаемой для Са2+, ионы транспортируются в направлении градиента концентрации. При этом мембрана на внешней стороне приобретает более отрицательный заряд, а на внутренней — более положительный. Когда под действием электрического заряда клетка возбуждается и открываются Са2+-каналы, теоретическое равновесие между потоком Са2+ в клетку и потоком К+ из клетки определяет уровень мембранного потенциала ближе к значению ЕCa. Согласно уравнению Нернста,
Если [Са2+]0 = 1,5 мМ и [Ca2+]i = 0,1 мкМ, как для мышечной клетки, то мембранный потенциал составляет Em = +129 мВ. Таким образом, суммарный эффект открытия Са2+ каналов выражается в установлении потока Са2+ в клетку, который приводит к сдвигу отрицательного потенциала покоя Еm, к +129 мВ. [Са2+-каналы открываются при более положительном значении потенциала действия, чем натриевые каналы. Это означает, что они открываются на более поздней фазе потенциала действия. Для ионов Cl_ по уравнению Нернста получаем
Если [Cl-]0 = 123 мМ и [Cl-]i= 4,2 мМ, то мембранный потенциал только для Cl- составляет Еm = -90 мВ. Таким образом, суммарный эффект открытия хлоридного канала приводит к выходу ионов Cl-, что стабилизирует отрицательное значение потенциала покоя Еm.

Значения равновесных потенциалов рассчитаны для 37 °С, принимая величину потенциала покоя мембраны мышечной клетки равной -90 мВ.
Сверху обозначены относительные радиусы негидратированных ионов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Электродный потенциал. Уравнение Нернста.
Учение об электродвижущих силах гальванических элементов является одним из основных разделов электрохимии. Начало изучению электродвижущих сил было положено еще М. В. Ломоносовым (1750), который в своих работах отмечал связь между химическими и электрическими явлениями. Позднее наблюдения итальянского физиолога Гальвани (1780) и обширные работы итальянского физика Вольта (1780) привели к открытию гальванических элементов.
В 1800 г. Вольта изобрел первый химический источник тока, так называемый вольтов столб, который был собран из пластинок различных металлов, разделенных прослойками ткани, смоченной электролитом. Исследования привели Вольта к открытию контактной разности потенциалов, возникающей при соприкосновении металлов различной природы. В первых исследованиях в качестве чувствительного прибора для обнаружения малой разности потенциалов ученый использовал свежеанатомированные мышцы лягушки. Этот случай является наглядным примером того, как биологические методы исследования нередко могут способствовать успешному развитию физики и других точных наук.
Открытие химических источников тока и контактной разности потенциалов оказало большое влияние на все последующее развитие электрохимических явлений. В настоящее время методы электрохимии получили широкое распространение в агрохимии, физиологии растений, в биологии, почвоведении, а также во многих других смежных дисциплинах.
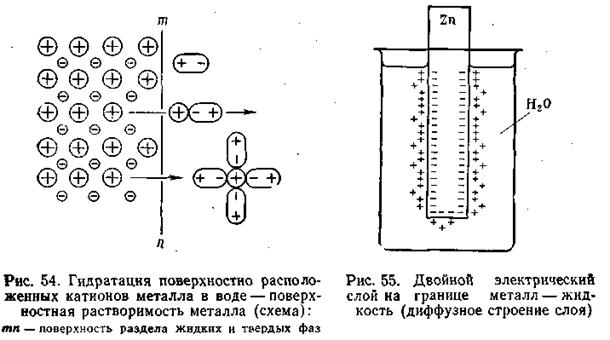
Если в чистую воду погрузить пластинку какого-либо металла, то согласно гидратной теории Д. И. Менделеева ионы металла будут взаимодействовать с полярными молекулами воды. Иными словами, поверхностно расположенные катионы этого металла будут гидратироваться молекулами воды и переходить в окружающий раствор, заряжая его положительно, т. е. металл будет как бы растворяться (рис.4.8).
Однако электроны, в избытке остающиеся в металле, заряжают его поверхностный слой отрицательно. В результате этого между ионами металла, перешедшими в раствор, и поверхностью металлической пластинки возникают силы электростатического притяжения, в силу чего ионы, окружающие пластинку, образуют так называемый двойной электрический слой, схема которого приведена на рис. 4.8. Этот слой препятствует дальнейшему растворению металла и в системе устанавливается подвижное равновесие, которое характеризуется равными скоростями как растворения, так и обратного осаждения ионов из раствора на поверхности металлической пластинки.
Первоначально считали, что двойной электрический слой имеет плоское строение. Он уподоблялся конденсатору, одна из обкладок которого расположена на поверхности металла, другая — в слое прилегающей к электроду жидкости. Расстояние между обкладками равно диаметру молекулы.
Согласно этой теории, которую обычно связывают с именем Гельмгольца (1879), учитывалось только проявление электростатических сил взаимодействия между зарядами противоположного знака и не учитывалось изменение свойств двойного электрического слоя с изменением концентрации электролита и его температуры, что явилось основным недостатком теории Гельмгольца.
В разработке современной теории строения двойного электрического слоя на границе твердая фаза—жидкость и методов его исследования ведущая роль принадлежит А. Н. Фрумкину и его школе. Работы А. Н. Фрумкина и его учеников установили, что слой ионов, располагающийся в жидкости, благодаря действию двух противоположно направленных сил (электростатического притяжения и теплового движения) имеет диффузное строение, т. е. он проникает в жидкость на некоторую глубину (рис. 4.8).
|
|
Определенная часть ионов удерживается вблизи поверхности раздела металл—электролит, образуя обкладку двойного слоя с толщиной, отвечающей среднему радиусу ионов электролита. Остальные ионы, входящие в состав двойного слоя, распределяются диффузно, с постепенно убывающей плотностью заряда.
Таким образом, при соприкосновении металла с водой ионы его находятся под действием двух конкурирующих сил: электростатического притяжения, возникающего между ионами металла и молекулами воды (явление гидратации), и электростатического притяжения со стороны электронного газа, определяющего прочность кристаллической решетки.
Вполне понятно, что чем прочнее кристаллическая решетка металла, тем труднее иону металла перейти в раствор. Чем выше величина энергии гидратации, тем с большей жадностью молекулы воды взаимодействуют с этими ионами, и тем легче им выделиться в раствор.
В результате взаимодействия двух указанных взаимно противоположных сил растворение металла в воде приобретает характер только поверхностного процесса и охватывает лишь очень узкую область на границе металл—жидкость. В этом поверхностном слое концентрация ионов металла, несмотря на его чрезвычайно малую растворимость, может быть довольно значительной. Кроме того, в поверхностном растворе гидратированные катионы в силу электростатических сил притяжения со стороны электронов кристаллической решетки металла совершают лишь ограниченное кинетическое движение в виде так называемых «пристенных» скачков. Они прочно связаны с жестким каркасом кристаллической решетки металла.
Таким образом, в системе металл — вода на границе раздела фаз возникает двойной электрический слой, блокирующий поверхность металла. Образовавшаяся пограничная разность потенциалов получила название электродного потенциала (дат. potentia — возможность, мощь).
Если жидкая среда — чистая вода, для всех металлов картина в качественном отношении будет однозначной: металл заряжается отрицательно, прилегающий слой жидкости — положительно. Однако количественно для разных металлов будут наблюдаться существенные различия, что объясняется не только неодинаковой энергией связи катионов этих металлов в кристаллической решетке, но и неодинаковой гидратируемостью этих катионов.
Несколько иная картина наблюдается в случае, если металлическую пластинку погрузить не в чистую воду, а в раствор соли этого металла. При этом могут иметь место три случая.
1. Исходная концентрация ионов данного металла в растворе С меньше концентрации Со, соответствующей равновесному состоянию ионов после погружения в раствор металлической пластинки, т. е. С С0. В этом случае наблюдается обратное явление: ионы металла из раствора выделяются на поверхности металлической пластинки. Чтобы ионы металла могли выделиться, они должны присоединить электроны согласно уравнению (б). Поскольку источника электронов в системе нет, выделение металла на поверхности пластинки происходит в виде ионов. В результате поверхность приобретает положительный заряд.
3. При условии С=С0 вся система будет находиться в состоянии подвижного равновесия, разность потенциалов между жидкостью и металлом равна нулю. В этом случае из раствора осаждается на единицу поверхности металла столько же катионов, сколько их выходит в двойной электрический слой.
Принимая это во внимание, нетрудно найти математическую зависимость между величиной скачка потенциала на границе соприкосновения металла и раствора и концентрацией (точнее, активностью) ионов этого металла в растворе.
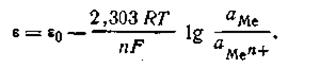 | 4.84 |
Так как активность металла принимается равной единице (аMе= 1), то с учетом этого уравнения (4.84) будет иметь следующее выражение:
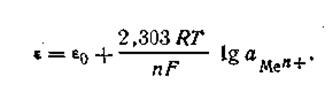 | 4.85 |
Уравнение (4.85) называется уравнением Нернста,
ε0— постоянная величина, характеризующая электрохимическую природу электрода.
Для расчетов удобнее предварительно вычислить значение R·T· 2,303/F при какой-либо температуре. Например, при 291 К это число будет равно 0,0577. Следовательно, для температуры 291 К уравнение Нернста будет иметь вид:
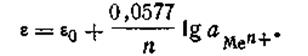 | 4.86 |
Обозначим численное значение выражения R·T·2,303/F буквой Ж.
Зависимость этого числа от температуры выразится следующей формулой:
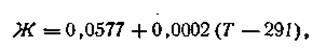 | 4.87 |
где Г —любая температура, при которой производится измерение разности потенциалов. С учетом этого обозначения уравнение электродного потенциала Нернста будет иметь следующий вид:
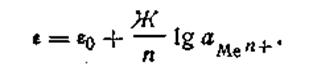 | 4.88 |

обращается в нуль, и тогда
 | 4.89 |
Таким образом, стандартным (нормальным) потенциалом называется такой потенциал, который возникает на металлической пластинке, находящейся в контакте с одноименными ионами в растворе, с концентрацией С=1 моль/л.
За нулевую точку измерения потенциалов условно принят нормальный потенциал водородного электрода. Для изготовления его используют способность платины растворять газообразный водород. Платиновая проволока или пластинка, содержащая растворенный водород, играет роль «водородной пластинки», а функции «раствора солей» может выполнять любой водный раствор, в котором всегда присутствуют ионы водорода Н + . Причем нормальный потенциал водородного электрода равен нулю при условии, что давление молекулярного водорода на пластинке равно 101,325 кПа и СН+ = 1 моль/л.
Если нормальный потенциал какого-либо металла больше водородного, его принято считать положительным, если меньше — отрицательном.
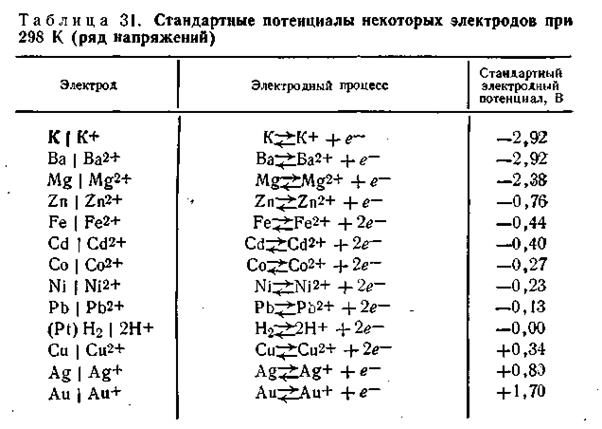
Если все металлы расположить последовательно по возрастающей величине их нормальных электродных потенциалов, получится ряд напряжений. В табл. 4.9 приведены стандартные потенциалы некоторых металлов.
В этой таблице каждый электрод обозначен символом элемента, из которого он состоит, и соответствующего иона, а вертикальная линейка изображает поверхность раздела двух фаз, где имеет место скачок потенциала.
Представленным в табл. 4.9 рядом напряжений широко пользуются в практике при составлении так называемых гальванических элементов, а также при изучении взаимодействия между металлами и кислотами, между солями и металлами. Зная ряд напряжений, можно предвидеть направление реакции вытеснения одних элементов другими. Так металлы, стоящие в ряду напряжений после водорода, не способны вытеснять водород из кислот. Вытеснение металла из солей другим металлом осуществляется только в том случае, если вытесняющий металл расположен в ряду напряжений до вытесняемого.
Например, при составлении гальванического элемента из цинка и свинца в качестве положительного электрода следует взять свинцовый (εо= -0,13 В), а в качестве отрицательного — цинковый (εо= -0,76 В).
|
Электроды подразделяются на электроды первого и второго рода. Электроды первого рода — это электроды из металла, погруженного в раствор, содержащий ионы того же металла (например, Cu|Cu 2+ , Zn|Zn 2+ ). Эти электроды обратимо обменивают катионы Ме↔Ме n + nе, где n — число теряемых (или приобретаемых) электронов (е — ).
Электроды второго рода состоят из металла, покрытого слоем труднорастворимой соли и погруженного в раствор какой-либо легкорастворимой соли с тем же анионом. Такие электроды обратимы относительно этого аниона.
Для электродов второго рода выражение электродного потенциала
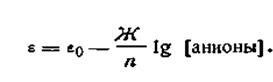 | 4.90 |
Дата добавления: 2016-02-20 ; просмотров: 2555 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://meduniver.com/Medical/genetika/uravnenie_nernsta.html
http://helpiks.org/7-14677.html