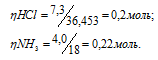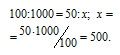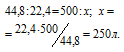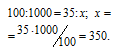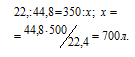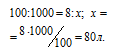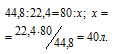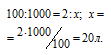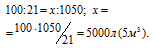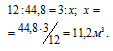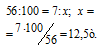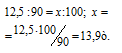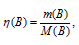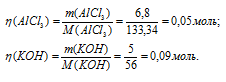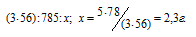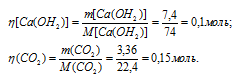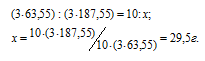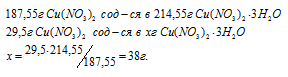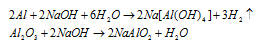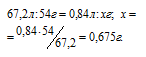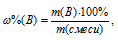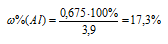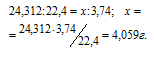Согласно уравнению реакции : 2CO + O2 = 2CO2 + 566 кДж при сжигании оксида углерода (II) (CO) выделилось 152 кДж?
Химия | 10 — 11 классы
Согласно уравнению реакции : 2CO + O2 = 2CO2 + 566 кДж при сжигании оксида углерода (II) (CO) выделилось 152 кДж.
Найдите массу сгоревшего газа CO.
При горении 2 — х моль угарного газа выделилось 566кдж , а при горении х моль — 152 кДж т.
О. х = 2 * 152 / 566 = 0, 537 моль
m = n * M ; М(СО) = 28 г / моль ; m = 15.
При сжигании цинка массой 3, 27 г выделилось 174 кДж?
При сжигании цинка массой 3, 27 г выделилось 174 кДж.
Составь термохимическое уравнение реакции.
1. Согласно термохимическому уравнению реакции CH4(г?
1. Согласно термохимическому уравнению реакции CH4(г.
) + 802 кДж количество теплоты, выделившейся при сжигании 10 моль метана CH4, равно а)80.
2 кДж b)1604 кДж с)8020 кДж d)601.
Вычислите массу (в г) угля, если при его сгорании выделилось 50250 кДж тепла?
Вычислите массу (в г) угля, если при его сгорании выделилось 50250 кДж тепла.
Тепловой эффект реакции горения углерода 402 кДж.
Дано термохимическое уравнение : 2CO + O2 = 2CO2 + 565 кДжВ результате реакции выделилось 226 кДж теплоты?
Дано термохимическое уравнение : 2CO + O2 = 2CO2 + 565 кДж
В результате реакции выделилось 226 кДж теплоты.
Сколько граммов оксида углерода(2) вступило в реакцию?
По уравнению реакции C + O2 — >CO2 + 402 кдж вычеслити какой обьем кислорода израсходовался на сгорание углерода если при этом выделилось 2010 кдж теплоты?
По уравнению реакции C + O2 — >CO2 + 402 кдж вычеслити какой обьем кислорода израсходовался на сгорание углерода если при этом выделилось 2010 кдж теплоты.
При сжигании 15г кальция до оксида кальция выделилось 238, 5 кДж энергии?
При сжигании 15г кальция до оксида кальция выделилось 238, 5 кДж энергии.
Составьте термохимическое уравнение этой реакции.
При сжигании 15г кальция до оксида кальция выделилось 238, 5 кДж энергии?
При сжигании 15г кальция до оксида кальция выделилось 238, 5 кДж энергии.
Составьте термохимическое уравнение этой реакции.
По термохимическому уравнению реакции горения метана CH4(г) + 2O2(г) = CO(г) + 2H2O(г) + 890 кДж вычислите массу сгоревшего метана если известно что при его сгорании выделилось 178 кДж теплоты?
По термохимическому уравнению реакции горения метана CH4(г) + 2O2(г) = CO(г) + 2H2O(г) + 890 кДж вычислите массу сгоревшего метана если известно что при его сгорании выделилось 178 кДж теплоты.
По термохимическому уравнению реакции горения циклогексанаС6Н12 + 9О2 → 6СО2 + 6Н2О + 3924 кДж определите массу сгоревшего циклогексана (г), если при этом выделилось 9100 кДж теплоты?
По термохимическому уравнению реакции горения циклогексана
С6Н12 + 9О2 → 6СО2 + 6Н2О + 3924 кДж определите массу сгоревшего циклогексана (г), если при этом выделилось 9100 кДж теплоты.
60 балловПриведено термохимическое уравнение реакции :CH4 + 2O2 = CO2 + 2H2O + 892 кДжВычислите :а) массу сгоревшего метана и б) объем (н?
Приведено термохимическое уравнение реакции :
CH4 + 2O2 = CO2 + 2H2O + 892 кДж
а) массу сгоревшего метана и б) объем (н.
У. ) полученного оксида углерода (3 валентен), если при этом выделилось 446 кДж теплоты.
На этой странице находится ответ на вопрос Согласно уравнению реакции : 2CO + O2 = 2CO2 + 566 кДж при сжигании оксида углерода (II) (CO) выделилось 152 кДж?, из категории Химия, соответствующий программе для 10 — 11 классов. Чтобы посмотреть другие ответы воспользуйтесь «умным поиском»: с помощью ключевых слов подберите похожие вопросы и ответы в категории Химия. Ответ, полностью соответствующий критериям вашего поиска, можно найти с помощью простого интерфейса: нажмите кнопку вверху страницы и сформулируйте вопрос иначе. Обратите внимание на варианты ответов других пользователей, которые можно не только просмотреть, но и прокомментировать.
Кислород находится во 2 периоде, VI группе A — подгруппе. Атомный номер — 8 — из этого следует, что у него 8 протонов, 8 электронов и 8 нейтронов. У кислорода 2 электронные оболочки. Электронная формула 1s²2s²2p⁴ Сера находится в 3 — ем периоде, 6..
При попадании перекиси водорода — Н2О2 — на любой белковый материал идет сильная реакция окисления белка атомом кислорода, выделяется тепло, слышно шипение пузырьков — выделение молекулярного кислорода, всё, что соприкасается с перекисью, все микробы..
Ответ : 2) CO + Fe2O3 = 2FeO + CO2.
Cu2 + 1s22s22p63s2 3p64s0 3d9 S2 — 1s22s22p63s2 3p6 Sr2 + 1s22s22p63s2 3p64s2 3d10 4p6.
Дано m(CuCL2) = 100 g — — — — — — — — — — — — — — — — — — — m(Cu) — ? 100 X CuCL2 + Zn — — >ZnCL2 + Cu M(CuCL2) = 135 g / mol , M(Cu) = 64 g / mol 135 64 X = 100 * 64 / 135 = 47. 4 g ответ 47. 4 г.
Менделеев Дмитрий Иванович.
Менделеев, Дмитрий Иванович.
SO3 CRO3 SEO3 MOO3 TEO3 WO3 PO3 SGO3.
SO3 + K2O = K2SO4 Основные оксиды реагируют с кислотными.
Расчёты, связанные с протеканием химических реакций
Задача 121.
Смешано 7,3г НСI с 4,0г NH3. Сколько граммов NH4С1 образуется? Найти массу оставшегося после реакции газа.
Решение:
Уравнение реакции имеет вид:
Молекулярные массы HCl, NH3 и NH4Cl соответственно равны 36,453, 17 и 53,453. Следовательно, их мольные массы составляют 36,453; 17; 53,453г/моль. Согласно уравнению реакции 1 моль HCl реагирует с 1 моль NH3, образуя 1 моль NH4Cl. Находим, какое вещество взято в недостатке:
В недостатке взято 0,2 моля HCl, значит, расчёт массы, образовавшейся соли NH4Cl, производим по количеству соляной кислоты:
m(NH4Cl) = 0,2 . 53,453 = 10,69г.
Затем рассчитаем массу NH3, вступившего в реакцию с HCl:
Ответ: 10,69г NH4Cl; 3,4г NH3.
Задача 122.
Какой объем воздуха потребуется для сжигания 1м 3 газа, имеющего следующий состав по объему: 50% Н2, 35% СН4, 8% СО, 2% С2Н4 и 5% негорючих примесей. Объемное содержание кислорода в воздухе равно 21%.
Решение:
Рассчитаем объём кислорода, необходимый для сжигания газов.
а) Уравнение реакции сгорания водорода:
Находим объём водорода, содержащегося в 1 м 3 газа из пропорции:
Согласно уравнению реакции на сжигание 2 молей Н2 расходуется 1 моль О2 т. е. на сжигание 44,8 л водорода требуется 22,4 л кислорода.
Находим объём расходуемого кислорода из пропорции:
б) Уравнение реакции сгорания метана:
СН4 + О2 = СО2 + 2Н2О
Находим объём метана, содержащегося в 1 м 3 газа из пропорции:
Согласно уравнению реакции на сжигание 1 моль СН4 расходуется 2 моля О2 т. е. на сжигание 22,4 л метана требуется 44,8л кислорода.
Находим объём расходуемого кислорода из пропорции:
в) Уравнение реакции горения угарного газа:
Находим объём угарного газа, содержащегося в 1м 3 газа из пропорции:
Согласно уравнению реакции на сжигание 2 молей СО расходуется 1 моль О2 т. е. на сжигание 44,8 л угарного газа требуется 22,4 л кислорода.
Находим объём расходуемого кислорода из пропорции:
г) Уравнение реакции горения этилена:
Согласно уравнению реакции на сжигание 1 моль С2Н4 расходуется 3 моль О2, т.е. затрачивается в три раз больший объём кислорода, чем этилена.
Находим содержание этилена в 1 м 3 газа из пропорции:
Кислорода для сжигания этилена требуется в три раза больше по объёму, чем этилена, а именно 60 л (20 . 3 = 60).
Теперь находим общий объём кислорода, затраченный на сжигание 1 м 3 газа:
V(O2) = 250 + 700 + 40 + 60 = 1050 л.
Рассчитаем объём воздуха, содержащий 1050 л кислорода из пропорции
Ответ: 5 м 3
Задача 123.
При пропускании водяного пара над раскаленным углем получается водяной газ, состоящий из равных объемов СО и Н2. Какой объем водяного газа (условия нормальные) может быть получен из 3,0 кг угля?
Решение:
Уравнение протекающей реакции:
Согласно уравнению реакции из одного моля угля и одного моля воды образуется «водяной газ», состоящий из одного моля угарного газа и одного моля водорода. Мольная масса углерода равна 12 кг/кмоль; 1 кмолоь «водяного газа» занимает объём 44,8 м 3 .
Рассчитаем объём водяного газа, образуемого из 3 кг угля из пропорции:
Ответ: 11,2м 3 .
Задача 124.
Карбонат кальция разлагается при нагревании на СаО и СО2. Какая масса природного известняка, содержащего 90% (масс.) СаСО3, потребуется для получения 7,0т негашеной извести?
Решение:
Уравнение протекающей реакции:
СаСO3 
Молекулярные массы СаСО3 и СаО соответственно равны 100 и 56, следовательно, их мольные массы составляют 100 и 56 г/моль. Согласно уравнению реакции 1 моль СаСО3 образует 1 моль СаО. Находим теоретический выход негашёной извести из пропорции:
Находим массу природного известняка из пропорции:
Ответ: 13,9т.
Задача 125.
К раствору, содержащему 6,8г АIСl3, прилили раствор, содержащий 5,0г КОН. Найти массу образовавшегося осадка.
Решение:
Уравнение протекающей реакции:
Мольные массы АlCl3, KOH и Al(OH)3 соответственно равны 133,34; 56 и 78 г/моль. Рассчитаем количество реагирующих веществ по формуле:
Где n — количество вещества, моль; m(B) – масса вещества, г; M(B) – мольная масса, г/моль.
Отсюда
Согласно уравнению реакции 1 моль AlCl3 реагирует с 3 моль КОН с образованием 1 моль Al(OH)3, т.е. КОН должно 0,15 моль (0,05 . 3 = 0,15), чем взято по условию задачи (0,09 моль). Таким образом, КОН взят в недостатке, поэтому расчёт массы Al(OH)3 проводим по КОН, получим:
Ответ: 2,3г
Задача 126.
Через раствор, содержащий 7,4г гидроксида кальция, пропустили 3,36л диоксида углерода, взятого при нормальных условиях. Найти массу вещества, образовавшегося в результате реакции.
Решение:
Уравнение реакции имеет вид:
Молекулярные массы Са(ОН)2 и СаСО3 соответственно равны 74 и 100, следовательно, их мольные массы составляют 74 и 100г/моль. Согласно уравнению реакции из 1 моль Са(ОН)2 и 1 моль СО2 образуется 1 моль СаСО3. Рассчитаем количество реагирующих веществ по формуле
Следовательно, СО2 взят в избытке и поэтому расчёт массы образовавшегося СаСО3 будем проводить по Са(ОН)2.
m(CaCO3) = n(CaCO3) . M(CaCO3) = 0,1 . 100 = 10 г.
Ответ: 10 г.
Задача 127.
Рассчитать массу кристаллогидрата Cu(NO3) . 3Н2O, полученного растворением 10 г меди в азотной кислоте и последующим выпариванием раствора.
Решение:
Уравнение протекающей реакции:
Мольные массы Cu и Cu(NO3)2 соответственно равны 63,55 и 187,55 г/моль. Согласно уравнению реакции из 3 моль Cu образуется 3 моль Cu(NO3)2. Рассчитаем массу Cu(NO3)2, образующуюся при растворении 10 г меди в азотной кислоте:
Находим мольную массу кристаллогидрата нитрата меди:
M[(Cu(NO3)2) . 3H2O] = 187,55 + (3 . 18) = 214,55г/моль.
Рассчитаем массу образовавшегося кристаллогидрата меди:
Ответ: 38г
Задача 128.
При обработке раствором гидроксида натрия 3,90г смеси алюминия с его оксидом выделялось 840 мл газа, измеренного при нормальных условиях. Определить процентный состав (по массе) исходной смеси.
Решение:
Уравнения протекающих реакций:
Следовательно, водород образуется при растворении алюминия в растворе щёлочи Согласно уравнению реакции из 2 моль Al (2 . 27 = 54 г) образуется 3 моль Н2 или 67,2л (3 . 22,4 = 67,2). Рассчитаем массу алюминия в смеси из пропорции:
Теперь находим процентное содержание алюминия в смеси по формуле:
Где
Ответ: 17,3%.
Задача 129.
5,10 г порошка частично окисленного магния обработали соляной кислотой. При этом выделилось 3,74л Н2, измеренного при нормальных условиях. Сколько процентов магния (по массе) содержалось в образце?
Решение:
Уравнение протекающей реакции:
Мольная масса Mg равна 24,312 г/моль, мольный объём газа равен 22,4 л/моль. Согласно уравнению реакции 1 моль магния выделяет 1 моль водорода. Рассчитаем массу магния, которая растворилась в кислоте из пропорции:
Процентный состав магния в образце определяем из пропорции:
химия. помогите пожалуйста!
1.исходные концентрации N2 и H2 равны соответственно 5 и 6 моль/дм3. найдите их равновесные концентрации, если равновесная концентрация аммиака равна 3 моль/дм3.
2.уголь какой массы, с массовой долей углерода 96%, надо сжечь, чтобы получить 5700кДж теплоты, если известно, что при сгорании 1 моль углерода выделяется 396 кДж теплоты?
3.определите среднюю скорость химической реакции, протекающей согласно уравнению CO2 + H2=CO + H2O, если через 80с после начала реакции концентрация воды была 0,24 моль/дм3, а через 2 мин 07с — 0,28 моль/дм3.
4.даны термохимические уравнения реакцией горения угля и разложения известняка: C (т) + O2 (г) =CO2 (г) + 412кДж ; CaCO3 (т) =CaO (т) + CO2 (г) — 180кДж. какую минимальную массу угля надо сжечь для получения 112 кг негашеной извести?
5.смесь меди и цинка массой 40г обработали конц раствором щелочи. при этом выделился газ объемом 8,96 дм3 (н. у). рассчитайте массовую долю меди в смеси.
6.FE3O4->FE->FECL3->FE(OH)3->FE2O3->FE2(SO4)3
CA->CAO->CA(OH)2->CACL2->CACO3
СПАСИБО. !
http://buzani.ru/zadachi/khimiya-glinka/1089-raschjoty-po-khimicheskim-uravneniyam-zadachi-121-129
http://sprashivalka.com/tqa/q/20878092