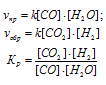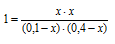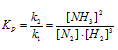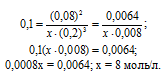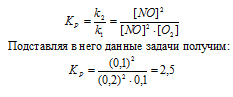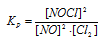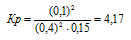Согласно термохимическому уравнению реакции 2СО(г) + О2(г) = 2СО2(г) + 566 кДж при сжигании оксида углерода (II) выделилось 424,5
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,292
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,160
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Согласно уравнению реакции : 2CO + O2 = 2CO2 + 566 кДж при сжигании оксида углерода (II) (CO) выделилось 152 кДж?
Химия | 10 — 11 классы
Согласно уравнению реакции : 2CO + O2 = 2CO2 + 566 кДж при сжигании оксида углерода (II) (CO) выделилось 152 кДж.
Найдите массу сгоревшего газа CO.
При горении 2 — х моль угарного газа выделилось 566кдж , а при горении х моль — 152 кДж т.
О. х = 2 * 152 / 566 = 0, 537 моль
m = n * M ; М(СО) = 28 г / моль ; m = 15.
При сжигании цинка массой 3, 27 г выделилось 174 кДж?
При сжигании цинка массой 3, 27 г выделилось 174 кДж.
Составь термохимическое уравнение реакции.
1. Согласно термохимическому уравнению реакции CH4(г?
1. Согласно термохимическому уравнению реакции CH4(г.
) + 802 кДж количество теплоты, выделившейся при сжигании 10 моль метана CH4, равно а)80.
2 кДж b)1604 кДж с)8020 кДж d)601.
Вычислите массу (в г) угля, если при его сгорании выделилось 50250 кДж тепла?
Вычислите массу (в г) угля, если при его сгорании выделилось 50250 кДж тепла.
Тепловой эффект реакции горения углерода 402 кДж.
Дано термохимическое уравнение : 2CO + O2 = 2CO2 + 565 кДжВ результате реакции выделилось 226 кДж теплоты?
Дано термохимическое уравнение : 2CO + O2 = 2CO2 + 565 кДж
В результате реакции выделилось 226 кДж теплоты.
Сколько граммов оксида углерода(2) вступило в реакцию?
По уравнению реакции C + O2 — >CO2 + 402 кдж вычеслити какой обьем кислорода израсходовался на сгорание углерода если при этом выделилось 2010 кдж теплоты?
По уравнению реакции C + O2 — >CO2 + 402 кдж вычеслити какой обьем кислорода израсходовался на сгорание углерода если при этом выделилось 2010 кдж теплоты.
При сжигании 15г кальция до оксида кальция выделилось 238, 5 кДж энергии?
При сжигании 15г кальция до оксида кальция выделилось 238, 5 кДж энергии.
Составьте термохимическое уравнение этой реакции.
При сжигании 15г кальция до оксида кальция выделилось 238, 5 кДж энергии?
При сжигании 15г кальция до оксида кальция выделилось 238, 5 кДж энергии.
Составьте термохимическое уравнение этой реакции.
По термохимическому уравнению реакции горения метана CH4(г) + 2O2(г) = CO(г) + 2H2O(г) + 890 кДж вычислите массу сгоревшего метана если известно что при его сгорании выделилось 178 кДж теплоты?
По термохимическому уравнению реакции горения метана CH4(г) + 2O2(г) = CO(г) + 2H2O(г) + 890 кДж вычислите массу сгоревшего метана если известно что при его сгорании выделилось 178 кДж теплоты.
По термохимическому уравнению реакции горения циклогексанаС6Н12 + 9О2 → 6СО2 + 6Н2О + 3924 кДж определите массу сгоревшего циклогексана (г), если при этом выделилось 9100 кДж теплоты?
По термохимическому уравнению реакции горения циклогексана
С6Н12 + 9О2 → 6СО2 + 6Н2О + 3924 кДж определите массу сгоревшего циклогексана (г), если при этом выделилось 9100 кДж теплоты.
60 балловПриведено термохимическое уравнение реакции :CH4 + 2O2 = CO2 + 2H2O + 892 кДжВычислите :а) массу сгоревшего метана и б) объем (н?
Приведено термохимическое уравнение реакции :
CH4 + 2O2 = CO2 + 2H2O + 892 кДж
а) массу сгоревшего метана и б) объем (н.
У. ) полученного оксида углерода (3 валентен), если при этом выделилось 446 кДж теплоты.
На этой странице находится ответ на вопрос Согласно уравнению реакции : 2CO + O2 = 2CO2 + 566 кДж при сжигании оксида углерода (II) (CO) выделилось 152 кДж?, из категории Химия, соответствующий программе для 10 — 11 классов. Чтобы посмотреть другие ответы воспользуйтесь «умным поиском»: с помощью ключевых слов подберите похожие вопросы и ответы в категории Химия. Ответ, полностью соответствующий критериям вашего поиска, можно найти с помощью простого интерфейса: нажмите кнопку вверху страницы и сформулируйте вопрос иначе. Обратите внимание на варианты ответов других пользователей, которые можно не только просмотреть, но и прокомментировать.
Прозрачный, бесцветеный, при охлаждении сжимается, при нагревании расширяется, и забыла бесвкусный.
Вот! Да здравствует Логика.
Li 2e 1e Na 2e 8e 1e P 2e 8e 5e Fe 2e 8e 8e 8e.
2, 3 — дибромбутан H³С — СНBr — CHBr — CH³ 3 — етил — 2, 3, 5 — триметилоктан. H³C — CН(CH3) — C(СН3)(C2H5) — CН2 — CН(СН3) — CH2 — CH2 — CH³.
Формулы есть на фото.
Количество вещества n = m / M молярные массы веществ M(N₂) = 2 * 14, 0 = 28, 0 г / моль M(CO₂) = 12, 0 + 2 * 16, 0 = 44, 0 г / моль M(Na) = 23, 0 г / моль количества веществ n(N₂) = 100 / 28, 0 = 3, 6 моль n(CO₂) = 100 / 44, 0 = 2, 3 моль n(Na) = 100..
Формула для нахождения количества вещества n = m / M Дано : m(N2) = 100 r n(N2) — ? M(N2) = 28 г / моль n(N2) = 100 г / 28 г / моль = 3, 6 моль Дано : m(CO2) = 100 r n(CO2) — ? M(CO2) = 44 г / моль n(CO2) = 100 г / 44 г / моль = 2, 3 моль Дано : m(..
3LiOH + AlCl3 = Al(OH)3 (осадок) + 3LiCl n(LiOH) = m / M = 100 / 24 = 4, 16 моль n(Al(OH)3) = 1 / 3 n(LiOH) по уравнению реакции n(Al(OH)3) = 4, 17 : 3 = 1, 4 моль(с округлением) m(Al(OH)3) = n(Al(OH)3) * M(Al(OH)3) = 1, 4 * 78 = 109, 2 гр Ответ : m(..
1подвижностисвободных электронов. 2 ионная, молекулярная, атомная 3 -.
C3H8 + 5O2 = 3CO2 + 4H2O n(CO2) = V / Vm = 1, 12 л / 22, 4 л / моль = 0, 05 моль m(СО2) = n * M = 0, 05 моль * 44 г / моль = 2, 2 г m(КОН)(р — р) = V * p = 50 мл * 1, 12 г / мл = 56 г m(KOH) = m(p — pa) * w = 56г * 0. 12 = 6, 72 г n(KOH) = m / M = 6..
Вычисление константы равновесия системы
Константа равновесия для гомогенной реакции
Задание 135.
Вычислите константу равновесия для гомогенной системы:
СО (г) + Н2О (г) ↔ СО2 (г) + Н2 (г)
если равновесные концентрации реагирующих веществ (молы/л):
[СО]р = 0,004; [Н2О]р = 0,064; [СО2]р = 0,016; [Н2]р = 0,016,
Чему равны исходные концентрации воды и СО? Ответ: Кр = 1; [H2O]исх = 0,08 моль/л; [СО]исх =0, 02 моль/л.
Решение:
Уравнение реакции имеет вид:
Kp = [CO2] . [H2]/ [CO] . [H2O]
Подставляя в выражение данные задачи получим:
Кр = (0,016 . 0,016)/(0,004 . 0,064) = 1.
Для нахождения исходных концентраций веществ Н2О и СО учтём, что согласно уравнению реакции из 1 моль СО и 1 моль Н2О образуется 1 моль СО2 и 1 моль Н2. Поскольку по условию задачи в каждом литре системы образовалось 0,016 моль СО2 и 0,016 моль Н2, то при этом было израсходовано по 0,016 моль СО и Н2О. Таким образом, искомые исходные концентрации равны:
Ответ: Кp = 1; [H2O]исх = 0,08 моль/л; [СО]исх =0, 02 моль/л.
Задание 136.
Константа равновесия гомогенной системы:
СО (г) + Н2О (г) ⇔ СО2 (г) + Н2 (г)
при некоторой температуре равна 1,00. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации равны (молы/л): [СО]исх = 0,10; [Н2О]исх = 0,40.
Ответ: [СО2]Р = [Н2]Р = 0,08; [СO]P= 0,02; [Н2O]P = 0,32.
Решение:
Уравнение реакции имеет вид:
При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
Обозначаем за «х» моль/л равновесную концентрацию одного из продуктов реакции, тогда равновесная концентрация другого будет также х моль/л так как они оба образуются в одинаковом количестве. Равновесные концентрации исходных веществ будут:
[СО]исх = 0,10 – х моль/л; [Н2О]исх = 0,40 — х моль/л. (так как на образование х моль/л продукта реакции расходуется соответственно по х моль/л СО и Н2О. В момент равновесия концентрация всех веществ будет (моль/л): [СО2]Р = [Н2]Р = х; [СO]P= 0,10 — х; [Н2O]P = 0,4 – х.
Подставляем эти значения в выражение константы равновесия:
Решая уравнение, находим х = 0,08. Отсюда равновесные концентрации (моль/л):
Задание 137.
Константа равновесия гомогенной системы N2 + ЗН2 = 2NH3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрации азота. Ответ: [N2]P = 8 молы/л; [N2]исх = 8,04 моль/л.
Решение:
Уравнение реакции имеет вид:
Обозначим равновесную концентрацию N2 через х моль/л. Выражение константы равновесия данной реакции имеет вид:
Подставим в выражение константы равновесия данные задачи и найдём концентрацию N2
Для нахождения исходной концентрации N2, учтём, что, согласно уравнению реакции на образование 1 моль NH3 затрачивается ½ моль N2. Поскольку по условию задачи в каждом литре системы образовалось 0,08 моль NH3, то при этом было израсходовано 0,08 . 1/2 = 0,04 моль N2. Таким образом, искомая исходная концентрация N2 равна:
Задание 138.
При некоторой температуре равновесие гомогенной системы
2NО + O2 ↔ 2NO2 установилось при следующих концентрациях реагирующих веществ (молы/л): [NО]p = 0,2; [О2]р = 0,1; [NO2]р = 0,1. Вычислите константу равновесия и исходную концентрацию NO и O2. Ответ: К = 2,5; [NО]исх = 0,3 молы/л; [О2]исх = 0,15 моль/л.
Решение:
Уравнение реакции:
Для нахождения исходных концентраций NO и O2 учтём, что согласно уравнению реакции, из 2 моль NO и 1 моль О2 образуется 2 моль NO2, то при этом было затрачено 0,1 моль NO и 0,05 моль О2. Таким образом, исходные концентрации NO и О2 равны:
Ответ: Кp = 2,5; [NО]исх = 0,3 молы/л; [О2]исх = 0,15 моль/л.
Смещение равновесия схимической системы
Задание 139.
Почему при изменении давления смещается равновесие системы:
N2 + 3Н2 ↔ 2NH3 и, не смещается равновесие системы N2 + O2 ↔ 2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакций в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
Решение:
а) Уравнение реакции:
Из уравнения реакции следует, что реакция протекает с уменьшением объёма в системе (из 4 моль газообразных веществ образуется 2 моль газообразного вещества). Поэтому при изменении давления в системе будут наблюдаться смещение равновесия. Если повысить давление в данной системе, то, согласно принципу Ле Шателье, равновесие сместится вправо, в сторону уменьшения объёма. При смещении равновесия в системе вправо скорость прямой реакции будет больше скорости обратной реакции:




Если же давление в системе уменьшить, то равновесие системы сместится влево, в сторону увеличения объёма, то при смещении равновесия влево скорость прямой реакции будет меньше, чем скорость прямой:

б) Уравнение реакции:
Из уравнения реакции следует, что при протекании реакции не сопровождается изменением объёма, реакция протекает без изменения числа молей газообразных веществ. Поэ му изменение давления в системе не приведёт к смещению равновесия, поэтому скорости прямой и обратной реакции будут равны:




Задание 140.
Исходные концентрации [NО]исх и [С12]исх в гомогенной системе
2NO + Сl2 ↔ 2NOС1 составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NО. Ответ: 0,417.
Решение:
Уравнение реакции имеет вид: 2NO + Сl2 ↔ 2NOС1
Согласно условию задачи в реакцию вступило 20% NO, что составляет 0,5 . 0,2 = 0,1 моль, а не прореагировало 0,5 – 0,1 = 0,4 моль NO. Из уравнения реакции следует, что на каждые 2 моль NO расходуется 1 моль Cl2, при этом образуется 2 моль NOCl. Следовательно, c 0,1 моль NO в реакцию вступило 0,05 моль Cl2 и образовалось 0,1 моль NOCl. Осталось не израсходованным 0,15 моль Cl2 (0,2 – 0,05 = 0,15). Таким образом, равновесные концентрации, участвующих веществ равны (моль/л):
Подставляя в данное выражение равновесные концентрации веществ, получим:
Ответ: Кр = 4,17.
http://himia.my-dict.ru/q/7910150_soglasno-uravneniu-reakcii-2co-o2-2co2/
http://buzani.ru/zadachi/khimiya-shimanovich/920-konstanty-ravnovesiya-zadacha-135-140