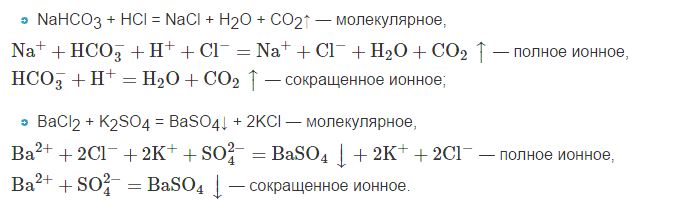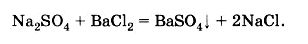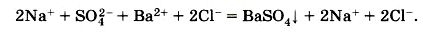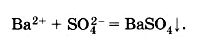Какое сокращенное ионное уравнение соответствует реакции между нитратом бария и серной кислотой? 1. Ba2+ + SO42- →BaSO4 2. H+ + OH- → HNO3
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,293
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,176
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Сокращенному ионному уравнению допишите молекулярное а) СО32 — + 2Н + →СО2 + Н2О б) Ва2 + + SО42 — → ВаSО4 в) S2 — + 2H + →H2S?
Химия | 5 — 9 классы
Сокращенному ионному уравнению допишите молекулярное а) СО32 — + 2Н + →СО2 + Н2О б) Ва2 + + SО42 — → ВаSО4 в) S2 — + 2H + →H2S.
А) Na2CO3 + 2HCl = 2NaCl + H2O + CO2
б) BaCl2 + H2SO4 = BaSO4 + 2HCl
в) Na2S + 2HCl = 2NaCl + H2S.
Составить по сокращенному ионному уравнению полное ионное и молекулярное?
Составить по сокращенному ионному уравнению полное ионное и молекулярное.
Напишите уравнения в молекулярном, полное ионное и сокращенное ионное уравнение гидролиза?
Напишите уравнения в молекулярном, полное ионное и сокращенное ионное уравнение гидролиза.
Составьте полное ионно — молекулярное и молекулярное уравнения реакции на основе сокращенного ионно — молекулярного уравнения?
Составьте полное ионно — молекулярное и молекулярное уравнения реакции на основе сокращенного ионно — молекулярного уравнения.
Zn(OH)2 + 2OH = Zn(OH)4.
Напишите молекулярные полные и сокращеные ионные уравнение?
Напишите молекулярные полные и сокращеные ионные уравнение.
Помогите написать молекулярное ионное и сокращенно ионное уравнение?
Помогите написать молекулярное ионное и сокращенно ионное уравнение.
Допишите схемы реакций и составьте уравнения реакций в молекулярной, ионной и сокращенные ионные уравнения реакций :А)Cu(OH)2 + HCI =Б)Fe2(SO4)3 + KOH =?
Допишите схемы реакций и составьте уравнения реакций в молекулярной, ионной и сокращенные ионные уравнения реакций :
Составьте молекулярное и полные ионно — молекулярные уравнения, которым соответствуют следующие сокращенные ионно — молекулярные уравнения :KOH , H2SO4?
Составьте молекулярное и полные ионно — молекулярные уравнения, которым соответствуют следующие сокращенные ионно — молекулярные уравнения :
Молекулярное уравнение, Полное ионное уравнение, Сокращенное ионное уравнениеа)H2SO4 + MgO =б)H2SO4 + NaOH =?
Молекулярное уравнение, Полное ионное уравнение, Сокращенное ионное уравнение
Нужно решить ионное уравнение и молекулярное с сокращеннымNa2Co3 + HCl?
Нужно решить ионное уравнение и молекулярное с сокращенным
Na2SO3 + KNO3допишите, составьте полные и сокращенные ионные уравнения реакций?
допишите, составьте полные и сокращенные ионные уравнения реакций.
На этой странице находится ответ на вопрос Сокращенному ионному уравнению допишите молекулярное а) СО32 — + 2Н + →СО2 + Н2О б) Ва2 + + SО42 — → ВаSО4 в) S2 — + 2H + →H2S?, из категории Химия, соответствующий программе для 5 — 9 классов. Чтобы посмотреть другие ответы воспользуйтесь «умным поиском»: с помощью ключевых слов подберите похожие вопросы и ответы в категории Химия. Ответ, полностью соответствующий критериям вашего поиска, можно найти с помощью простого интерфейса: нажмите кнопку вверху страницы и сформулируйте вопрос иначе. Обратите внимание на варианты ответов других пользователей, которые можно не только просмотреть, но и прокомментировать.
Дано : m(CaO) = 140 гнайти : n(CaO)решение : M(CaO) = 40 + 16 = 56 г \ мольn(CaO) = m \ M = 140 г \ 56 г \ моль = 2, 5 мольответ : 2, 5 моль.
1 — 1) 2Li + S = Li2S 2) 2Na + Br2 = 2NaBr 3) 4Al + 3Si = Al4Si3 4) 2Ca + O2 = 2CaO 5) 3Ba + N2 = Ba3N2 2 — 1) Ba + 2H2O = Ba(OH)2 + H2 2) Ba + 2HCl = BaCl2 + H2 3) Ba + PbCl2 = BaCl2 + Pb.
M = 244 (г) M(H2) = 2 * 1 = 2 (г / моль) n = m / M = 244 / 2 = 122 (моль) N = Na * n, где Na — число Авагадро = 6. 02 * 10 ^ 23 (молекул / моль) N = 6. 02 * 10 ^ 23 * 122 = 734. 44 * 10 ^ 23 (молекул).
Формула сахарозы (сахара) — C12H22O11. 25% = 0, 25 m(C12H22O11) = 300г * 0, 25 = 75г m(H2O) = 300г — 75г = 225г V(H2O) = 225г : 1г / см3 = 225 см3 1 см3 = 1мл 225 см3 = 225 мл.
Держи, первые 4 вопроса точно здесь найдёшь.
На рисунке видно уменьшение радиуса Поэтому подходит только Ответ 4.
1. в 2. Г 3. б 4. А 2. б, в, а, г 3. Г 4. знаходима масу сульфатної кислоти у розчині : 300г·0, 196 = 58, 8г Хг 58, 8г 2NaOH + H2SO4 = Na2SO4 + 2H2O 80г 98г Х = 80г··58, 8г / 98г = 48г.
3CuO. + 2Al. — > Al2O3. + 3Cu Cu( + 2) + 2e — > Cu(0) 3. В — ие ок — ль Al(0) — 3e — > Al( + 3) 2. Ок — ие в — ль.
2H2O = 4H2 + O2Mr(H2O) — 36составляем пропорцию108 / 36 : икс / 32 = икс = 108 * 32 / 36 = 96грамм / дробная черта * умножить.
K⁻¹₂S⁺² самостоятельного соединения K2S2 — нету.
Сокращенное ионное уравнение ва2 sо42 ваsо4
Как вам уже известно из предыдущих уроков химии, большая часть химических реакций происходит в растворах. А так как все растворы электролитов включают ионы, то можно говорить о том, что реакции в растворах электролитов сводятся к реакциям между ионами.
Вот такие реакции, которые происходят между ионами, носят название ионных реакций. А ионные уравнения – это, как раз и есть уравнения этих реакций.
Как правило, ионные уравнения реакций получают из молекулярных уравнений, но это происходит при соблюдении таких правил:
• Во-первых, формулы слабых электролитов, а также нерастворимых и малорастворимых веществ, газов, оксидов и т.д. в виде ионов не записывают, исключением из этого правила является ион HSO−4, и то в разбавленном виде.
• Во-вторых, в виде ионов, как правило, представляют формулы сильных кислот, щелочей, а также растворимых в воде солей. Так же следует отметить, что такая формула, как Са(ОН)2 представлена в виде ионов, в том случае, если используется известковая вода. Если же используется известковое молоко, которое содержит нерастворимые частицы Ca(OH)2, то формула в виде ионов, также не записывается.
При составлении ионных уравнений, как правило, используют полное ионное и сокращенное, то есть краткое ионное уравнения реакции. Если рассматривать ионное уравнение, которое имеет сокращенный вид, то в нем мы не наблюдаем ионов, то есть они отсутствуют обеих частях полного ионного уравнения.
Давайте рассмотрим на примерах, как записываются молекулярные, полные и сокращенные ионные уравнения:
Поэтому следует помнить, что формулы веществ, которые не распадаются, а также нерастворимые и газообразные, при составлении ионных уравнений принято записывать в молекулярном виде.
Также, следует помнить, что в том случае, если вещество выпадает в осадок, то рядом с такой формулой изображают направленную вниз стрелку (↓). Ну, а в том случае, когда в ходе реакции выделяется газообразное вещество, то рядом с формулой должен стоять такой значок, как стрелка направленная вверх (↑).
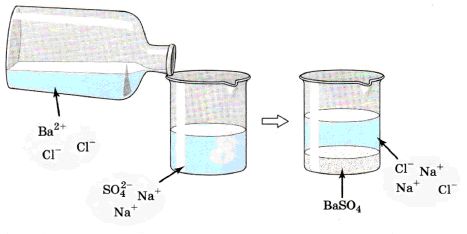
Давайте более подробно рассмотрим на примере. Если у нас есть раствор сульфата натрия Na2SO4, и мы к нему добавим раствор хлорида бария ВаСl2 (рис. 132), то увидим, что у нас образовался белый осадок сульфата бария BaSO4.
Посмотрите внимательно на изображение, на котором показано взаимодействие сульфата натрия и хлорида бария:
Теперь давайте запишем молекулярное уравнение реакции:
Ну, а сейчас давайте перепишем это уравнение, где будут изображены сильные электролиты в виде ионов, а реакции, которые уходят из сферы, представлены в виде молекул:
Перед нами записано полное ионное уравнение реакции.
Теперь попробуем убрать из одной м другой части равенства одинаковые ионы, то есть, те ионы, которые не принимают участия в реакции 2Na+ и 2Сl, то у нас получится сокращённое ионное уравнение реакции, которое будет иметь такой вид:
Из этого уравнения мы видим что вся сущность данной реакции сводится к взаимодействию ионов бария Ва2+ и сульфат-ионов 
и что в результате образуется осадок BaSO4, даже не зависимо от того, в состав каких электролитов входили эти ионы до реакции.
Как решать ионные уравнения
И напоследок, давайте подведем итоги нашего урока и определим, как же нужно решать ионные уравнения. Мы с вами уже знаем, что все реакции, которые происходят в растворах электролитов между ионами, являются ионными реакциями. Эти реакции принято решать или описывать с помощью ионных уравнений.
Также, следует помнить, что все те соединения, которые относятся к летучим, трудно растворимым или малодиссоциированным, находят решение в молекулярной форме. Также, следует не забывать, что в том случае, когда при взаимодействии растворов электролитов не образуется ни одного из вышеперечисленных видов соединения, то это означает, что реакции практически не протекают.
Правила решения ионных уравнений
Для наглядного примера возьмем такое образование труднорастворимого соединения, как:
Nа2SО4 + ВаСl2 = ВаSО4 + 2NаСl
В ионном виде это выражение будет иметь вид:
2Nа+ +SО42- + Ва2+ + 2Сl- = BаSО4 + 2Nа+ + 2Сl-
Так как мы с вами наблюдаем, что в реакцию вступили лишь ионы бария и сульфат-ионы, а остальные ионы не прореагировали и их состояние осталось прежним. Из этого следует, что мы можем это уравнение упростить и записать в сокращенном виде:
Ва2+ + SО42- = ВаSО4
Теперь вспомним, что нам следует предпринять при решении ионных уравнений:
• во-первых, необходимо исключить из обеих частей уравнения одинаковые ионы;
• во-вторых, не следует забывать о том, что сумма электрических зарядов уравнения должна быть одинаковой, и в его правой части, и также в левой.
http://himia.my-dict.ru/q/6890030_sokrasennomu-ionnomu-uravneniu-dopisite-molekularnoe-a/
http://edufuture.biz/index.php?title=%D0%98%D0%BE%D0%BD%D0%BD%D1%8B%D0%B5_%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F