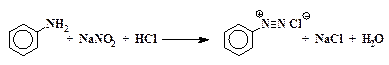
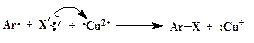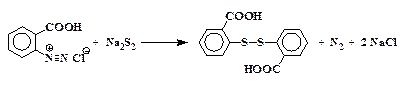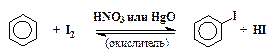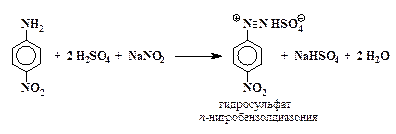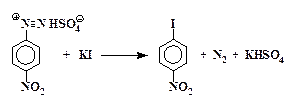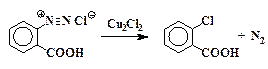Реакции солей диазония с выделением азота
Соли диазония неустойчивы и способны распадаться гетеролитически в растворителях с высокой диэлектрической проницаемостью:
Ar — N + ºN X — 
или гомолитически (как правило, под действием катализаторов):
Ar — N + ºN X — 
Направление распада зависит от аниона соли диазония и растворителя. Гомолизу способствуют в основном анионы слабых кислот, но в неводных растворах таким образом распадаются даже хлориды. Растворители с высокой диэлектрической проницаемостью способствуют гетеролитическому распаду (общая закономерность).
Диазосоединения широко используются для замены диазогруппы в аренах на различные функциональные группы. Иногда это единственный метод получения нужного продукта.
Ниже приведены наиболее часто применяемые в лаборатории синтезы с применением диазосоединений. Около каждой реакции указывается, если это достоверно известно, по какому механизму она протекает: ГТЛ (гетеролитически) или ГМЛ (гомолитически).
Замещение диазониевой группы гидроксилом:
Ar-N + ºN + H2O  Ar-OH + N2 + H + Ar-OH + N2 + H + | (ГТЛ) |
2. Замещение диазогруппы на Cl, Br, CN и CNS (реакция Зандмейера). Осуществляется путем разложения соли диазония в присутствии соответствующих координационных соединений меди(I) ([CuCl4] 3 — , [CuBr4] 3 — , [Cu(CN)4] — , [Cu(CNS)4] 3 — ):
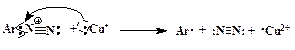
Ar-N + ºN + X — 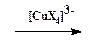 Ar-X + N2 Ar-X + N2 | (ГМЛ) |
Доказано, что этот процесс идет через промежуточное образование арильного радикала. Поставщиком электрона, необходимого для гомолитического разрыва связи С-N, является ион меди в степени окисления +1 (схематично):
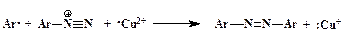
Далее ион Cu 2+ вновь превращается в Сu + , забирая электрон у галогена, и радикал Х· образует ковалентную химическую связь с Ar·:
Таким образом, медь в реакции Зандмейера служит переносчиком электрона.
Образованием в промежуточной стадии арильных радикалов объясняется прохождение ряда побочных процессов при реакциях Зандмейера:
а) Образование диарилов:
Ar. + Ar. 
б) Образование производных азобензола:
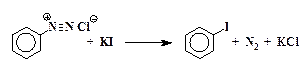
3. Замещение диазогруппы на иод непосредственно действием йодистого калия на водный раствор соли диазония без катализатора:
Ar-N + ºN + I — 
В случае реакции с йодид-анионом катализатор не нужен, т.к. роль переносчика электрона способен выполнить сам иодид-ион.
4. Разложение сухого тетрафторбората диазония с образованием фторзамещенных:
[Ar-N + ºN] [BF4] —  Ar-F + BF3 + N2 Ar-F + BF3 + N2 | (ГТЛ) |
5. В ряде случаев диазогруппа может быть замещена на сульфохлоридную группу и нитрогруппу:
Ar-N + ºN Cl — + SO2 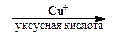
Ar-N + ºN SO4H — + NaNO2 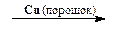
6. Взаимодействие диазониев с полисульфидами щелочных металлов:
Запрещается применять эту реакцию к диазониям, не содержащим групп, сообщающих растворимость в щелочной среде (-ОН, -СООН, -SО3Н), так как в этом случае наблюдаются сильные взрывы.
Если при диазотировании ароматических аминов образуется нерастворимая в воде соль диазония (например, при диазотировании сульфаниловой кислоты), ее необходимо перерабатывать только во влажном виде из-за чрезвычайной взрывчатости высушенных диазосоединений. Воронку и фильтр, на которых производилось отсасывание диазония, следует немедленно обмыть водой.
Йодбензол
Диазотирование анилина. В стакане емкостью 100 мл смешивают 8,3 мл 38,3 % соляной кислоты с 10 мл воды и к раствору прибавляют 3,1 г свежеперегнанного анилина. Раствор охлаждают в бане со льдом до 1 – 2 °С и из капельной воронки при непрерывном перемешивании постепенно прибавляют раствор 2,3 г нитрита натрия в 6,5 мл воды. Температура реакционной смеси не должна превышать 5 °С. Для этого в реакционную смесь бросают кусочки льда. Окончание реакции диазотирования контролируют по йодкрахмальной бумажке. Избыток азотистой кислоты разрушают добавлением нескольких крупинок карбамида (мочевины) до прекращения выделения пузырьков газа.
Замещение диазогруппы на йод.Полученный раствор соли диазония медленно при перемешивании приливают к предварительно охлажденному в ледяной воде раствору 6,7 г иодида калия в 10 мл воды, находящемуся в колбе емкостью 500 мл. Смесь оставляют на 2 часа при комнатной температуре. Затем к колбе присоединяют воздушный холодильник и нагревают на кипящей водяной бане до прекращения выделения азота. Раствор охлаждают и приливают к нему концентрированный (30 %) раствор NаОН до сильнощелочной реакции. Отгоняют йодбензол с водяным паром. Перегонку ведут до прекращения выделения маслянистых капель йодбензола.
Йодбензол отделяют от воды с помощью делительной воронки и обезвоживают прокаленным хлористым кальцием. Перегоняют из маленькой колбы, собирая фракцию, кипящую при 185 – 189 °С. Выход 90 %. Ткип 188 °С, показатель преломления йодбензола nD 20 = 1,6213.
Таким же способом можно получить из орто-толуидина орто-йодтолуол (Ткип 204 °С, nD 20 = 1,609).
Пояснения к синтезу
Из-за низкой активности йода и обратимости процесса прямое йодирование бензола проходит медленно и дает низкий выход иодбензола:
Окислитель выводит йодистый водород из сферы реакции и тем самым сдвигает равновесие вправо. Способ синтеза йодбензола с использованием соли диазония намного более удобен.
Необходимое для работы количество анилина следует перегнать непосредственно перед диазотированием на установке для микроперегонки (рис. 21, стр. 102). Для этого нужно взять 4 мл неочищенного анилина, а в перегонную колбочку вместе с анилином поместить небольшое количество цинковой пыли.
Разложение соли фенилдиазония в водном растворе йодистого калия проводят при очень медленном повышении температуры для того, чтобы замедлить побочную реакцию соли диазония с водой. Образующийся в качестве побочного продукта фенол связывают в неперегоняющийся фенолят натрия путем добавления в реакционную смесь щелочи:
Йодбензол и о-йодтолуол представляют собой очень тяжелые по сравнению с водой (плотность йодбензола 1,835) бесцветные жидкости с высокими показателями преломления. Это – характерные свойства галоген- и особенно йодпроизводных.
Контрольные вопросы по работе см. на стр. 147.
2.4.3. п-Йоднитробензол
Диазотирование п-нитроанилина. В конической колбе при нагревании растворяют 2,5 г п-нитроанилина в смеси 3 мл концентрированной серной кислоты с 30 мл воды. Смесь быстро охлаждают до
5 – 10° С и к ней постепенно при постоянном перемешивании в течение 30 мин прибавляют раствор 1,5 г нитрита натрия в 7,5 мл воды. Температура реакционной массы при этом не должна превышать 10 °С. Конец реакции диазотирования определяют пробой с иодокрахмальной бумажкой.
Холодную реакционную смесь фильтруют через складчатый фильтр. К фильтрату прибавляют небольшое количество карбамида (мочевины) до прекращения выделения пузырьков газа. Добавка карбамида требуется для разложения некоторого избытка азотистой кислоты. Фильтрату не дают при этом нагреваться выше 10 °С.
Разложение соли диазония. Холодный фильтрат, представляющий собой раствор гидросульфата п-нитробензолдиазония, постепенно при размешивании прибавляют к охлажденному раствору 5 г йодистого калия в 30 мл воды, находящемуся в стакане или конической колбе емкостью не менее 500 мл. Происходит бурное выделение азота, смесь при этом сильно пенится. Выпавший осадок отфильтровывают на воронке Бюхнера, промывают водой и высушивают. Выход 90 %.
Берут 1/5 часть сухого осадка (по весу) и перекристаллизовывают ено из спирта. Определяют температуру плавления перекристаллизованного продукта. Тпл 174° С. Рассчитывают выход неочищенного продукта и долю потерь при его перекристаллизации (в %).
Пояснения к синтезу
При низкой температуре растворимость и скорость растворения п-нитроанилина в 15 % серной кислоте мала, поэтому растворение проводят при нагревании. Затем раствор резко охлаждают, и в осадок выпадает мелкокристаллическая соль амина. В растворе при этом находится равновесная смесь свободного амина и его соли. Диазотированию подвергается только свободный амин, реагирующий относительно быстро. По мере расходования амина его содержание пополняется за счет разложения растворенной соли. Таким образом, скорость суммарного процесса диазотирования определяется скоростью растворения гидросульфата п-нитроанилиния. А она тем выше, чем меньше размеры кристаллов. Тем не менее, раствор нитрита к реакционной смеси следует добавлять медленно (7,5 мл за 30 мин).
Гидросульфат п-нитробензолдиазония, как и большинство других солей диазония, хорошо растворим в воде и разбавленных растворах кислот. Поэтому при правильном проведении процесса реакционная смесь к окончанию диазотирования будет однородным раствором желтоватого цвета. Если смесь в конце реакции представляет собой не раствор, а суспензию, это означает, что нитрит добавляли слишком быстро. Часть п-нитроанилина, не успев продиазотироваться, выпала в осадок из-за разбавления кислоты водой, добавленной вместе с нитритом. (С уменьшением концентрации кислоты растворимость амина падает). В этом случае раствор соли диазония нужно быстро отфильтровать, а лишь затем разлагать в присутствии иодистого калия. Избыток азотистой кислоты в растворе следует убрать, добавив к нему небольшое количество мочевины до прекращения выделения пузырьков газа. Иначе азотистая кислота окислит йодистый калий с выделением свободного йода, что приведет к загрязнению продукта.
Следует соблюдать осторожность при разложении соли n-нитрофенилдиазония в присутствии йодистого калия. Раствор КI перед прибавлением к нему соли диазония обязательно должен быть охлажден в ледяной воде.
Контрольные вопросы по работе см. на стр. 147.
О-Хлорбензойная кислота
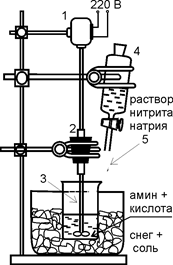 Рис. 24. Схема установки для проведения реакции диазотирования: 1 – электродвигатель, 2 – резиновая пробка с направляющей стеклянной трубкой, 3 – мешалка, 4 – капельная воронка, 5 – резиновая трубка Рис. 24. Схема установки для проведения реакции диазотирования: 1 – электродвигатель, 2 – резиновая пробка с направляющей стеклянной трубкой, 3 – мешалка, 4 – капельная воронка, 5 – резиновая трубка | Приготовление однохлористой меди. В колбе емкостью 250 мл растворяют при нагревании 4,5 г хлорида натрия и 12,5 г пятиводного сульфата меди (CuSO4·5H2O) в 40 мл воды. К смеси медленно при перемешивании добавляют 3,15 г безводного сульфита натрия (или 6,3 г семиводного сульфита натрия Na2SO3·7H2O) в 10 мл воды. Реакционную смесь охлаждают до комнатной температуры. Выпавший осадок белого цвета промывают методом декантации, т.е. сливанием прозрачной жидкости через край. Однохлористая медь чувствительна к действию кислорода воздуха, поэтому ее хранят под слоем воды в закрытой колбе. Диазотирование антраниловой кислоты. В стакане (рис. 24) емкостью 250 – 300 мл, снабженном мешалкой и капельной воронкой, конец трубки которой помещен ниже уровня жидкости, готовят смесь 6,9 г антраниловой кислоты, 20 мл воды, 14 мл концентрированной соляной кислоты |
и 10 г льда. В баню помещают охлажденную смесь размельченного льда или снега с поваренной солью, взятых в приблизительном весовом соотношении 10:1.
При интенсивном перемешивании в стакан постепенно прибавляют из капельной воронки охлажденный в ледяной воде раствор
4 г нитрита натрия в 20 мл воды. В реакционный сосуд желательно поместить 10 г измельченного льда непосредственно перед прибавлением нитрита, которое должно занимать не менее 15 минут. При соблюдении этих условий температура реакционной смеси не превышает 5 °С. По прошествии не менее 5 мин после окончания прибавления нитрита, следует сделать пробу на присутствие в реакционной массе азотистой кислоты, т.е. на конец диазотирования по йодкрахмальной бумажке
Замещение диазогруппы на хлор. Приготовленную ранее однохлористую медь растворяют в 20 мл концентрированной соляной кислоты. Получается около 25 мл раствора, который используют как катализатор разложения соли диазония. Раствор катализатора переносят в стакан емкостью 300 мл и охлаждают в бане с ледяной водой.
Холодный раствор соли диазония очень медленно при размешивании приливают к охлажденному раствору хлорида меди(I). При этом происходит бурное выделение азота. Выпавший осадок о-хлорбензойной кислоты отфильтровывают на воронке Бюхнера и промывают холодной водой. Для очистки продукт растворяют в разбавленном растворе соды (14 г Na2CO3·10H2O в 100 мл Н2О). При необходимости полученный раствор натриевой соли обесцвечивают с помощью активированного угля и фильтруют. Добавляют 10 % раствор соляной кислоты до кислой реакции по индикаторной бумажке (рН
Процессы нитрозирования и диазотирования
Процессы нитрозирования и диазотирования
1. Общие сведения
Замена атома водорода в молекуле органического соединения у атома углерода, азота, кислорода на нитрозогруппу, называется, соответственно, С-, N-, и О-нитрозированием.
Нитрозирование первичных аминов, с образованием солей диазония (R-NźNX-), называется реакцией диазотирования.
Диазотирование и нитрозирование являются быстрыми, необратимыми, экзотермическими и очень «капризными» процессами.
При соблюдении технологии выход целевого продукта – почти количественный. При отклонении технологических параметров от оптимальных значений выход целевого продукта резко снижается вследствие протекания большого количества побочных реакций. При этом выделение и очистка целевых диазо — или нитрозосоединений может оказаться экономически нецелесообразной или технически невыполнимой. Такое положение во многом справедливо и для процессов последующей переработки диазо — и нитрозосоединений.
Диазо — и нитрозосоединения обладают высокой реакционной способностью и широко используются в синтезе лекарственных веществ и витаминов. Поскольку диазо — и нитрозосоединения нестабильны, получать их необходимо на том же предприятии, где производят целевой продукт.
Следует отметить, что алифатические и ароматические диазосоединения значительно отличаются как по своим свойствам, так и основным способам получения.
2. Механизмы процессов
Большинство реакций нитрозирования формально можно отнести к реакциям электрофильного замещения.
1) Активные частицы (нитрозацидий-катион H2NO2Å, катион нитрозония NOÅ, нитрозилгалогенид NOHlg, азотистый ангидрид N2O3) образуются при взаимодействии солей азотистой кислоты с минеральными кислотами:
Соотношение активных частиц в реакционной массе зависит от кислотности среды и природы минеральной кислоты. При проведении реакции в соляной кислоте основной диазотирующей частицей является нитрозилхлорид NOCl, а в среде серной кислоты – азотистый ангидрид N2O3. Катион нитрозония NOÅ в заметных количествах образуется лишь в концентрированной серной кислоте. Активность нитрозацидий катиона значительно меньше, чем активность перечисленных частиц.
2) Реакция диазотирования протекает
— Механизм реакции можно представить следующей схемой:

— Лимитирующей стадией процесса является нитрозирование, поэтому скорость реакции зависит от рКа амина и кислотности среды. Поскольку в кислой среде амин находится в состоянии динамического равновесия с солью, реакция идет тем быстрее, чем в большей степени равновесие смещено в сторону свободного основания.
— Соли арендиазония в водных растворах минеральных кислот при низкой температуре (0¸10°С) относительно устойчивы и полностью диссоциированы. Это связывают с равномерностью распределения электронного облака катиона, структуру которого можно представить в виде следующих граничных структур:
В сухом кристаллическом состоянии при нагревании или ударе они разлагаются, иногда, со взрывом. При необходимости соли диазония могут быть стабилизированы в виде двойных солей металлов или в виде солей ароматических сульфокислот:
— Соли алкандиазония, полученные из первичных алифатических аминов, неустойчивы. Электронное облако катиона неравномерно распределено по частице, поэтому катион отщепляет азот, превращается в карбониевый ион и далее в спирт, алкен и другие стабильные продукты:
— В случае метиламина, а также соединений, имеющих в a-положении заместители с сильным I-эффектом, образуются устойчивые алифатические биполярные ионы диазония за счет отщепления протона от радикала. Например, диазометан и диазоуксусный эфир (этиловый эфир диазоуксусной кислоты) в большей мере отвечают структуре:
3) N-Нитрозирование наблюдается при взаимодействии вторичных аминов с азотистой кислотой, в результате чего образуются N-нитрозосоединения, которые не могут изомеризоваться в диазогидрат:
Алифатические нитрозоамины при нагревании с разбавленной соляной кислотой гидролизуются до вторичного амина и азотистой кислоты.
N-нитрозоарилалкиламины могут изомеризоваться в С-нитрозосоединения (перегруппировка Фишера-Хеппа):
Миграция нитрозогруппы в п-положение представляет интерес для синтеза С-нитрозосоединений, т. к. прямое нитрозирование по атому углерода вторичных ароматических аминов не проходит.
Перегруппировка хорошо идет только под действием HCl. При этом образуются исключительно пара— производные бензола. В связи с тем, что перегруппировка идет и в большом избытке мочевины, которая поглощает NOÅ или NOCl, можно предположить, что электрофильной частицей является сам N-нитрозамин.
4) Реакции С-нитрозирования.
а)Активированные ароматические соединения (третичные жирноароматические амины и фенолы) взаимодействуют с нитрозо-катионом по механизму электрофильного замещения (SE) у атома углерода.
В случае производных бензола нитрозогруппа почти всегда вступает в пара—положение к ОН — или NR2-группе. Продукт реакции, как правило, выделяется в виде осадка интенсивно желтого цвета, представляющего собой соль:
В ряду нафталина чаще образуется смесь изомеров. Например при нитрозировании a-нафтола получаются почти равные количества 1-гидрокси-2-нитрозонафталина и 1-гидрокси-4-нитрозонафталина.
б) С-нитрозирование алифатических соединений протекает по радикальному механизму SR. Из алканов таким образом получают нитрозоалканы, которые неустойчивы и легко перегруппировываются в изомерные оксимы. Например, в синтезе лизина и e-аминокапроновой кислоты используют следующую реакцию:
5) О-нитрозирование. Алкилнитриты получают действием нитритов на алкилгалогениды, либо взаимодействием спирта с азотистой кислотой:
3. Влияние основных технологических параметров на ход процесса диазотирования
— Температура. Обычно диазотирование проводят при низких температурах (0-5°С), т. к.: 1) с возрастанием температуры резко увеличивается скорость разложения соли диазония; 2) уменьшается растворимость азотистой кислоты и, следовательно, увеличивается опасность улетучивания нитрозных газов (окислов азота). Все это приводит к уменьшению выхода целевого продукта. В отдельных случаях, когда диазосоединение устойчиво, диазотирование может проводиться и при более высокой температуре, однако необходимо помнить, что реакция является экзотермичной и требует интенсивного отвода тепла.
— Кислотность среды. При практическом диазотировании ароматических аминов количество кислоты превышает теоретически рассчитанное (два эквивалента кислоты на один эквивалент амина) на пол-эквивалента и более. Во время и в конце реакции раствор должен иметь значение рН 4 в качестве побочного продукта образуется диазоаминосоединение, которое не способно к конденсации в рибофлавин.
Обычно диазосоставляющая по объему и структуре молекулы проще, чем азосоставляющая, однако бывают и обратные варианты:
— Образование диазоаминосоединения во многих случаях является побочной реакцией и её стараются избежать. Однако в синтезе азидина она является целевой:
8.2.Сочетание солей диазония с алифатическими азосоставляющими. В алифатическом ряду реакция азосочетания известна лишь с соединениями общей формулы Z-CH2-Z’ или Z’-CHR-Z (b-кетоэфиры, малоновый эфир и т. п.), где Z и Z’ ацильные, карбоксильные и др. заместители. Вероятный механизм SE1:
В этом случае первоначально образующееся соединение неустойчиво и таутомерно превращается в гидразон, который и является продуктом реакции. При проведении реакции с соединениями Z’-CHR-Z отщепляется группа Z (особенно, если это ацил или карбоксил) и, также как и в предыдущем случае, проходит таутомеризация и образуется гидразон:
При наличии в молекуле ацильной и карбоксильной групп преимущественно отщепляется карбоксил. В отсутствие этих групп образуется азосоединение.
— В синтезе индопана и серотонина азосочетание сопровождается декарбоксилированием 2-пиперидона-3-карбоновой кислоты, и азогруппа становится на место уходящей карбоксильной группы:
— Другим примером использования азосоставляющей неароматического характера является одна из стадий в синтезе меркаптопурина:
7. Примеры использования реакции нитрозирования в промышленном синтезе лекарственных веществ
— В синтезе фолиевой кислоты в 2,4-диамино-6-гидроксипиримидине положение 5 сильно активировано, поэтому в первую очередь идет С-нитрозирования, а не диазотирования (при 0оС):
— При синтезе алкалоидов пуринового ряда (синтез Траубе) нитрозирование 1,3-диалкил-2,6-диоксо-4-иминопиримидина проводят при 80°С:
— В синтезе амидопирина и анальгина бензолсульфонат антипирина нитрозируют при температуре 2-5°С. Роль кислоты в этой реакции выполняет бензолсульфокислота, связанная с антипирином:
— Нитрозирование 4-диметиламино-2-бутанона в производстве изонитрозина осуществляют этилнитритом (С2Н5ОН + NaNO2 + H2SO4):
— N-Нитрозирование вторичного амина проводят в неводной среде:
Несмотря на изученность процесса и наличие типовых методик, проведение реакций диазотирования и нитрозирования при синтезе химико-фармацевтических препаратов достаточно часто требует индивидуальной рецептуры, учитывающей химические свойства субстратов сложного строения.
8. Другие способы получения диазо — и нитрозосоединений
Алифатические диазосоединения лишь в редких случаях получают прямым диазотированием соответствующих аминов, чаще используют другие методы синтеза.
1. Синтез диазоалканов из N-нитрозо — N-алкиламидов карбоновых, нитрозоалкилмочевины.
Например, диазометан можно получить из бис-(N-нитрозо-N-метиламида)-терефталевой кислоты:
Однако чаще исходят из N-нитрозо-N-алкилмочевины:
Указанные выше промежуточные продукты получения диазоалканов легко разлагаются, иногда со взрывом, поэтому целесообразнее использовать устойчивые N-нитрозо-N-алкил-п-толуолсульфамиды:
3. Диазометан можно получить реакцией натриевой соли оксима формальдегида с хлорамином:
4. Синтез диазоалканов окислением кетогидразоны оксидом ртути (II):
Моногидразоны 1,2-дикарбонильных соединений образуют a,-диазокетоны:
5. Реакцией расщепления тозилгидразонов:
6. Реакцией аренсульфонилазидов с соединениями с активными метиленовыми группами в присутствии оснований:
В образующемся диазоциклопентадиене имеется ароматический циклопентадиенил-анион.
Нитрозосоединения могут быть получены окислением N-замещенных гидроксиламинов и первичных аминов бихроматом калия в серной кислоте или перкислотами
9. Особенности техники безопасности при проведении процессов диазотирования и нитрозирования
Диазосоединения в производстве химико-фармацевтических препаратов в свободном виде не выделяют, а используют далее реакционную массу, полученную на стадии диазотирования. При необходимости (например, для научно-исследовательских целей) соли диазония могут быть выделены в чистом виде при проведении диазотирования алкилнитратом в кислой спиртовой среде и последующем разбавлении реакционной массы эфиром. Следует, однако, помнить, что сухие соли диазония взрывчаты.
Нитрозосоединения легко окисляются, а сухие нитрозосоединения под действием окислителей (в частности, окислов азота) способны к самовозгоранию. Последнее может иметь место в вытяжных вентиляционных каналах от нитрозаторов. Поэтому нитрозосоединения выделяют обычно в виде кислой пасты, а только в отдельных случаях и в сухом виде.
Отделения нитрозирования и диазотирования необходимо обеспечить раздельными системами приточно-вытяжной местной и аварийной вентиляции, не связанной с вентиляцией других производств. Аппараты на этих стадиях должны быть снабжены местными отсосами от мест возможного выделения окислов азота. Для поглощения окислов азота должны быть предусмотрены поглотительные системы.
Во избежание выброса реакционной массы и выделения большого количества ядовитых окислов азота, при проведении процессов диазотирования и нитрозирования, а также превращения диазосоединений, следует особенно тщательно поддерживать заданный температурный режим путем регулирования подачи реагентов в реакционную массу и хладоагентов в рубашку и змеевики реактора.
Аппараты должны быть защищены от кислой коррозии, и регулярно подвергаться тщательному осмотру.
Свойства ароматических солей диазония
Вы будете перенаправлены на Автор24
Арендиазониевые соли являются крайне реакционноспособными соединениями. Ниже приведены те классы соединений, которые непосредственно могут быть получены из арендиазониевых солей:
$ArOH$, $ArSH$, $ArI$, $ArBr$, $ArCl$, $ArF$, $ArCN$, $ArNO_2$, $ArH$,
$Ar-Ar$, $Ar^1-Ar^2$, $ArN_3$, $ArNH-NH_2$, $Ar^1N=NAr^2$ и др.
Реакции арендиазониевых солей условно можно разделить на следующие четыре группы, которые различаются механизмами взаимодействий диазониевых катионов с нуклеофильными агентами $X^-$:
И реакции типа (1), и реакции типа (4) являются реакциями нуклеофильного замещения. Принципиальным различием между этими реакциями является то, что в реакциях типа (1) отщепляется азот, а в реакциях типа (4) диазогруппа сохраненяется
В реакциях типа (2) происходит радикальный распад солей диазония также с отщеплением азота
Тип реакций (3) предполагает атаку нуклеофильными агентами крайних атомов азота диазониевых катионов и реакции этого типа протекают с сохранением диазогруппы.
В общем реакции солей диазония удобно делить на две большие группы:
- такие, где диазогруппа отщепляется;
- такие, где диазогруппа сохраняется.
Термическое разложение и восстановление солей диазония
При нагревании или облучении УФ светом ароматические диазониевые соли теряют азот. В водной среде образовавшийся фенил-катион главным образом взаимодействует с самой водой с образованием фенола. При нагреве растворов, также содержащих хлоридионы, или бромидионы, то в качестве побочных продуктов в небольших количествах также образуются и галогенпроизводные соединения. Анион фтора хорошо вводится только через тетрафторборат диазония нагревом в среде инертного растворителя (реакция Шимана). Во всех этих случаях реакция происходит из-за образования $Ph^+$:
Готовые работы на аналогичную тему
При кипячении солей диазония со спиртами наряду с образованием алкилариловых эфиров наблюдается также конкурентная реакция — восстановление солей диазония в углеводы. В таких растворителях, как циклические эфиры (диоксан, тетрагидрофуран и другие), а также в диметилформамиде эта реакция становится главной (восстановление по Меервейну).
При этом в результате радикального цепного процесса на арильньий остаток переносится водород.
Рисунок 3. Схема восстановления солей диазония в углеводороды. Автор24 — интернет-биржа студенческих работ
Для восстановления солей диазония в соответствующие углеводороды можно применять щелочной раствор станнита натрия.
Выходы фенолов при кипячении солей диазония достаточно низкие. Этим путем фенолы получают тогда, когда другие пути не пригодны.
Реакции солей диазония с сохранением азота
Восстановление в арилгидразины
Кроме рассмотренного выше восстановления солей диазония в углеводороды, их можно восстанавливать также с сохранением азота в молекуле. При таком восстановлении водород присоединяется по двойной связи $N = N$ образуя арилгидразины. Как восстановитель используют $SO_2$, цинк в уксусной кислоте или дихлорид олова в соляной кислоте. Выбор восстановителя и условий проведения этой реакции является очень важным, поскольку сам арилгидразин очень легко восстанавливается до анилина. Синтез анилинов из солей диазония, разумеется, не имеет практической ценности.
Фенилгидразины являются важными реактивами для идентификации альдегидов, кетонов, сахаров, и применяются также в синтезе индолов по Фишеру. В промышленности их используют в больших количествах для производства производных пиразолона, которые являются лекарственными препаратами или компонентами производства красителей.
Как уже было сказано, при действии на диазосоединения щелочью образуются диазотаты:
Окислением щелочных растворов диазотатов можно получить соли нитроаминов $Ar-NH-NO_2$. Минеральными кислотами эти соединения изомеризуються с образованием смеси орто- и пара-нитроанилина.
Ионы диазония имеют электрофильные свойства (пониженную электронную плотность) у конечного атома азота, как это видно из схемы:
Поэтому ионы диазония могут атаковать ароматические соединения. При этом протекают реакции электрофильного замещения (азосочетания). Эти реакции аналогичны обычным электрофильным реакциям замещения в ароматическом ряду — нитрованию, сульфированию, галогенированию и т.п.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 24 03 2021
http://pandia.ru/text/78/339/569.php
http://spravochnick.ru/himiya/aromaticheskie_i_alifaticheskie_nitrosoedineniya_diazosoedineniya_i_azidy/svoystva_aromaticheskih_soley_diazoniya/