Соли алюминия: получение и свойства
Соли алюминия
Нитрат и сульфат алюминия
Нитрат алюминия при нагревании разлагается на оксид алюминия, оксид азота (IV) и кислород:
Сульфат алюминия при сильном нагревании разлагается аналогично — на оксид алюминия, сернистый газ и кислород:
Комплексные соли алюминия
Для описания свойств комплексных солей алюминия — гидроксоалюминатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоалюминат на две отдельные молекулы — гидроксид алюминия и гидроксид щелочного металла.
Например , тетрагидроксоалюминат натрия разбиваем на гидроксид алюминия и гидроксид натрия:
Na[Al(OH)4] разбиваем на NaOH и Al(OH)3
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы алюминия реагируют с кислотными оксидами .
Например , гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид алюминия не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Аналогично тетрагидроксоалюминат калия реагирует с углекислым газом:
По такому же принципу тетрагидроксоалюминаты реагирует с сернистым газом SO2:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид алюминия реагирует с сильными кислотами.
Например , с соляной кислотой:
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида алюминия кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид алюминия:
Комплекс разрушается при взаимодействии с хлорной водой (водным раствором хлора) Cl2:
2Na[Al(OH)4] + Cl2 → 2Al(OH)3↓ + NaCl + NaClO
При этом хлор диспропорционирует.
Также комплекс может прореагировать с избытком хлорида алюминия. При этом выпадает осадок гидроксида алюминия:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-алюминат:
Гидролиз солей алюминия
Растворимые соли алюминия и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Al 3+ + H2O = AlOH 2+ + H +
II ступень: AlOH 2+ + H2O = Al(OH )2 + + H +
Однако сульфиды, сульфиты, карбонаты алюминия и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Более подробно про гидролиз можно прочитать в соответствующей статье.
Алюминаты
Соли, в которых алюминий является кислотным остатком (алюминаты) — образуются из оксида алюминия при сплавлении с щелочами и основными оксидами:
Для понимания свойств алюминатов их также очень удобно разбить на два отдельных вещества.
Например, алюминат натрия мы разделим мысленно на два вещества: оксид алюминия и оксид натрия.
NaAlO2 разбиваем на Na2O и Al2O3
Тогда нам станет очевидно, что алюминаты реагируют с кислотами с образованием солей алюминия :
KAlO2 + 4HCl → KCl + AlCl3 + 2H2O
NaAlO2 + 4HCl → AlCl3 + NaCl + 2H2O
Под действием избытка воды алюминаты переходят в комплексные соли:
Соли алюминия гидроксид алюминия уравнение

webkonspect.com — сайт, с элементами социальной сети, создан в помощь студентам в их непростой учебной жизни.
Здесь вы сможете создать свой конспект который поможет вам в учёбе.
Чем может быть полезен webkonspect.com:
- простота создания и редактирования конспекта (200 вопросов в 3 клика).
- просмотр конспекта без выхода в интернет.
- удобный текстовый редактор позволит Вам форматировать текст, рисовать таблицы, вставлять математические формулы и фотографии.
- конструирование одного конспекта совместно с другом, одногрупником.
- webkonspect.com — надёжное место для хранения небольших файлов.
Способы получения Аl2O3
1. Извлечение из природных бокситов.
2. Сгорание порошка Al в токе кислорода.
3. Термическое разложение Al(OH)3.
4. Термическое разложение некоторых солей.
Гидроксид алюминия Al(OH)3
— твердое бесцветное вещество, нерастворимое в воде. При нагревании разлагается:
Полученный этим способом Al2O3 называется алюмогелем.
По химическим свойствам — типичный амфотерный гидроксид, растворяется и в кислотах, и в щелочах:
Al(OH)3 + NaOH = Na[Al(OH)4] тетрагидроксоалюмикат натрия
При сплавлении Al(OH)3 с твердыми щелочами образуются метаалюминаты — соли метагидроксида АlO(ОН), которые можно рассматривать как соли метаалюминиевой кислоты НАlO2:
Соли алюминия
Вследствие амфотерности гидроксида алюминия и возможности существования его в орто- и метаформе существуют различные типы солей. Так как Al(OH)3 проявляет очень слабые кислотные и очень слабые основные свойства, все типы солей в водных растворах в сильной степени подвержены гидролизу, в результате которого образуется в конечном итоге нерастворимый Al(OH)3. Присутствие в водном растворе того или иного типа солей алюминия определяется величиной рН данного раствора.
1. Соли Al 3+ с анионами сильных кислот (AlCl3, Al2(SO4)3, Al(NO3)3, АlВr3) существуют в подкисленных растворах. В нейтральной среде метаалюминаты, содержащие алюминий в составе аниона АlO2 существуют в твердом состоянии. Распространены в природе. При растворении в воде превращаются в гидроксоалюминаты.
2. Гидроксоалюминаты, содержащие алюминий в составе аниона [Al(OH)4] — , существуют в щелочных растворах. В нейтральной среде сильно гидролизуются.
3. Метаалюминаты, содержащие алюминий в составе аниона АlO2. Существуют в твердом состоянии. Распространены в природе. При растворении в воде превращаются в гидроксоалюминаты.
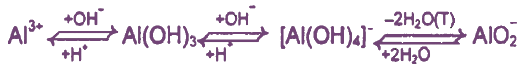
Взаимопревращения солей алюминия
Способы осаждения (получения) Аl(ОН)3 из растворов его солей
I. Осаждение из растворов, содержащих соли Al 3+ :
а) действие сильных щелочей, добавленных без избытка
б) действие водных растворов аммиака (слабое основание)
в) действие солей очень слабых кислот, растворы которых вследствие гидролиза имеют щелочную среду (избыток ОН — )
II. Осаждение из растворов, содержащих гидроксоалюминаты:
а) действие сильных кислот, добавленных
б) действие слабых кислот, например, пропускание СО2
III. Осаждение в результате обратимого или необратимого гидролиза солей Al 3+ (усиливается при разбавлении раствора водой и при нагревании)
http://webkonspect.com/?room=profile&id=8005&labelid=94823
http://examchemistry.com/content/lesson/neorgveshestva/aluminii.html