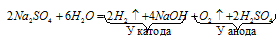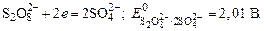Электронные процессы, происходящие на электродах при электролизе солей
Решение задач на электролиз солей
Задание 277.
При электролизе растворов MgSO4 и ZnСl2, соединенных последовательно с источником тока, на одном из катодов выделилось 0,25 г водорода. Какая масса вещества выделится на другом катоде; на анодах? Ответ: 8,17 г; 2,0 г; 8,86 г.
Решение:
При электролизе солей растворов MgSO4 и ZnСl2, соединенных последовательно с источником тока, на катоде в растворе MgSO4 будет происходить электрохимическое восстановление воды, а на катоде в растворе ZnСl2 – электрохимическое восстановление ионов цинка, поскольку стандартный электродный потенциал системы Mg 2+ -2 

На анодах будут происходить электрохимические окислительные процессы: в растворе MgSO4 будет протекать окисление воды с образованием водорода, а в растворе ZnСl2 – окисление хлрид-ионов с выделением газообразного хлора, так как стандартные электродные потенциалы систем:
2SO4 2- -2 
2Cl – -2 = Cl2 0 ;
2H2O -4 
соответственно равны -2,01 В; 1,36 В; 1,23 В.
Количества веществ, выделяющихся при электролизе эквивалентны друг другу:
Находим количество эквивалентов водорода, выделившегося на катоде:
m(O2) = (О2) . МЭ(O2) = 0,25 . 8 = 2 г;
m(Zn) = (Zn) . МЭ(Zn) = 0,25 . 32,66 = 8,17 г’
m(Cl2) = (Cl2) . МЭ(Cl2) = 0,25 . 8,86 = 2 г
Ответ: m(Zn) = 8,17 г; 2,0 г; m(Cl2) = 8,86 г.
Задание 278,
Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора Na2SO4. Вычислите массу вещества, выделяющегося на катоде, если на аноде выделяется 1,12 л газа (н.у.). Какая масса H2SO4 образуется при этом возле анода? Ответ: 0,2 г; 9,8 г.
Решение:
Стандартный электродный потенциал системы Na + + 
2Н2О + 2 
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О — 4 
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему: 2SO4 2- — 2 
Суммарно процесс электролиза Na2SO4 можно представить в молекулярной форме:
Количества веществ, выделяющихся при электролизе эквивалентны друг другу:
На аноде выделяется кислород, поэтому количество эквивалентов кислорода равно:
Ответ: m(Н2SO4) = 0,2 г; 9,8 г.
Задание 279.
При электролизе раствора соли кадмия израсходовано 3434 Кл электричества. Выделилось 2 г кадмия. Чему равна молярная масса эквивалента кадмия? Ответ: 56,26 г/моль.
Решение:
Расход электричества, необходимый для проведения электролиза равен: Q = I . t = 3434 Кл. Эквивалентную массу металла рассчитаем из уравнения Фарадея относительно массы вещества и количества электричества, подставив в него данные из задачи, получим:
m(В) = МЭ(В) . I . t/F = МЭ(В) . Q/F
МЭ(Ме) = m(В) . F/Q = (2 . 96500)/3434 = 56,20 г/моль.
Здесь m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Ответ: М Э (Ме) = 56,26 г/моль.
Задание 280.
Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН. Чему равна сила тока, если в течение 1 ч 15 мин 20 с на аноде выделилось 6,4 г газа? Сколько литров газа (н.у,) выделилось при этом на катоде? Ответ: 17,08 А; 8,96 л.
Решение:
Стандартный электродный потенциал системы К + + 
2Н2О + 2 
На аноде будет происходить электрохимическое окисление ионов ОН-, приводящее к выделению кислорода:
4ОН — 4 
поскольку отвечающий этой системе стандартный электродный потенциал (+0,54 В) значительно ниже, чем стандартный электродный потенциал (+1,23 В), характеризующий систему 2Н2О — 4 
Силу тока вычисляем из уравнения Фарадея относительно массы газа, имея в виду, что 1 ч 15 мин 20 с = 4520 с и m(О2) = 6,4 г, получим:
I = m(О2) . F/ МЭО2) . t = 6,4 . 96500/8 . 4520 = 17,08 A.
При вычислении объёмов выделившихся газов представим уравнение Фарадея в следующем виде:
V = VЭ . I . t/F
Здесь m(B) – масса выделившегося вещества, г; V – объём выделившегося газа, л; m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Поскольку при нормальных условиях эквивалентный объём водорода равен 11,2 л/моль, получим:
V(Н2) = (11,2 . 17,08 . 5420)/96500 = 8,96 л
Ответ: V(Н2) = 17,08 А; 8,96 л.
Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов MgSO4 и ZnCl2. Вычислите силу тока при электролизе раствора MgSO4 в течение 1 ч 40 мин






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов MgSO4 и ZnCl2. Вычислите силу тока при электролизе раствора MgSO4 в течение 1 ч 40 мин, если на катоде выделилось 1,4 л водорода (н.у.).
Решение :
MgSO 4 в водном растворе диссоциирует: MgSO 4 = Mg 2+ + SO 4 2-
Так как потенциал восстановления магния намного меньше потенциала восстановления воды, то на катоде восстанавливается вода, на аноде сульфат ионы не окисляются, окисляется вода:
Продукты электролиза – Н2 и О2.
| Если вам нужно решить химию, тогда нажмите ➔ заказать контрольную работу по химии. |
| Похожие готовые решения: |
- Две цинковые пластинки, частично покрытые одна никелем, другая – серебром, находятся во влажном воздухе. На какой из пластинок коррозия протекает интенсивнее? Почему? Составьте электронные уравнения
- Периодическая система элементов и Периодический закон Д.И.Менделеева. Электронные аналоги.
- Какие из приведенных реакций относятся к реакциям обмена и к окислительно-восстановительным реакциям? 2. Для реакций обмена расставьте коэффициенты методом подбора. 231
- Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде.
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Электролиз. Законы Фарадея
Пример 1. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора MgSO4 с инертными электродами.
Решение. Стандартный электродный потенциал системы Mg 2+ + 2e ® Mg равен –2,363 В. Сульфат магния является солью, обра-зованной слабым основанием и сильной кислотой, поэтому вследствие гидролиза среда в его водном растворе будет слабокислотной (рН – ,
а ионы Мg 2+ будут накапливаться в прикатодном пространстве.
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
поскольку отвечающий этой системе электродный потенциал кислородного электрода в слабокислотной среде
значительно меньше, чем стандартный потенциал, характеризующий систему:
Ионы 
Умножая уравнение катодного процесса на 2 для подведения баланса по электронам и складывая его с уравнением анодного процесса, получают суммарное уравнение процесса электролиза:
Принимая во внимание, что одновременно происходит накопление ионов магния в прикатодном пространстве и сульфат-ионов в прианодном пространстве, итоговое уравнение процесса можно записать так:
6 Н2О + 2MgSO4 = 2H2 + 2Mg(OH)2¯ + O2 + 4H + + 2
Следует учитывать, что гидроксид магния – малорастворимое соединение.
Пример 2. Написать уравнения процессов, протекающих при электролизе водного раствора, содержащего смесь солей Cu(NO3)2 и ZnBr2. Электроды графитовые.
Решение. На катоде возможно протекание следующих процессов:
Cu 2+ + 2e = Cu 
Zn 2+ + 2 e = Zn 
2H2O + 2e ® H2 + 2OH – 
Необходимо учитывать, что выделение водорода протекает со значительным перенапряжением.
Наибольший потенциал у первого процесса, поэтому на катоде будут восстанавливаться ионы меди:
На аноде возможно протекание следующих процессов:
2H2O – 4e = O2 + 4H + 
В прианодном пространстве накапливаются нитрат–ионы.
Суммарное уравнение процесса электролиза можно получить сложением уравнений катодного и анодного процессов:
Сu 2+ + 2Br – = Cu + Br2
Принимая во внимание, что одновременно происходит накопление ионов цинка в прикатодном пространстве и нитрат-ионов в прианодном, итоговое уравнение процесса можно записать так:
Сu(NO3)2 + ZnBr2 = Cu + Br2 + Zn 2+ + 2
Пример 3. Какие процессы будут протекать на железных электродах при электролизе водного раствора Al2(SO4)3 в атмосфере воздуха в нейтральной среде?
В атмосфере воздуха рН »7.
На катоде возможно протекание следующих процессов:
Fe 2+ + 2e = Fe 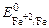
2H2O + 2e ® H2 + 2OH – 
Al 3+ + 3e = Al 
Вследствие того, что выделение водорода сопровождается перенапряжением, наибольший потенциал становится у первого процесса, поэтому на катоде будут восстанавливаться ионы железа: Fe 2+ + 2 e = Fe.
В прикатодном пространстве накапливаются ионы алюминия Al 3+ .
На железном аноде возможно протекание следующих процессов:
Fe – 2e = Fe 2+ 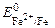


2H2O – 4e = O2 + 4H + 
При электролизе расплава хлорида натрия на электродах протекают процессы
Согласно первому закону Фарадея, время, необходимое для получения 150 г металлического натрия, определяем по формуле

где Mэк.(Na) – молярная масса эквивалента натрия, г/моль; z – число электронов, участвующих в электродном процессе; I – сила тока, А; F – постоянная Фарадея; h – выход по току.
Объем хлора образуется в количестве 1 моль и составляет
Пример 5. Серебрение изделий ведется в растворе азотнокислого электролита с плотностью тока 3 А/дм 3 . Рассчитать толщину серебряного слоя, образующегося за 2 мин, если выход по току h = 0,90. Плотность серебра r = 10 490 кг/м 3 .
Решение. Согласно закону Фарадея, масса выделившегося серебра

После преобразований находим толщину покрытия
где i = I/S – плотность тока; r – плотность металла.
Пример 6. Определите выход по току водорода, выделенного на электроде при нормальных условиях, если объем его составил 112 л при прохождении через электрод 1000 А×ч.
Решение. Объем моль эквивалента водорода при н.у. составляет 22,4/2 = 11,2 л. Для выделения такого объема водорода требуется количество электричества, равное 1F, или 26,8 А×ч., следовательно, для выделения 112 л потребуется 268 А×ч. Найдем выход по току водорода:

Пример 7. При электролизе водного раствора меди сульфата 
Решениезадачи следует начинать с описания объекта изучения – электрохимических реакций. До электролиза в растворе прошли реакции:
а) диссоциация
б) гидролиз
Электрохимическая система: (-) К С 
Процессы на катоде (–) и на аноде (+) А при электролизе:
Определим массу кислорода 
Молярная масса эквивалентов кислорода 
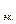
5,6 л 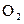
х =
На аноде выделилось 0,28/5,6 = 0,05 моль эквивалентов О2.
Вычислим массу меди 
Согласно второму закону Фарадея:
Пример 8. Через щелочной раствор, содержащий комплексные ионы двух- и четырехвалентного олова, 


Решение. Процессы диссоциации комплексных ионов в растворе:


Электрохимическая система: (–) К: Sn 
Примем, что электроосаждение происходит из ионов Sn 4+ и Sn 2+ :
(–) К: 

“Sn” (+) A: Sn
Масса олова 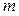
Масса олова 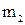
Общая масса выделившегося на катоде олова m:
http://natalibrilenova.ru/sostavte-elektronnyie-uravneniya-protsessov-proishodyaschih-na-elektrodah-pri-elektrolize-rastvorov-mgso4-i-zncl2-vyichislite-silu-toka-pri-elektrolize-rastvora-mgso4-v-techenie-1-ch-40-min/
http://poisk-ru.ru/s36042t7.html