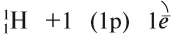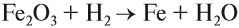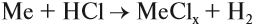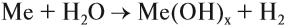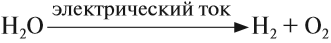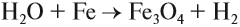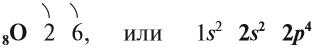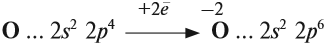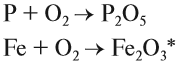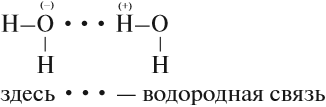Урок 12. Водород и кислород
Водород
Водород — самый распространённый химический элемент во Вселенной. Именно он составляет основу горючего вещества Звёзд.
Водород — первый химический элемент Периодической системы Менделеева. Его атом имеет простейшее строение: вокруг элементарной частицы «протон» (ядро атома) вращается один-единственный электрон:
Природный водород состоит из трех изотопов: протий 1 Н, дейтерий 2 Н и тритий 3 Н.
Задание 12.1. Укажите строение ядер атомов этих изотопов.
Имея на внешнем уровне один электрон, атом водорода может проявлять единственно возможную для него валентность I:
Вопрос. Образуется ли завершённый внешний уровень при приёме атомом водорода электронов?
Таким образом, атом водорода может и принимать, и отдавать один электрон, т. е. является типичным неметаллом. В любых соединениях атом водорода одновалентен.
Простое вещество «водород» Н2 — газ без цвета и запаха, очень лёгкий. Он плохо растворим в воде, но хорошо растворим во многих металлах. Так, один объём палладия Рd поглощает до 900 объёмов водорода.
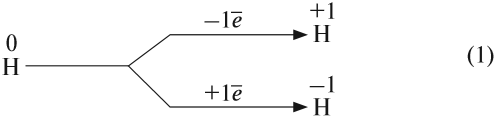
Схема (1) показывает, что водород может быть и окислителем, и восстановителем, реагируя с активными металлами и многими неметаллами:
Задание 12.2. Определите, в каких реакциях водород является окислителем, а в каких — восстановителем. Обратите внимание, что молекула водорода состоит из двух атомов.
Смесь водорода и кислорода является «гремучим газом», поскольку при поджигании её происходит сильнейший взрыв, который унёс многие жизни. Поэтому опыты, в которых выделяется водород, нужно выполнять подальше от огня.
Чаще всего водород проявляет восстановительные свойства, что используется при получении чистых металлов из их оксидов*:
* Аналогичные свойства проявляет алюминий (см. урок 10 — алюминотермия).
Разнообразные реакции происходят между водородом и органическими соединениями. Так, за счёт присоединения водорода (гидрирование) жидкие жиры превращаются в твёрдые (подробнее урок 25).
Водород можно получить разными способами:
- Взаимодействием металлов с кислотами:
Задание 12.3. Составьте уравнения таких реакций для алюминия, меди и цинка с соляной кислотой. В каких случаях реакция не идет? Почему? В случае затруднения см. уроки 2.2 и 8.3;
- Взаимодействие активных металлов с водой:
Задание 12.4. Составьте уравнения таких реакций для натрия, бария, алюминия, железа, свинца. В каких случаях реакция не идёт? Почему? В случае затруднений см. урок 8.3.
В промышленных масштабах водород получают электролизом воды:
а также при пропускании паров воды через раскалённые железные опилки:
Водород — самый распространённый элемент Вселенной. Он составляет бОльшую часть массы звёзд и участвует в термоядерном синтезе — источнике энергии, которую эти звёзды излучают.
Кислород
Кислород — самый распространённый химический элемент нашей планеты: более половины атомов Земной коры приходится на кислород. Вещество кислород О2 составляет около 1/5 нашей атмосферы, а химический элемент кислород — 8/9 гидросферы (Мирового океана).
В Периодической системе Менделеева кислород имеет порядковый номер 8 и находится в VI группе второго периода. Поэтому строение атома кислорода следующее:
Имея на внешнем уровне 6 электронов, кислород является типичным неметаллом, т. е. присоединяет два электрона до завершения внешнего уровня:
Поэтому кислород в своих соединениях проявляет валентность II и степень окисления –2 (за исключением пероксидов).
Принимая электроны, атом кислорода проявляет свойства окислителя. Это свойство кислорода исключительно важно: процессы окисления происходят при дыхании, обмене веществ; процессы окисления происходят при горении простых и сложных веществ.
Горение — окисление простых и сложных веществ, которое сопровождается выделением света и теплоты. В атмосфере кислорода горят или окисляются почти все металлы и неметаллы. При этом образуются оксиды:
При горении в кислороде сложных веществ образуются оксиды химических элементов, входящих в состав исходного вещества. Только азот и галогены выделяются в виде простых веществ:
Вторая из этих реакций используется как источник тепла и энергии в быту и промышленности, так как метан CH4 входит в состав природного газа.
Кислород позволяет интенсифицировать многие промышленные и биологические процессы. В больших количествах кислород получают из воздуха, а также электролизом воды (как и водород). В небольших количествах его можно получить разложением сложных веществ:
Задание 12.5. Расставьте коэффициенты в приведенных здесь уравнениях реакций.
Воду нельзя ничем заменить — этим она отличается практически от всех других веществ, которые встречаются на нашей планете. Воду может заменить только сама вода. Без воды нет жизни: ведь жизнь на Земле возникла тогда, когда на ней появилась вода. Жизнь зародилась в воде, поскольку она является естественным универсальным растворителем. Она растворяет, а значит, измельчает все необходимые питательные вещества и обеспечивает ими клетки живых организмов. А в результате измельчения резко возрастает скорость химических и биохимических реакций. Более того, без предварительного растворения невозможно протекание 99,5 % (199 из каждых 200) реакций! (См. также урок 5.1.)
Известно, что взрослый человек в сутки должен получать 2,5–3 л воды, столько же выводится из организма: т. е. в организме человека существует водный баланс. Если он нарушается, человек может просто погибнуть. Например, потеря человеком всего 1–2 % воды вызывает жажду, а 5 % — повышает температуру тела вследствие нарушения терморегуляции: возникает сердцебиение, возникают галлюцинации. При потере 10 % и более воды в организме возникают такие изменения, которые уже могут быть необратимы. Человек погибнет от обезвоживания.
Вода — уникальное вещество. Её температура кипения должна составлять –80 °C (!), однако равна +100 °C. Почему? Потому что между полярными молекулами воды образуются водородные связи:
Поэтому и лёд, и снег — рыхлые, занимают больший объём, чем жидкая вода. В результате лёд поднимается на поверхность воды и предохраняет обитателей водоёмов от вымерзания. Свежевыпавший снег содержит много воздуха и является прекрасным теплоизолятором. Если снег покрыл землю толстым слоем, то и животные и растения спасены от самых суровых морозов.
Кроме того, вода имеет высокую теплоёмкость и является своеобразным аккумулятором тепла. Поэтому на побережьях морей и океанов климат мягкий, а хорошо политые растения меньше страдают от заморозков, чем сухие.
Без воды в принципе невозможен гидролиз, химическая реакция, которая обязательно сопровождает усвоение белков, жиров и углеводов, которые являются обязательными компонентами нашей пищи. В результате гидролиза эти сложные органические вещества распадаются до низкомолекулярных веществ, которые, собственно, и усваиваются живым организмом (подробнее см. уроки 25–27). Процессы гидролиза были нами рассмотрены в уроке 6. Вода реагирует со многими металлами и неметаллами, оксидами, солями.
Задание 12.6. Составьте уравнения реакций:
- натрий + вода →
- хлор + вода →
- оксид кальция + вода →
- оксид серы (IV) + вода →
- хлорид цинка + вода →
- силикат натрия + вода →
Изменяется ли при этом реакция среды (рН)?
Вода является продуктом многих реакций. Например, в реакции нейтрализации и во многих ОВР обязательно образуется вода.
Задание 12.7. Составьте уравнения таких реакций.
Выводы
Водород — самый распространённый химический элемент во Вселенной, а кислород — самый распространённый химический элемент на Земле. Эти вещества проявляют противоположные свойства: водород — восстановитель, а кислород — окислитель. Поэтому они легко реагируют друг с другом, образуя самое удивительное и самое распространённое на Земле вещество — воду.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e12fe5349f06b2c • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Водород: химия водорода и его соединений
Водород
Положение в периодической системе химических элементов
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии :
+1H 1s 1 1s
Атом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Степени окисления атома водорода — от -1 до +1. Характерные степени окисления -1, 0, +1.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Н–Н
Соединения водорода
Основные степени окисления водорода +1, 0, -1.
Типичные соединения водорода:
| Степень окисления | Типичные соединения |
| +1 | кислоты H2SO4, H2S, HCl и др. вода H2O и др. летучие водородные соединения (HCl, HBr) кислые соли (NaHCO3 и др.) основания NaOH, Cu(OH)2 основные соли (CuOH)2CO3 |
| -1 | гидриды металлов NaH, CaH2 и др. |
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов :
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.3. Водород не реагирует с кремнием .
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
1.5. В специальных условиях водород реагирует с углеродом .
1.6. Водород горит , взаимодействует с кислородом со взрывом:
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов . Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например , водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов .
Например , водород взаимодействует с оксидом азота (I):
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварке металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- водород используется для получения аммиака и искусственного жидкого топлива;
- получение твердых жиров (гидрогенизация).
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Способы получения
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
Например , при взаимодействии натрия с водородом образуется гидрид натрия:
2Na + H2 → 2NaH
Гидрид кальция можно получить из кальция и водорода:
Химические свойства
1. Солеобразные гидриды легко разлагаются водой .
Например , гидрид натрия в водной среде разлагается на гидроксид натрия и водород:
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
Например , гидрид натрия реагирует с соляной кислотой с образованием хлорида натрия и водорода:
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
Например , гидрид натрия окисляется кислородом:
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором :
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
http://gomolog.ru/reshebniki/9-klass/eremin-2019/19/4.html
http://chemege.ru/hydrogen/