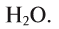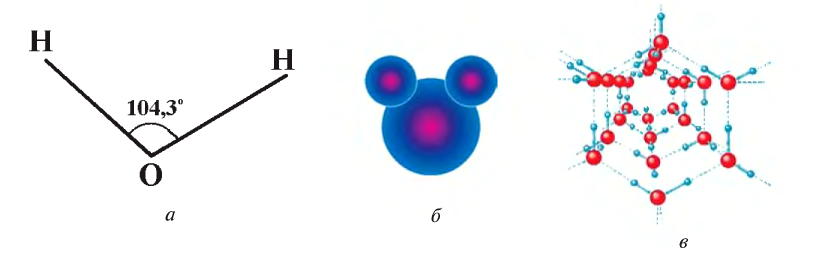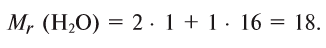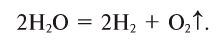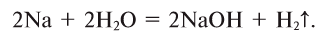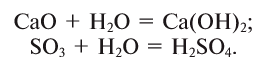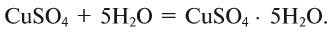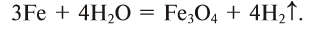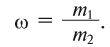Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса с примерами
Содержание:
Вода ее элементный состав, молекулярное строение, формула и молярная масса:
Вода — одно из важнейших химических соединений, широко распространенное на земном шаре.
Вода — это сложное вещество, состоящее из двух атомов водорода и одного атома кислорода (рис. 29).
Молекулярная формула воды —
Относительная молекулярная масса воды равна сумме относительных атомных масс водорода и кислорода:
Следовательно, масса 1 моля воды — 18 г, а молярная масса воды — 18 г/моль.
Вода и её физические свойства
Чистая вода — прозрачная жидкость без цвета, вкуса и запаха. Вкус и запах воде придают растворенные в ней примеси. Многие физические свойства воды очень своеобразны. При соответствующих обстоятельствах они являются аномальными, т.е. отклоняются от привычных. Например, плотность воды при переходе из твердого состояния (лед) в жидкое не уменьшается, как у большинства веществ, а увеличивается (рис. 30). Плотность растет и при нагревании воды от 0°С до + 4°С, достигая своего максимума — 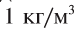
Еще одно свойство воды — это ее высокая теплоемкость (4,18 Дж/кг) (для сравнения: у песка —
0,79; известняка — 0,88; поваренной соли — 0,88; глицерина — 2,43; этилового спирта — 2,85). Поэтому вода в ночное время или при переходе от летнего сезона к зимнему медленно остывает, а в дневное время и при смене зимы летом так же медленно нагревается.
Вода замерзает при 0°С (при этой же температуре лед начинает таять) и превращается в пар (кипит) при 100°С.
Вода, являясь универсальным растворителем, растворяет многие органические и неорганические вещества.
Вода и её химические свойства
Молекулы воды очень устойчивы к нагреванию, но при температуре выше 1000°С пары воды начинают разлагаться на водород и кислород:
Реакционная способность воды очень велика.
Активные металлы, взаимодействуя с водой, выделяют из нее водород:
Рис. 30. Вода и лед
При взаимодействии с водой оксидов многих металлов и неметаллов образуются основания и кислоты:
Некоторые соли образуют с водой соединения, называемые кристаллогидратами:
Нагретое железо вступает в реакцию с парами воды:
Вода катализирует ряд химических процессов: при ее отсутствии «гремучий газ» не взрывается даже при высокой температуре, угарный газ не горит в кислороде, натрий и фосфор не окисляются на воздухе, не взаимодействуют с хлором и не происходит травления стекла фтористым водородом.
Распространение воды в природе
Три четверти поверхности земного шара покрыто водой в виде океанов, морей, озер, рек. Вода распространена в атмосфере в виде паров, на горных вершинах и полюсах — в виде ледников и снега. Существуют также подземные воды, увлажняющие почву и горные породы.
Объем Мирового океана составляет 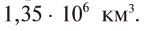
Вода имеет огромное значение в жизни растений, животных и людей. По современным представлениям, происхождение и развитие жизни на Земле было связано с морем. Вода — это среда, которая обеспечивает жизнедеятельность каждого организма посредством химических процессов, в ней протекающих. Кроме того, вода сама участвует в ряде биохимических процессов.
Аномальные физические свойства воды имеют важное значение в обеспечении жизненных процессов. Если бы плотность воды при переходе из жидкого состояния в твердое изменялась так же, как и у других веществ, то с приходом зимы поверхность воды, замерзая при 0°С, оседала бы ниже и уступала бы свое место более теплому слою, который также замерзал бы и оседал на дно. Таким образом вся вода превратилась бы в лед и многие формы жизни прекратили бы свое существование.
Но то, что вода при +4°С обладает максимальной плотностью, не дает происходить подобному явлению, так как обладающий меньшей плотностью лед остается на поверхности воды и предохраняет от замерзания более глубокие теплые слои.
Высокая теплоемкость воды также имеет большое значение для жизни на Земле. На нагревание воды необходимо затратить больше энергии, чем на нагревание любого другого вещества, т.е. вода, поглотившая тепло, нагревается при более низкой температуре, чем любая другая жидкость. Одна третья часть поглощаемой энергии Солнца расходуется на испарение воды Мирового океана и других водных бассейнов.
Вода выполняет специфическую роль терморегулятора и тем самым обеспечивает нормальную жизнедеятельность на поверхности Земли. Водные ресурсы земного шара могут быть как солеными, так и пресными, но все они имеют важное значение для промышленности.
Промышленность приспособлена для потребления в основном пресной воды. По имеющимся сведениям, в год на одного жителя планеты приходится в среднем 8000 л воды. Это количество воды используется как в бытовых, так в сельскохозяйственных и промышленных целях.
Только 10% расходуемой воды приходится на бытовые расходы, а остальное количество затрачивается на промышленность и сельское хозяйство. Для получения 1 кг сахара необходимо 400 л воды, для обработки 1 кг зерна — 1500 л, а для получения 1 кг синтетической резины необходимо примерно 2500 л воды.
В промышленности вода в основном используется как растворитель, охладитель и очиститель.
Пресная вода широко используется в сельском хозяйстве для полива полей и питья в животноводстве.
Повсеместное использование воды в промышленности связано с проблемами возникновения сточных вод и загрязнения окружающей среды. Для решения этих проблем необходим комплексный подход.
Не забывайте, что вода является бесценным богатством!
Меры по сохранению водных ресурсов от загрязнения
Для жизнедеятельности (т.е. для бытовых нужд, сельского хозяйства и промышленности) используют воды озер, рек, подземные воды и воды искусственных водоемов. Для водообеспечения большое значение имеет сохранение чистоты воды, которая загрязняется, проходя через систему канализационных сетей, промышленных предприятий, подвергаясь «обработке» путем смыва химических средств с полей.
Возвращаемые в водоемы сточные воды должны проходить соответствующую очистку, поскольку они могут быть загрязнены выбросами ферм, мусоросборников, городской канализацией, дренажными водами, остатками минеральных удобрений, инсектицидами, гербицидами, отходами больниц, торговых предприятий, общественного питания, заводов, фабрик и лабораторий. Такие воды должны быть подвергнуты многоступенчатой очистке. Сначала вода пропускается через механические фильтры, на которых задерживаются песок и другие частицы. Мелкие же частицы и многие бактерии осаждаются путем добавления в воду сначала извести, а затем сульфата алюминия. При пропускании воздуха через такую воду в ней усиливается разложение органических веществ. На последней стадии, чтобы очистить воду от бактерий, ее обрабатывают озоном или хлором. После такой стерилизации воду можно использовать для потребления.
При применении данного метода очистки вода очищается от вредных веществ. Но в некоторых случаях появляется необходимость ее очистки от ионов кальция и магния, повышающих жесткость воды. Эти ионы в сочетании с мылом образуют в воде нерастворимые соединения, отрицательно влияющие на эффективность синтетических моющих веществ. Такая вода при кипячении дает накипь. Многие подземные воды подвергаются такой очистке, потому что в результате взаимодействия известняка, а также других соединений магния и кальция содержание их ионов в воде возрастает. Эта вода обрабатывается гашеной или негашеной известью, а также содой. Потом проводят ее обработку квасцами. Такая вода полностью готова к употреблению.
Для очистки сточных вод существует особый способ, состоящий из трех стадий. На первой стадии очистку проходят 30% воды, на второй 60%, 10% воды не подвергаются очистке. При этом на первой стадии фильтрованием отделяются крупные твердые частицы, 60% которых могут выпасть в осадок. Если не подвергать такую воду вторичной очистке, то следует провести ее обеззараживание хлором и отправить в водоем.
При вторичной очистке посредством воздуха разлагаются органические вещества, увеличивается количество аэробных бактерий, которые, питаясь остатками органических веществ, очищают воду. Затем они осаждаются, а вода подвергается обработке хлором и сливается в водоем. На этой стадии можно осадить до 90% твердых частиц.
Вода, прошедшая первичную и вторичную обработку, может содержать значительное количество соединений фосфора и азота, что приводит к размножению водорослей в водоемах. Помимо этого, многие химические вещества, содержащиеся в сточных водах, пройдя эти стадии очистки, могут снова загрязнять окружающую среду и водные бассейны.
Однако полная очистка воды от многих металлов и органических веществ — очень дорогостоящая процедура. Поэтому вода в незначительных количествах подвергается третичной обработке, при которой с помощью специальных средств такие примеси ликвидируются.
Вода — один из лучших растворителей
Вода имеет огромное значение в жизни и практической деятельности человека. Процесс усвоения пищи связан с переводом питательных веществ в растворимые формы посредством воды. Все физиологически важные жидкости (кровь, лимфа и др.) — водные растворы. В основе многих сфер производственной деятельности лежат процессы, в которых используются водные растворы.
Жидкие растворы — это жидкие гомогенные (однородные) системы, состоящие из двух или более компонентов.
Общая поверхность Земли составляет 510100000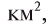
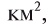
В природе вода широко распространена в виде растворенных в ней солей. Такие реки, как Ганг или Миссисипи, растворяют до 100 млн т солей в год, а все реки мира — 2,735 млрд т солей.
Почти все вещества растворяются в воде (рис. 31): некоторые — очень хорошо, другие — средне, а остальные — плохо.
Проходя через нижние слои атмосферы, дождевая вода может растворить значительное количество различных веществ. При выпаривании 1000 г дождевой воды остается 3—5 г твердого осадка.
Растворенные и попавшие в почву вещества, химически взаимодействуя с компонентами почвы и горных пород, активно участвуют в непрерывном процессе образования почвы и минералов, разрушения горных пород.
Рис. 31. Растворение различных веществ в воде:
1 — хлорид кальция; 2 — перманганат калия; 3 — пищевая соль; 4 — бихромат калия;5 — карбонат натрия; 6 — бертолетова соль
Рис. 32. Растворение сахара в воде
Вода — универсальный растворитель, который может растворять и газы (кислород, водород, углекислый газ и др.), и жидкости (спирт, кислоты и др.), и твердые вещества (соли, минералы и др.).
В воде растворяются в небольшом количестве даже те вещества, которые, казалось бы, совсем не растворяются в ней. К.В. Шееле, кипятя в течение 12 дней в колбе дистиллированную снеговую воду, отметил небольшое разъедание стенок колбы. А. Лавуазье, кипятя определенное количество воды в колбе в течение 101 дня, заметил, что масса сосуда уменьшилась на определенное число, а масса осадка, полученного после выпаривания воды, равняется этому числу. Следовательно, даже стекло незначительно растворяется в воде.
Способность вещества растворяться называется растворимостью.
Например, понаблюдаем растворение сахара в воде (рис. 32). При комнатной температуре (20°С) в 100 г воды может раствориться 200 г сахара. Большее количество сахара при этой температуре не растворится. Такой раствор называется насыщенным.
Мера растворимости определяется количеством вещества в насыщенном растворе при определенных условиях.
Растворимость определяется растворением вещества в 100 г растворителя. Если в растворителе растворяется больше 10 г вещества, то оно считается хорошо растворимым, если меньше 1 г — малорастворимым, если меньше 0,01 г — практически нерастворимым.
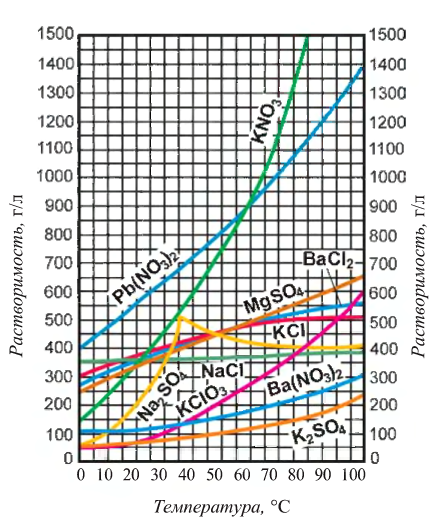
Растворимость многих твердых веществ возрастает с повышением температуры. Эту зависимость можно представить в виде графика (рис. 33).
Растворимость газов при повышении температуры уменьшается (при кипячении воды растворенные в ней газы выделяются).
Рис. 33. Кривые растворимости различных солей
Но повышение давления приводит к возрастанию их растворимости (открывая бутылку минеральной воды, мы уменьшаем давление внутри сосуда, и поэтому растворенный в ней углекислый газ начинает интенсивно выделяться).
Понятие о растворах и их концентрациях
Раствор — это однородная система, состоящая из растворителя, растворенного вещества и продуктов их взаимодействия.
Вещество в растворе измельчено до молекул, атомов или других частиц и равномерно распределено между молекулами растворителя, так как размеры частиц растворенного вещества составляют 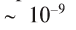
Растворы бывают жидкими, твердыми и газообразными. Примерами жидких растворов могут быть водные растворы соли, сахара, спирта; твердых растворов — золотометаллические изделия, сплавы типа дюралюминия; газообразных растворов — воздух или другие смеси газов.
При образовании растворов наблюдается выделение или поглощение тепла. Растворы могут хорошо проводить или не проводить электрический ток.
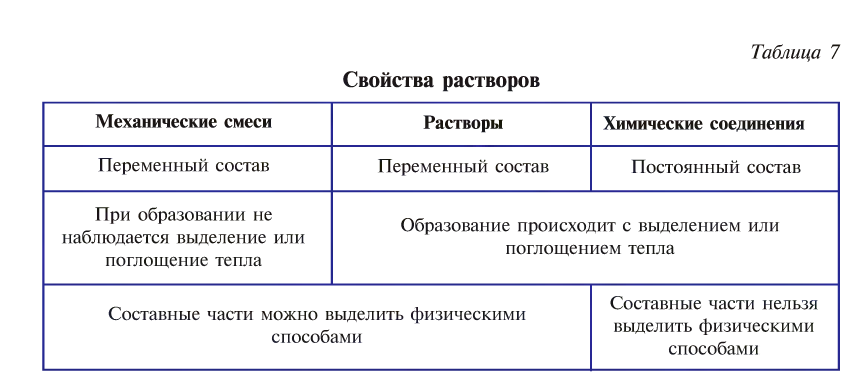
Растворы обладают свойствами как механических смесей, так и химических соединений (табл. 7).
При практическом применении растворов важное значение имеет точное определение количества вещества, растворенного в общей массе раствора.
Состав раствора (в частности, количество растворенного вещества) можно установить различными способами и выразить в размерных величинах (концентрациях).
Когда речь идет о компонентах раствора, под ними подразумеваются чистые вещества, при смешивании которых образуется раствор. При этом большее количество вещества принимается за растворитель, а меньшее — за растворенное вещество (рис. 34).
Эти термины были приняты для удобства, потому что при смешивании двух компонентов их нельзя строго разделять. При образовании раствора из чистой жидкости и твердого вещества обычно за растворитель принимается жидкий компонент. Независимо от того, что является растворенным веществом — газ, жидкость или твердое тело, — когда мы говорим о составе раствора, то обязаны учитывать отношение растворенного вещества к раствору. Это относительное количество называется концентрацией и выражается в различных величинах.
Обычно в химии концентрация выражается:
- — в массовых долях вещества, растворенного в одной весовой части раствора;
- — в процентах растворенного вещества, содержащегося в 100 г раствора;
- — в молях или эквивалентах растворенного вещества, содержащегося в 1 л раствора.
Рис.34 Соли (а)и их растворы (б)
Массовая доля, процентная, молярная и нормальная концентрация вещества в растворе
Как уже было сказано при изучении предыдущей темы, при определении состава раствора необходимо учитывать природу и количество его компонентов.
Насыщенный раствор — это раствор, который при данной температуре не может растворить большего количества вещества.
Ненасыщенный раствор — это раствор, который при данной температуре продолжает растворять вещество.
Если количество растворенного вещества очень мало, то такой раствор называется разбавленным.
Если количество растворенного вещества будет достаточно высоким, то такой раствор называется концентрированным (рис. 35).
В химии в основном пользуются ненасыщенными растворами.
Рис. 35. Взаимодействие цинка с растворами серной кислоты различной концентрации
В химической практике для выражения количества растворенного вещества широко применяются следующие величины:
1. Массовая доля 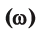
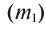
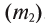
2. Процентная концентрация (С%) — выражение в процентах отношения массы растворенного вещества 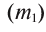
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Как составлять ионные уравнения. Задача 31 на ЕГЭ по химии
Достаточно часто школьникам и студентам приходится составлять т. н. ионные уравнения реакций. В частности, именно этой теме посвящена задача 31, предлагаемая на ЕГЭ по химии. В данной статье мы подробно обсудим алгоритм написания кратких и полных ионных уравнений, разберем много примеров разного уровня сложности.
Зачем нужны ионные уравнения
Напомню, что при растворении многих веществ в воде (и не только в воде!) происходит процесс диссоциации — вещества распадаются на ионы. Например, молекулы HCl в водной среде диссоциируют на катионы водорода (H + , точнее, H 3 O + ) и анионы хлора (Cl — ). Бромид натрия (NaBr) находится в водном растворе не в виде молекул, а в виде гидратированных ионов Na + и Br — (кстати, в твердом бромиде натрия тоже присутствуют ионы).
Записывая «обычные» (молекулярные) уравнения, мы не учитываем, что в реакцию вступают не молекулы, а ионы. Вот, например, как выглядит уравнение реакции между соляной кислотой и гидроксидом натрия:
HCl + NaOH = NaCl + H 2 O. (1)
Разумеется, эта схема не совсем верно описывает процесс. Как мы уже сказали, в водном растворе практически нет молекул HCl, а есть ионы H + и Cl — . Так же обстоят дела и с NaOH. Правильнее было бы записать следующее:
H + + Cl — + Na + + OH — = Na + + Cl — + H 2 O. (2)
Это и есть полное ионное уравнение . Вместо «виртуальных» молекул мы видим частицы, которые реально присутствуют в растворе (катионы и анионы). Не будем пока останавливаться на вопросе, почему H 2 O мы записали в молекулярной форме. Чуть позже это будет объяснено. Как видите, нет ничего сложного: мы заменили молекулы ионами, которые образуются при их диссоциации.
Впрочем, даже полное ионное уравнение не является безупречным. Действительно, присмотритесь повнимательнее: и в левой, и в правой частях уравнения (2) присутствуют одинаковые частицы — катионы Na + и анионы Cl — . В процессе реакции эти ионы не изменяются. Зачем тогда они вообще нужны? Уберем их и получим краткое ионное уравнение:
H + + OH — = H 2 O. (3)
Как видите, все сводится к взаимодействию ионов H + и OH — c образованием воды (реакция нейтрализации).
Все, полное и краткое ионные уравнения записаны. Если бы мы решали задачу 31 на ЕГЭ по химии, то получили бы за нее максимальную оценку — 2 балла.
Итак, еще раз о терминологии:
- HCl + NaOH = NaCl + H 2 O — молекулярное уравнение («обычное» уравнения, схематично отражающее суть реакции);
- H + + Cl — + Na + + OH — = Na + + Cl — + H 2 O — полное ионное уравнение (видны реальные частицы, находящиеся в растворе);
- H + + OH — = H 2 O — краткое ионное уравнение (мы убрали весь «мусор» — частицы, которые не участвуют в процессе).
Алгоритм написания ионных уравнений
- Составляем молекулярное уравнение реакции.
- Все частицы, диссоциирующие в растворе в ощутимой степени, записываем в виде ионов; вещества, не склонные к диссоциации, оставляем «в виде молекул».
- Убираем из двух частей уравнения т. н. ионы-наблюдатели, т. е. частицы, которые не участвуют в процессе.
- Проверяем коэффициенты и получаем окончательный ответ — краткое ионное уравнение.
Пример 1 . Составьте полное и краткое ионные уравнения, описывающие взаимодействие водных растворов хлорида бария и сульфата натрия.
Решение . Будем действовать в соответствии с предложенным алгоритмом. Составим сначала молекулярное уравнение. Хлорид бария и сульфат натрия — это две соли. Заглянем в раздел справочника «Свойства неорганических соединений». Видим, что соли могут взаимодействовать друг с другом, если в ходе реакции образуется осадок. Проверим:
BaCl 2 + Na 2 SO 4 = BaSO 4 ↓ + 2NaCl.
Таблица растворимости подсказывает нам, что BaSO 4 действительно не растворяется в воде (направленная вниз стрелка, напомню, символизирует, что данное вещество выпадает в осадок). Молекулярное уравнение готово, переходим к составлению полного ионного уравнения. Обе соли, присутствующие в левой части, записываем в ионной форме, а вот в правой части оставляем BaSO 4 в «молекулярной форме» (о причинах этого — чуть позже!) Получаем следующее:
Ba 2+ + 2Cl — + 2Na + + SO 4 2- = BaSO 4 ↓ + 2Cl — + 2Na + .
Осталось избавиться от балласта: убираем ионы-наблюдатели. В данном случае в процессе не участвуют катионы Na + и анионы Cl — . Стираем их и получаем краткое ионное уравнение:
Ba 2+ + SO 4 2- = BaSO 4 ↓.
А теперь поговорим подробнее о каждом шаге нашего алгоритма и разберем еще несколько примеров.
Как составить молекулярное уравнение реакции
Должен сразу вас разочаровать. В этом пункте не будет однозначных рецептов. Действительно, вряд ли можно рассчитывать, что я смогу разобрать здесь ВСЕ возможные уравнения реакций, которые могут встретиться вам на ЕГЭ или ОГЭ по химии.
Ваш помощник — раздел «Свойства неорганических соединений». Если вы хорошо знакомы с четырьмя базовыми классами неорганических веществ (оксиды, основания, кислоты, соли), если вам известны химические свойства этих классов и методы их получения, можете на 95% быть уверены в том, что у вас не будет проблем на экзамене с написанием молекулярных уравнений.
Оставшиеся 5% — это некоторые «специфические» реакции, которые мы не сможем перечислить. Не будем лить слез по поводу этих 5%, а вспомним лучше номенклатуру и химические свойства базовых классов неорганических веществ. Три задания для самостоятельной работы:
Упражнение 1 . Напишите молекулярные формулы следующих веществ: оксид фосфора (V), нитрат цезия, сульфат хрома (III), бромоводородная кислота, карбонат аммония, гидроксид свинца (II), фосфат стронция, кремниевая кислота. Если при выполнении задания у вас возникнут проблемы, обратитесь к разделу справочника «Названия кислот и солей».
Упражнение 2 . Дополните уравнения следующих реакций:
- KOH + H 2 SO 4 =
- H 3 PO 4 + Na 2 O=
- Ba(OH) 2 + CO 2 =
- NaOH + CuBr 2 =
- K 2 S + Hg(NO 3 ) 2 =
- Zn + FeCl 2 =
Упражнение 3 . Напишите молекулярные уравнения реакций (в водном растворе) между: а) карбонатом натрия и азотной кислотой, б) хлоридом никеля (II) и гидроксидом натрия, в) ортофосфорной кислотой и гидроксидом кальция, г) нитратом серебра и хлоридом калия, д) оксидом фосфора (V) и гидроксидом калия.
Искренне надеюсь, что у вас не возникло проблем с выполнением этих трех заданий. Если это не так, необходимо вернуться к теме «Химические свойства основных классов неорганических соединений».
Как превратить молекулярное уравнение в полное ионное уравнение
Начинается самое интересное. Мы должны понять, какие вещества следует записывать в виде ионов, а какие — оставить в «молекулярной форме». Придется запомнить следующее.
В виде ионов записывают:
- растворимые соли (подчеркиваю, только соли хорошо растворимые в воде);
- щелочи (напомню, что щелочами называют растворимые в воде основания, но не NH 4 OH);
- сильные кислоты (H 2 SO 4 , HNO 3 , HCl, HBr, HI, HClO 4 , HClO 3 , H 2 SeO 4 , . ).
Как видите, запомнить этот список совсем несложно: в него входят сильные кислоты и основания и все растворимые соли. Кстати, особо бдительным юным химикам, которых может возмутить тот факт, что сильные электролиты (нерастворимые соли) не вошли в этот перечень, могу сообщить следующее: НЕвключение нерастворимых солей в данный список вовсе не отвергает того, что они являются сильными электролитами.
Все остальные вещества должны присутствовать в ионных уравнениях в виде молекул. Тем требовательным читателям, которых не устраивает расплывчатый термин «все остальные вещества», и которые, следуя примеру героя известного фильма, требуют «огласить полный список» даю следующую информацию.
В виде молекул записывают:
- все нерастворимые соли;
- все слабые основания (включая нерастворимые гидроксиды, NH 4 OH и сходные с ним вещества);
- все слабые кислоты (H 2 СO 3 , HNO 2 , H 2 S, H 2 SiO 3 , HCN, HClO, практически все органические кислоты . );
- вообще, все слабые электролиты (включая воду. );
- оксиды (всех типов);
- все газообразные соединения (в частности, H 2 , CO 2 , SO 2 , H 2 S, CO);
- простые вещества (металлы и неметаллы);
- практически все органические соединения (исключение — растворимые в воде соли органических кислот).
Уф-ф, кажется, я ничего не забыл! Хотя проще, по-моему, все же запомнить список N 1. Из принципиально важного в списке N 2 еще раз отмечу воду.
Пример 2 . Составьте полное ионное уравнение, описывающие взаимодействие гидроксида меди (II) и соляной кислоты.
Решение . Начнем, естественно, с молекулярного уравнения. Гидроксид меди (II) — нерастворимое основание. Все нерастворимые основания реагируют с сильными кислотами с образованием соли и воды:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O.
А теперь выясняем, какие вещества записывать в виде ионов, а какие — в виде молекул. Нам помогут приведенные выше списки. Гидроксид меди (II) — нерастворимое основание (см. таблицу растворимости), слабый электролит. Нерастворимые основания записывают в молекулярной форме. HCl — сильная кислота, в растворе практически полностью диссоциирует на ионы. CuCl 2 — растворимая соль. Записываем в ионной форме. Вода — только в виде молекул! Получаем полное ионное уравнение:
Сu(OH) 2 + 2H + + 2Cl — = Cu 2+ + 2Cl — + 2H 2 O.
Пример 3 . Составьте полное ионное уравнение реакции диоксида углерода с водным раствором NaOH.
Решение . Диоксид углерода — типичный кислотный оксид, NaOH — щелочь. При взаимодействии кислотных оксидов с водными растворами щелочей образуются соль и вода. Составляем молекулярное уравнение реакции (не забывайте, кстати, о коэффициентах):
CO 2 + 2NaOH = Na 2 CO 3 + H 2 O.
CO 2 — оксид, газообразное соединение; сохраняем молекулярную форму. NaOH — сильное основание (щелочь); записываем в виде ионов. Na 2 CO 3 — растворимая соль; пишем в виде ионов. Вода — слабый электролит, практически не диссоциирует; оставляем в молекулярной форме. Получаем следующее:
СO 2 + 2Na + + 2OH — = Na 2+ + CO 3 2- + H 2 O.
Пример 4 . Сульфид натрия в водном растворе реагирует с хлоридом цинка с образованием осадка. Составьте полное ионное уравнение данной реакции.
Решение . Сульфид натрия и хлорид цинка — это соли. При взаимодействии этих солей выпадает осадок сульфида цинка:
Na 2 S + ZnCl 2 = ZnS↓ + 2NaCl.
Я сразу запишу полное ионное уравнение, а вы самостоятельно проанализируете его:
2Na + + S 2- + Zn 2+ + 2Cl — = ZnS↓ + 2Na + + 2Cl — .
Предлагаю вам несколько заданий для самостоятельной работы и небольшой тест.
Упражнение 4 . Составьте молекулярные и полные ионные уравнения следующих реакций:
- NaOH + HNO 3 =
- H 2 SO 4 + MgO =
- Ca(NO 3 ) 2 + Na 3 PO 4 =
- CoBr 2 + Ca(OH) 2 =
Упражнение 5 . Напишите полные ионные уравнения, описывающие взаимодействие: а) оксида азота (V) с водным раствором гидроксида бария, б) раствора гидроксида цезия с иодоводородной кислотой, в) водных растворов сульфата меди и сульфида калия, г) гидроксида кальция и водного раствора нитрата железа (III).
В следующей части статьи мы научимся составлять краткие ионные уравнения и разберем большое количество примеров. Кроме того, мы обсудим специфические особенности задания 31, которое вам предстоит решать на ЕГЭ по химии.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e033ecceb7d16df • Your IP : 85.95.188.35 • Performance & security by Cloudflare
http://www.repetitor2000.ru/ionnye_uravnenija_01.html
http://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/339.html