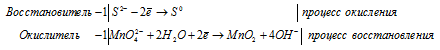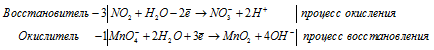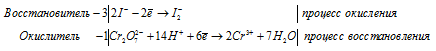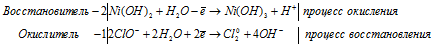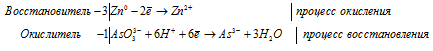Окислитель — перманганат калия.
Окислитель – это частица (атом, молекула), которые присоединяют к себе электроны. Перманганат калия (KMnO4) является типичным окислителем, в котором Mn имеет максимальную степень окисления — +7. Чаще всего его используют в лабораториях.
KMnO4 представляет собой растворимую соль, имеющую фиолетовый цвет.
Соли-перманганаты существуют только в растворах. Все соли (металл — щелочные металлы, аммоний, серебро и алюминий) растворимы в воде и образуют фиолетово-черные кристаллы.
При нагревании перманганаты разлагаются до манганатов:
В кислой среде он восстанавливается до Mn +2 :
В щелочной среде – до Mn +6 :
В нейтральной среде – до Mn +4 :
Применение перманганата калия.
Перманганат калия чаще всего используют в медицине. В зависимости от концентрации он оказывает различное воздействие на кожу: либо прижигающее, либо вяжущее. Так как перманганат при разложении дает свободный кислород (активный) его часто используют при обработке глубоких инфекционных ран.
Составление уравнений в ионно-молекулярной форме
S 2 — + MnO4 2- + 2H2O = MnO2 + S 0 + 4OH —
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
4K + + S 2- + MnO4 2- + 2H2O = S + MnO2 + 4K + + 4OH — .
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Для уравнивания добавим в уравнение 1 моль K2SO4, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
3Zn 0 + AsO3 3- + 6H + = 3Zn 2+ + As 3- + 3H2O.
После приведения членов обеих частей уравнения, получим:
Составьте полное ионное уравнение окислительно-восстановительной реакции и определите, насколько полно пойдет процесс.
Составьте полное ионное уравнение окислительно-восстановительной реакции и определите, насколько полно пойдет процесс.
При составлении полного уравнения окислительно-восстановительной реакции рекомендуется придерживаться следующего порядка:
1) Выписываем стандартные окислительно-восстановительные потенциалы и определяем, какая частица будет обладать наибольшими окислительными и какая наибольшими восстановительными свойствами.
E°(MnO 4– +8H + /Mn 2+ +4H2O) = 1,51B; E°(NO 3– +2H + /NO 2– +H2O) = 0,94В
Так как E1>E2, наибольшими окислительными свойствами будет обладать MnO 4– , а восстановительными NO 2– .
2) Записываем схемы превращения для окислителя и восстановителя.
3) Составляем полуреакции, для этого уравниваем количество атомов в левой и правой части. В кислой среде кислород добавляется в виде молекул воды.
4) Подсчитываем суммарный заряд в левой и правой частях полуреакций.
MnO 4– + 8H + (+7) / Mn 2+ + 4H2O (+2); NO2 – + H2O (–1) / NO 3– + 2H + (+1)
5) Уравниваем заряд левой и правой части. В данных полуреакциях для выравнивания заряда требуется в первой полуреакции слева добавить 5 электронов, а от второй отнять два электрона:
MnO 4– + 8H + + 5ē → Mn 2+ + 4H2O
NO 2– + H2O – 2ē → NO 3– + 2H +
6) Составляем полное ионное уравнение. Учитывая, что электронный обмен является эквивалентным по правилу наименьшего кратного, определяем количество перераспределенных электронов, почленно перемножаем полуреакции на найденные коэффициенты, суммируем их и записываем полное ионное уравнение:
2 | MnO 4– + 8H + + 5ē → Mn 2+ + 4H2O
2MnO 4– + 16H + + 5NO2 – + 5H2O → 2Mn 2+ + 8H2O + 5NO3 – + 10H+
7) Сокращаем одноименные частицы в левой и правой частях уравнения.
2MnO 4– + 6H + + 5NO 2– → 2Mn 2+ + 3H2O + 5NO3 –
8) Переходим от полного ионного уравнения к молекулярному. Для этого по левой части уравнения смотрим, какие ионы и в каком количестве могут присоединяться из тех, которые есть в растворе. Столько же ионов добавляем к правой части.
2K + + 3SO4 2– + 5Na + → 2K + + 3SO4 2– + 5Na +
9) Для того, чтобы определить насколько полно протекает процесс, необходимо рассчитать Kp, которая показывает, во сколько раз продуктов реакции больше, чем реагентов. Kp рассчитывается по уравнению:
Kp= 
реакции n = 10; ∆Е – ЭДС реакции.
Для расчета ∆Е реакции из стандартного потенциала пары, обладающей наибольшими окислительными свойствами, отнимают потенциал пары, обладающей наибольшими восстановительными свойствами.
Kp = = 
Величина Kp свидетельствует о большом смещении равновесия в сторону образования продуктов реакции.
http://buzani.ru/zadachi/khimiya-glinka/1213-uravneniya-v-ionno-molekulyarnoj-forme-zadachi-631-632
http://einsteins.ru/subjects/chemistry/zadachi-chemistry/resheno-381