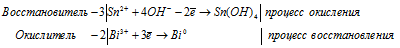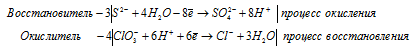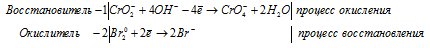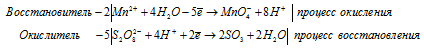Составление уравнений окислительно-восстановительного процесса в молекулярной и ионной форме
Задача 640.
Закончить уравнения реакций, записать их в ионно-молекулярной форме:
а) BiCl3 + SnCl2 + KOH → Bi +
б) NaClO3 + H2S → H2SO4 +
в) KCrO2 + Br2 + KOH →
г) MnSO4 + (NH4)2S2O8 + H2SO4 → HMnO4 +
Решение:
а) BiCl3 + SnCl2 + KOH → Bi +
Ионно-молекулярная форма процесса:
2Bi 3+ + 3Sn 2+ + 12OH — = 3Sn(OH)4 + 2Bi 0
Молекулярная форма будет иметь вид:
2BiCl3 + 3SnCl2 +12KOH = Bi + 3Sn(OH)4 + 12KCl.
2Bi 3+ + 3Sn 2+ + 12OH — + 12Cl — + 12K + = 3Sn(OH)4 + 2Bi 0 + 12K + + 12Cl — .
Сокращенная ионно-молекулярная форма процесса:
2Bi 3+ + 3Sn 2+ + 12OH — = 3Sn(OH)4 + 2Bi 0 .
Ионно-молекулярная форма процесса:
3S 2- + 4ClO3 — + 12H2O + 24H + = 4Cl — + 3SO4 2- + 12H2O + 24H +
После приведения членов в обеих частях равенства получим молекулярную форму:
4Na + + 4ClO3 — + 6H + + 3S 2- = 6H + + 3SO4 2- + 4Na + + 4Cl — .
Сокращённая ионно-молекулярная форма:
в) KCrO2 + Br2 + KOH →
Ионно-молекулярная форма процесса:
Молекулярная форма процесса:
5K + + CrO2 — + 2Br2 0 + 4OH — = 5K + + 4Br — + CrO4 — + 2H2O.
Сокращённая ионно-молекулярная форма:
Ионно-молекулярная форма процесса:
После приведения членов в обеих частях равенства получим:
Молекулярная форма процесса:
Для уравнивания атомов водорода и группы SO4 добавим в левую часть равенства одну молекулу H2SO4, получим:
Помогите пжлстсоставьте полные и сокращенные ионные уравнения реакций взаимодействия so2 и h2so3 с водой, основными оксидами, основаниями, растворимыми солями?
Химия | 5 — 9 классы
составьте полные и сокращенные ионные уравнения реакций взаимодействия so2 и h2so3 с водой, основными оксидами, основаниями, растворимыми солями.
SO2 + H2O = H2SO3
SO2 + H2O = 2H[ + ] + SO3[2 — ]
SO2 + CaO = CaSO3
SO2 + 2NaOH = Na2SO3 + H2O
So2 + 2Na[ + ] + 2OH[ — ] = 2Na[ + ] + SO3[2 — ] + H2O
SO2 + 2OH[ — ] = SO3[2 — ] + H2O
H2SO3 + MgO = MgSO3 + H2O
H2SO3 + MgCl2 = MgSO3 + 2Hcl
2H[ + ] + sO3[2 — ] + Mg[2 + ] + 2Cl[ — ] = MgSO3 + 2H[ + ] + 2Cl[ — ]
Mg[2 + ] + So3[2 — ] = MgSO3
H2SO3 + 2NaOH = Na2SO3 + 2H2O
2H[ + ] + SO3[2 — ] + 2Na[ + ] + 2OH[ — ] = 2Na[ + ] + SO3[2 — ] + 2H2O
2H[ + ] + 2OH[ — ] = 2H2O.
Составте полное и сокращеное ионное уравнение реакций взаимодействия SO2 и aH2SO3 с водой, основными оксидами, основаниями, растворами солями?
Составте полное и сокращеное ионное уравнение реакций взаимодействия SO2 и aH2SO3 с водой, основными оксидами, основаниями, растворами солями.
Назовите продукты этих реакций.
1. Основание образется при взаимодействии с водой оксида, формула которого : 1)Fe2P3 3)CaO 2)CuO 4)FeO Ответ : ?
1. Основание образется при взаимодействии с водой оксида, формула которого : 1)Fe2P3 3)CaO 2)CuO 4)FeO Ответ : .
Запишите уравнение реакции 2.
С Гидроксидом натрия реагирует : 1)CaO 3)SiO2 2)N2O 4)P2O5 Ответ : .
3. Составьте уравнения возможных реакций.
1)Молекулярное уравнение : Полное ионное уравнение : Сокращенное ионное уравнение : 2)Молекулярное уранение : Полное ионное уравнение : Сокращенное уравнение : 4.
С соляной кислотой реагирует : 1)Оксид железа(III) 3)Оксид кремния (IV) 2)Оксид серы(VI) 4)Оксид меди(II) Ответ : .
5. Составьте уравнения возможных реакций : 1)Молекулярное уранение : Полное ионное уравнение : Сокращенное ионное уравнение : 2)Молекулярное уранение : Полное ионное уранение : Сокращенное ионное уранение : 6.
Запишите по одному уравнению реакций соединения и разложения для получения : 1)Оксида меди (II) 2)Оксида кремния(IV).
Допишите уравнение реакции и составьте полное и сокращенное ионное уравнение?
Допишите уравнение реакции и составьте полное и сокращенное ионное уравнение.
Помогите пожалуйста?
Гидроксид лития LiOH имеет основный характер и является основание — щелочью.
Взаимодействует ( напишите уравнения возможных реакций в молекулярной, полной и сокращенной ионной формах) :
б) с солью, если «стрелочка вверх»
в) с солью, если «стрелочка вниз»
г) с кислотным оксидом.
Составить уравнение реакций : кислотный оксид + основной оксид : соль + соль : основание + соль?
Составить уравнение реакций : кислотный оксид + основной оксид : соль + соль : основание + соль.
Составьте уравнение реакции в молекулярном виде к реакциям обмена составьте полное и сокращенное ионное уравнение?
Составьте уравнение реакции в молекулярном виде к реакциям обмена составьте полное и сокращенное ионное уравнение.
Помогите пожалуйста сделать полное ионое и неполное ионое уравнение Типичные реакции основных оксидов 1 Основный оксид + кислота = соль + вода (реакция обмена) 3Na2O + 2H3PO4 = 2Na3PO4 = 3H2O 2 Основн?
Помогите пожалуйста сделать полное ионое и неполное ионое уравнение Типичные реакции основных оксидов 1 Основный оксид + кислота = соль + вода (реакция обмена) 3Na2O + 2H3PO4 = 2Na3PO4 = 3H2O 2 Основный оксид + Кислотный оксид = соль (реакция соединения) CaO + N2O5 = Ca(NO3)2 3 Основный оксид + ВОДА = ЩЕЛОЧИ (реакция соединения) К2О + Н2О = 2КОН Типичные реакции кислотных оксидов 1 Кислотные оксиды + основания = соль + вода (реакция обмена) SO2 + 2NaOH = Na2SO3 + H2O 2 Кислотный оксид + Основный оксид = соль (реакция соединения) K2O + SO3 = K2SO4 3 Кислотный оксид + ВОДА = ЩЕЛОЧИ (реакция соединения) N2O5 + H2O = 2HNO3 пожалуйста очень срочно.
Решите молекулярные полные и сокращенные ионные уравнения взаимодействия орфографичний кислоты с оксидом кальция?
Решите молекулярные полные и сокращенные ионные уравнения взаимодействия орфографичний кислоты с оксидом кальция.
Основный оксид + кислотный оксид = соль (2 примера) ; кислотный оксид (растворимый) + вода = кислота ; кислотный оксид + основание = соль + вода?
Основный оксид + кислотный оксид = соль (2 примера) ; кислотный оксид (растворимый) + вода = кислота ; кислотный оксид + основание = соль + вода.
ДОПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ И СОСТАВЬТЕ ПОЛНОЕ И СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ : KOH + CuCI =?
ДОПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ И СОСТАВЬТЕ ПОЛНОЕ И СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ : KOH + CuCI =.
Вы находитесь на странице вопроса Помогите пжлстсоставьте полные и сокращенные ионные уравнения реакций взаимодействия so2 и h2so3 с водой, основными оксидами, основаниями, растворимыми солями? из категории Химия. Уровень сложности вопроса рассчитан на учащихся 5 — 9 классов. На странице можно узнать правильный ответ, сверить его со своим вариантом и обсудить возможные версии с другими пользователями сайта посредством обратной связи. Если ответ вызывает сомнения или покажется вам неполным, для проверки найдите ответы на аналогичные вопросы по теме в этой же категории, или создайте новый вопрос, используя ключевые слова: введите вопрос в поисковую строку, нажав кнопку в верхней части страницы.
4Fe⁺²(OH)₂ + O₂⁰ + 2H₂O = 4Fe⁺³(O⁻²H)₃ Fe⁺² — e⁻ = Fe⁺³ |4 — восстановитель, процесс окисления O₂⁰ + 4e⁻ = 2O⁻² | 1 — окислитель, процесс восстановления.
Экономическая реакция Скорей всего.
Экзотермическая реакция (т. К. они протекают с выделением энергии).
Просто писать лень нашёл.
HxClyOz x : y : z = 1 / 1 : 35 / 35, 5 : 64 / 16 = 1 : 1 : 4 HClO4 — хронаякислота.
2NaHCO₃ (t) = Na₂CO₃ + CO₂↑ + H₂O↑ H₂ + Cl₂ = 2HCl.
Mr(C8H18) = 8 * 12 + 18 * 1 = 114 W(C) = 98 / 114 = 0. 84 = 84% W(H) = 18 / 114 = 0. 16 = 16% Mr(C10H22) = 10 * 12 + 22 * 1 = 142 W(C) = 120 / 142 = 0. 85 = 85% W(H) = 22 / 142 = 0. 15 = 15%.
Вот держи. Только третий не знаю как сделать.
Б) и д) в обоих случаях сначала( при акуратном добавлении) образуется гидроксид цинка, который позже реагирует с избытком реагента и образуется тетрагидроксоцинкат натрия (б) или гидроксид тетраамминцинка(||) (д).
Оксиды : CaO — оксид кальция K2O — оксид калия Кислоты : H2S — сероводородная кислота HCl — соляная кислота H2SO3 — сернистая кислота Основания : Cu(OH)2 — гидроксид меди(2) NaOH — гидроксид натрия Соли : CuSO4 — сульфат меди(2) BaSO4 — сульфат бария..
Реакции ионного обмена
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
| Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит. |
| Например, нитрат серебра взаимодействует с бромидом калия |
AgNО3 + КВr = АgВr↓ + КNО3
Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe 3+ + 3OH — = Fe(OH)3
На ионы мы не разбиваем:
- Оксиды; осадки; газы; воду; слабые электролиты (кислоты и основания)
- Анионы кислотных остатков кислых солей слабых кислот (НСО3 — , Н2РО4 — и т.п.) и катионы основных солей слабых оснований Al(OH) 2+
- Комплексные катионы и анионы: [Al(OH)4] —
| Например, взаимодействие сульфида цинка и серной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H + + SO4 2 — = Zn 2+ + SO4 2 — + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H + = Zn 2+ + H2S
| Например, взаимодействие гидрокарбоната натрия и гидроксида натрия |
Составляем уравнение реакции и проверяем растворимость всех веществ:
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na + + НСО3 — + Na + + ОН — = 2Na + + CO3 2- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3 — + ОН — = CO3 2- + H2O
| Например, взаимодействие тетрагидроксоалюмината натрия и соляной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ:
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
Na + + [Al(OH)4] — + 4H + + 4Cl — = Na + + Cl — + Al 3+ + 3Cl — + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4] — + 4H + = Al 3+ + 4H2O
http://himia.my-dict.ru/q/4074850_pomogite-pzlstsostavte-polnye-i-sokrasennye-ionnye/
http://chemege.ru/reakcii-ionnogo-obmena/