Составьте термохимическое уравнение реакции разложения карбоната кальция, если для разложения 25 г. карбоната кальция потребовалось
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,211
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Составьте термохимическое уравнение реакции разложения карбоната кальция, если при разложении 40 г карбоната кальция поглощается 70,8 кДж теплоты
1. Составьте термохимическое уравнение реакции разложения карбоната кальция, если при разложении 40 г карбоната кальция поглощается 70,8 кДж теплоты.
Ответ. CaCO3 = CaO + CO2 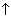
2. Сколько теплоты выделится при полном сгорании 1 м 3 смеси, состоящей из 30% (по объему) этилена и 70% ацетилена, если при сгорании 1 моль этих веществ выделяется соответственно 1400 и 1305 кДж?
Ответ. 59 531 кДж.
3. Вычислите теплоту сгорания ацетилена С2Н2, если теплота образования углекислого газа 393,5 кДж/моль, водяного пара – 242 кДж/моль, ацетилена – 226,8 кДж/моль.
Ответ. 1604,4 кДж.
1.1.3 Химическое равновесие
Необратимых реакций нет, любой процесс, рассматриваемый как необратимый, может быть превращен в обратимый (и наоборот). Разложение карбоната кальция:
Реакция необратима, если она осуществляется в открытой системе (т. е. где из сферы реакции возможно улетучивание оксида углерода(IV)). Однако в замкнутой системе процесс идет не полностью. Когда в системе устанавливается определенное давление газа, препятствующее разложению, процесс становится обратимым. Для обратимой реакции, записываемой в общем виде:
скорость прямой реакции uпр определяется из соотношения:
где k1 – константа скорости прямой реакции, cA и cB – молярные концентрации веществ А и В. Концентрации веществ А и В уменьшаются, и, следовательно, скорость прямой реакции понижается. Появление в системе продуктов С и D означает возможность протекания обратного процесса, скорость которого uобр математически выражается следующим образом:
По мере накопления в системе веществ С и D скорость обратного процесса непрерывно возрастает до выравнивания скоростей прямой и обратной реакций: uпр = uобр. Подобное состояние системы называется химическим равновесием. Соотношение между концентрациями при равновесии выражается формулой:
где Kp – константа равновесия, [A], [B], [C], [D] – равновесные концентрации веществ. Величина константы химического равновесия зависит от природы реагирующих веществ и от температуры. Если Kp > 1, то uпр > uобр, если Kp + ) – красный, а в щелочной (избыток гидратированного ОН – , рН > 7) – cиний?
Уравнение диссоциации индикатора можно представить в виде:
HInd 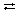
В состоянии химического равновесия:
1) При избытке в растворе гидратированного Н + (кислая среда, рН – (щелочная среда, рН > 7) нейтрализует ионы гидроксония, т. е. уменьшает их концентрацию, что сдвигает равновесие вправо (Кр > 1), в сторону накапливания гидратированных анионов индикатора синего цвета Ind – .
Пример 2. Вывести математическое выражение Кр для реакции:
Используя численное значение Кр и принцип Ле Шателье, объяснить, как можно предсказать сдвиг равновесия вправо.
Сместить равновесие вправо можно с помощью следующих воздействий.
1) Увеличить концентрацию реагирующих веществ. Такое воздействие можно описать неравенством:
Число молекул SO2 и O2 в единице объема увеличивается, столкновения между ними становятся чаще и концентрация SO3 тоже возрастает.
2) Уменьшить концентрацию продукта реакции. При уменьшении концентрации (отводе) SO3 результат подобен предыдущему. Новые порции исходных веществ будут реагировать для компенсации удаляемого продукта.
3) Понизить температуру. Прямая реакция – экзотермическая, поэтому для сдвига равновесия вправо систему следует охлаждать. Потерянное тепло будет восполняться вследствие усиления прямой реакции. (Наоборот, повышение температуры вызовет сдвиг равновесия влево.)
4) Повысить давление. Исходные вещества – газообразные, продукт – жидкое вещество (в виде пара). Прямая реакция идет с уменьшением объема, следовательно, увеличивая давление, мы смещаем равновесие вправо, а уменьшая – влево. Если бы реакция шла без изменения объема, то изменение давления не влияло бы на равновесие.
5) Использование катализатора не вызывает смещения равновесия. Катализатор, заметно влияющий на скорость химической реакции, равно ускоряет обе реакции – прямую и обратную.
Алгоритм 9. Использование принципа Ле Шателье
Задание. При определенных условиях реакция хлороводорода с кислородом является обратимой:
4НСl (г.) + O2 (г.) 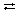
Какое влияние на равновесное состояние системы окажут:
а) увеличение давления;
б) повышение температуры;
в) увеличение концентрации кислорода;
г) введение катализатора?
Алгоритм 10. Вычисление константы равновесия реакции
Задача. Вычислите константу равновесия для реакции
СО2 + Н2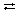
если равновесная концентрация углекислого газа равна 0,02 моль/л, водорода – 0,005 моль/л, а угарного газа и воды – по 0,01 моль/л.
Алгоритм 11. Вычисление исходных концентраций веществ
Задача. Обратимая реакция выражается уравнением
2SO2 + O2 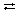
Известны равновесные концентрации: для оксида серы(IV) – 0,0002 моль/л, для кислорода – 0,004 моль/л, для оксида серы(VI) – 0,003 моль/л. Найдите исходные концентрации кислорода и сернистого газа.
Реакция термического разложения карбоната кальция
CaCO3  CaO + CO2
CaO + CO2
Реакция термического разложения карбоната кальция с образованием оксида кальция и оксида углерода(IV). Реакция протекает при температуре 900-1200°C. [8]
Обжиг известняка. Промышленный способ получения углекислого газа. Технологически этот процесс в промышленности реализуют в специальных шахтных печах.
Реакция используется в статьях:
- Оксиди (укр.)
- Е290 (укр.)
- Алкіни (укр.)
- CaCO3 = CaO + CO2, ΔH 0 298 = 177,9 кДж/моль.
http://kazedu.com/referat/127843/1
http://chemiday.com/reaction/3-1-0-17
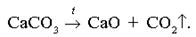
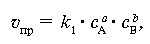
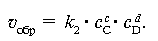
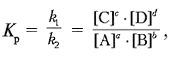
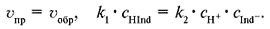
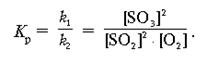
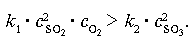


 CaO + CO2
CaO + CO2