Напишите уравнение реакции диссоциации гидроксида стронция?
Химия | 5 — 9 классы
Напишите уравнение реакции диссоциации гидроксида стронция.
Sr(oh)2 = sr(2 + ) + 2OH( — ).
1. напишите уравнения реакций взаимодействия лития и стронция с водой, если при этом образуется водород и соответствующий гидроксид?
1. напишите уравнения реакций взаимодействия лития и стронция с водой, если при этом образуется водород и соответствующий гидроксид.
2. напишите уравнения возможных реакций между бромоводородной кислотой и металлами : а)Fe ; б)Au ; в)K ; г)Ba.
Напишите уравнение процессов диссоциации фосфорной кислоты, гидроксида калия и сульфата алюминия?
Напишите уравнение процессов диссоциации фосфорной кислоты, гидроксида калия и сульфата алюминия.
Уравнения реакций 1?
Уравнения реакций 1.
Фосфорной кислоты и гидроксида кальция 2.
Дихромовой кислоты и гидроксида стронция.
Напишите реакции электролитической диссоциации следущих вещест : а)Сульфат натрия в)гидроксид калия с)хлорид кальция?
Напишите реакции электролитической диссоциации следущих вещест : а)Сульфат натрия в)гидроксид калия с)хлорид кальция.
Напишите уравнения реакций электролитической диссоциации гидроксида бериллия?
Напишите уравнения реакций электролитической диссоциации гидроксида бериллия.
Напишите реакции получения и докажите амфотерность гидроксида : олова (II), напишите диссоциацию амфотерного гидроксида : олова (II)?
Напишите реакции получения и докажите амфотерность гидроксида : олова (II), напишите диссоциацию амфотерного гидроксида : олова (II).
Напишите уравнения процессов диссоциации ортофосфорной кислоты, гидроксида калия и сульфата алюминия?
Напишите уравнения процессов диссоциации ортофосфорной кислоты, гидроксида калия и сульфата алюминия.
Уравнение диссоциации гидроксида кадмия?
Уравнение диссоциации гидроксида кадмия.
Напишите название и формулу гидроксида Cl, составьте уравнения диссоциации гидроксида?
Напишите название и формулу гидроксида Cl, составьте уравнения диссоциации гидроксида.
Напишите уравнения электролитической диссоциации Гидроксида калия и нитрата меди (II)?
Напишите уравнения электролитической диссоциации Гидроксида калия и нитрата меди (II).
Вопрос Напишите уравнение реакции диссоциации гидроксида стронция?, расположенный на этой странице сайта, относится к категории Химия и соответствует программе для 5 — 9 классов. Если ответ не удовлетворяет в полной мере, найдите с помощью автоматического поиска похожие вопросы, из этой же категории, или сформулируйте вопрос по-своему. Для этого ключевые фразы введите в строку поиска, нажав на кнопку, расположенную вверху страницы. Воспользуйтесь также подсказками посетителей, оставившими комментарии под вопросом.
Вода – слабый электролит, диссоциирующий на ионы H + и OH — — анионы. Этому процессу соответствует константа диссоциации воды : д * [H2O] = К H2O = [H + ] [OH — ] – ионное произведение воды, К H2O = 1 * 10 — 14 (при 25° С) К H2O – величина постоянна..
1. Литий — Li + 3 Li )2ē )1ē ē = 3, p = 3, n = 4 Находится в I группе, А подгруппе, II периоде. 2. Металл 3. Li Be 5. Высший оксид — Li2O — основный 6. Высший гидроксид — LiOH — щелочь 7. Летучего водородного соединения не образует..
Нет, там за каждый элемент ставится определенное кол — во баллов. На Решу ОГЭ вариант открой, после внизу страницы нажми «сохранить», далее будет написано, как оценивается каждое задание из 2 части.
2. Дано : ω(Е) = 91, 18% Знайти : Е — ? Ω(Н) = 100% — 91, 18% = 8, 82% Загальна формула сполуки ЕН3 Мг(ЕН3) = 3 / 0, 0882 = 34 Аг(Е) = 34 — 3 = 31⇒Р — Фосфор 2. Дано : m(Me(NO3)3 = 42. 6 r m(Me(OH)3 = 15. 6 r Знайти : Ме — ? Формула солі — ? 42..
Химия — это наука о веществах и их превращениях в другие вещества.
2Fe2O3 + 3C = 4Fe + 3CO2 реакция замещения Fe2O3 + 6HCl = 2FeCl3 + 3H2O реакция обмена H2CO3 = H2O + CO2 реакция разложения 3Mg + N2 = Mg3N2 реакция соединения.
HCl + NH3 = NH4Cl n(HCl) = n(NH4Cl) = 11200 дм3 / 22, 4 дм3 / моль = 500 моль m(NH4Cl) = 500 моль * 56, 5 г / моль = 28250 г = 28, 250 кг.
H2SO3 = H + HSO3 = 2H + SO3 AL(NO3)3 = AL + 3NO3.
Твердое ; желтого или зелено желтого цвета ; запах есть, непластичное и хрупкоев S8моноклинном виде и пластичное в S6 и S4 — пластические виды серы, получаются при нагревании ; в воде нерастворимо ; T кип = + 444 С Т плав = + 112С ; плотность = 2070 ..
A) Li + Cl2 = LiCl2 b)Li + S = v) g)Li + O2 = LiO2 d)Li + 2HCl = LiCl + H2.
Гидроксид стронция (Sr (OH) ₂) химическая структура, свойства и применение
гидроксид стронция (Sr (OH) ₂) — неорганическое химическое соединение, состоящее из иона стронция (Sr) и двух ионов гидроксида (OH). Это соединение получают путем объединения соли стронция с сильным основанием, в результате чего получается соединение щелочной природы, химическая формула которого Sr (OH)2.
Обычно гидроксид натрия (NaOH) или гидроксид калия (KOH) используют в качестве сильного основания для получения гидроксида стронция. С другой стороны, солью стронция (или ионом стронция), который реагирует с сильным основанием, является нитрат стронция Sr (NO3)2 и процесс описывается следующей химической реакцией:
В растворе катион стронция (Sr + ) приводится в контакт с гидроксид-анионом (ОН — ) образуя основную ионную соль стронция. Поскольку стронций является щелочноземельным металлом, гидроксид стронция считается едким щелочным соединением.
- 1 Получение
- 2 Химическая структура и физико-химические свойства
- 2.1 Октагидрат гидроксида стронция
- 2.2 Моногидрат гидроксида стронция
- 2.3 Безводный гидроксид стронция
- 2.4 Растворимость
- 2.5 Химическая реактивность
- 3 использования
- 3.1 Извлечение мелассы и рафинирование сахарной свеклы
- 3.2 Стронциевые жиры
- 3.3 Пластиковый стабилизатор
- 3.4 Другие приложения
- 4 Ссылки
получение
В дополнение к описанному ранее процессу можно сказать, что после проведения реакции Sr (OH)2 осаждается в растворе. Затем его подвергают процессу стирки и сушки, в результате чего получают очень тонкий белый порошок..
Альтернативный способ получения гидроксида стронция заключается в нагревании карбоната стронция (SrCO)3) или сульфат стронция (SrSO)4) с паром при температуре от 500 до 600 ° С Химическая реакция происходит, как показано ниже:
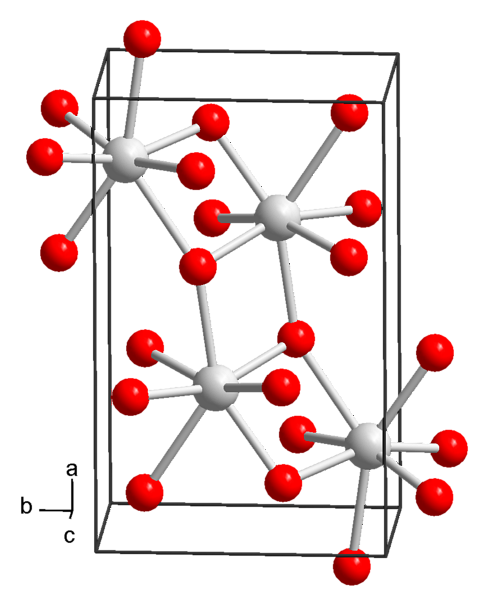
Химическая структура и физико-химические свойства
В настоящее время известны 3 формы гидроксида стронция: октагидрат, моногидрат и безводный..
Октагидрат гидроксида стронция
Из растворов при нормальных условиях температуры и давления (25 ° C и 1 атм) гидроксид стронция осаждается в октагидратированной форме, химическая формула которой Sr (OH)2H 8H2О.
Это соединение имеет молярную массу 265,76 г / моль, плотность 1,90 г / см и осаждается в виде тетрагональных кристаллов (с пространственной группой P4 / ncc) четырехугольного и бесцветного призматического вида..
Кроме того, октагидрат гидроксида стронция обладает способностью поглощать атмосферную влагу, так как является легко растекающимся соединением..
Моногидрат гидроксида стронция
По данным оптических микроскопических исследований (выполненных с использованием техники дифракции рентгеновских лучей), путем повышения температуры примерно до 210 ° С — при постоянном атмосферном давлении — Sr (OH)2H 8H2Или он обезвоживается и превращается в моногидрат гидроксида стронция (Sr (OH)2∙ H2O).
Эта форма соединения имеет молярную массу 139,65 г / моль, а его температура плавления составляет -73,15 ° С (375 К). Из-за своей атомной конфигурации он обладает более низкой растворимостью в воде, чем описано в октагидратированной форме..
Безводный гидроксид стронция
Продолжая повышать температуру системы до примерно 480 ° С, дегидратацию продолжают до тех пор, пока не будет получен безводный гидроксид стронция..
В отличие от его гидратированных форм, он имеет молярную массу 121,63 г / моль и плотность 3,625 г / см. 3 . Его температура кипения достигается при 710 ° C (1310 ° F или 983 K), в то время как температура плавления составляет 535 ° C (995 ° F или 808 K)..
растворимость
Октагидратированный гидроксид стронция имеет растворимость в воде 0,91 грамма на 100 миллилитров (измерено при 0 ° C), в то время как его безводная форма при аналогичных температурных условиях имеет растворимость 0,41 грамма на 100 миллилитров..
Таким же образом, это вещество считается нерастворимым в ацетоне и полностью растворимым в кислотах и хлориде аммония..
Химическая реактивность
Гидроксид стронция не горюч, его химическая реакционная способность остается стабильной при умеренных температурах и давлениях и способен поглощать диоксид углерода из атмосферного воздуха, превращая его в карбонат стронция..
Кроме того, это сильно раздражающее соединение, если оно вступает в контакт с кожей, дыхательными путями или другими слизистыми оболочками тела..
приложений
Благодаря своим гигроскопическим характеристикам и основным свойствам, гидроксид стронция используется для различных применений в промышленности:
- Извлечение мелассы и рафинирование сахара из свеклы.
- Пластиковый стабилизатор.
- Смазки и смазки.
Извлечение мелассы и рафинирование сахарной свеклы
В начале XXI века гидроксид стронция использовался в Германии для рафинирования сахара из свеклы по технологии, запатентованной Карлом Шейблером в 1882 году..
Этот процесс состоит из смешивания гидроксида стронция и сахарной пульпы свеклы, что приводит к нерастворимому дисахариду. Этот раствор отделяют декантированием, и после завершения процесса рафинирования в качестве конечного продукта получают сахар..
Несмотря на то, что эта процедура все еще используется сегодня, существуют другие методы с гораздо большим спросом, потому что они дешевле, которые используются на подавляющем большинстве мировых сахарных заводов. Например, метод Барсил, в котором используется силикат бария, или метод Штеффена с использованием Cal в качестве экстрактора.
Стронциевые смазки
Это смазки, содержащие гидроксид стронция. Они способны прочно сцепляться с поверхностями с металлическими характеристиками, устойчивы к воде и выдерживают резкие перепады температур.
Благодаря хорошей физической и химической стабильности эти жиры используются в качестве промышленных смазочных материалов..
Пластиковый стабилизатор
Подавляющее большинство пластмасс при воздействии климатических факторов, таких как солнце, дождь и атмосферный кислород, изменяют их свойства и ухудшают качество.
Из-за значительной устойчивости к воде в эти полимеры добавляется гидроксид стронция — во время фазы плавления — выступает в качестве стабилизатора при производстве изделий из пластмасс для продления срока их службы..
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e20c88e2b2b2169 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
http://ru.thpanorama.com/articles/qumica/hidrxido-de-estroncio-sroh-estructura-qumica-propiedades-y-usos.html
http://gomolog.ru/reshebniki/9-klass/zadachnik-kuznecova-2020/2-2.html