Написать уравнение диссоциации кремниевой кислоты?
Химия | 10 — 11 классы
Написать уравнение диссоциации кремниевой кислоты.
Кремниевая кислота неполностью диссоциирует
К. она нерастворима в воде и в водных растворах подвергается частичнойдиссоциации.
Написать уравнение диссоциации след?
Написать уравнение диссоциации след.
Веществ : серная кислота, хлорид магния, гидроксид калия.
Уравнение диссоциации селеноводородной кислоты?
Уравнение диссоциации селеноводородной кислоты.
Напишите уравнение диссоциации кислоты H2CrO4?
Напишите уравнение диссоциации кислоты H2CrO4.
Напишите уравнение диссоциации фосфорной кислоты?
Напишите уравнение диссоциации фосфорной кислоты.
Написать уровнение диссоциации фосфорной кислоты?
Написать уровнение диссоциации фосфорной кислоты.
В чем отличие кремниевой кислоты от других кислот?
В чем отличие кремниевой кислоты от других кислот?
Составьте возможные уравнения диссоциации следующих веществ : карбоната бария, хлорида железа 3, азотной кислоты, оксида углерода 4, кремниевой кислоты?
Составьте возможные уравнения диссоциации следующих веществ : карбоната бария, хлорида железа 3, азотной кислоты, оксида углерода 4, кремниевой кислоты.
HBrO3 — бромноватая кислота ; h2SiO3 — кремниевая кислота Написать формулу её андегрида, то есть 2 кислот?
HBrO3 — бромноватая кислота ; h2SiO3 — кремниевая кислота Написать формулу её андегрида, то есть 2 кислот.
Помогите сделать уравнение ?
Помогите сделать уравнение .
Написать уравнение реакций диссоциаций уксосной и муравьиной кислоты.
Написать ступенчатую диссоциацию серной кислоты?
Написать ступенчатую диссоциацию серной кислоты.
Вы открыли страницу вопроса Написать уравнение диссоциации кремниевой кислоты?. Он относится к категории Химия. Уровень сложности вопроса – для учащихся 10 — 11 классов. Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие ответы по интересующей теме. Чтобы получить наиболее развернутый ответ, можно просмотреть другие, похожие вопросы в категории Химия, воспользовавшись поисковой системой, или ознакомиться с ответами других пользователей. Для расширения границ поиска создайте новый вопрос, используя ключевые слова. Введите его в строку, нажав кнопку вверху.
У метиламина. Амины сами по себе являются слабыми основаниями (могут реагировать, например, с кислотами). Этанол — спирт. Он обладает кислотными свойствами.
2СН3СООН + Mg = (CH3COO)2Mg + Н2. Ацетат магния. 2СН3 — СН2 — СООН + CaO = (CH3 — CH2 — COO)2Ca + Н2О пропионат кальция. СН3СООН + СН3 — СН2 — ОН = СН3СООС2Н5 + Н2О этилацетат. Два первых вещества соли, последнее вещество, сложный эфир.
Так, можна. Якщо вскипьятити воду, то вона пiдiйметься вверх, а вугiльний пил осяде на низ посудини.
Железный купорос пирит.
BaCl2 Взаємодія металевого барію з хлором : Ba + Cl2 = BaCl2.
Оксиды : CaO, CO2, N2O5, Al2O3, N2O, FeO, SO3, ZnO, Mn2O7, CuO, , CO, Na2OSiO2, , NO, MnO, Cr2O3, CrO3 кислоты : H2SO3, HCl Основания : Zn(OH)2, Ca(OH)2, , KOH, F3(OH)3, Ba(OH)2, Al(OH)3, соли : CaCl2, FeCl3, Na2SO4, CaCO3.
Составить уравнение электролитической диссоциации кремниевой кислоты
Вопрос по химии:
Написать уравнение диссоциации кремниевой кислоты
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
Кремниевая кислота не полностью диссоциирует
т.к. она нерастворима в воде и в водных растворах подвергается частичной диссоциации.
H₂SiO₃ = H⁺ + HSiO₃⁻
HSiO₃- = H⁺ + SiO₃²⁻
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Кремниевая кислота — формула, физические и химические свойства
Общая информация
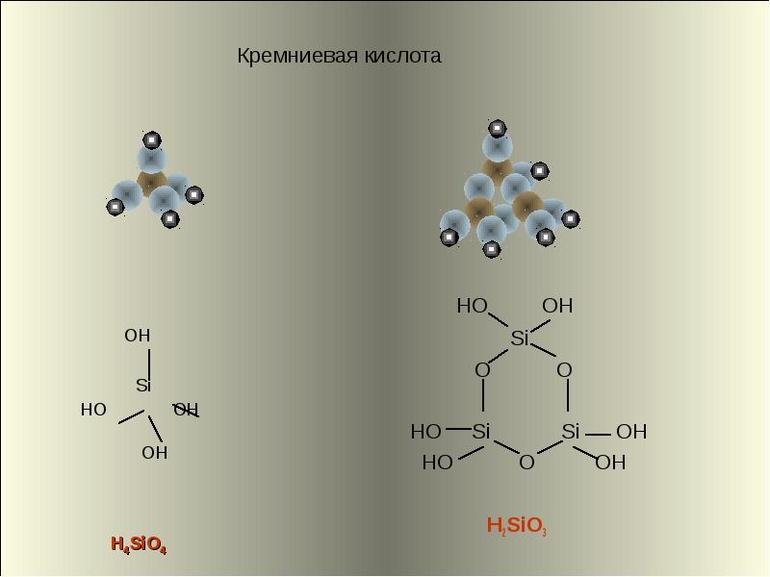
Основная формула кремниевой кислоты — H2SiO3 (так как кислота не имеет постоянного состава, её обозначение иногда принимает вид nSiO2 • mH2O, что соответствует поликремниевым видам). Номенклатура кислоты включает в себя и её подвиды. Условное обозначение их химического состава выглядит следующим образом:
- Ортокремниевая — H4SiO4. Наряду с метакремниевой кислотой, чья формула считается основной, ортокремниевая является наиболее распространённым химическим соединением кислот этого вида.
- Дикремниевая — H2Si2O5, H6Si2O7 и H10Si2O9 (показатель растворимости в воде при t = 20 градусов по цельсию составляет 2,9310 в минус 4 степени моль/л).
- Пирокремниевая — H6Si2O7.
Соли кремниевых кислот обозначаются как силикаты. Поликремниевые кислоты состоят из структурных звеньев, соединяющихся в сложные линейные и разветвлённые цепи. Несмотря на различие в формулах и отдельных характеристиках кремниевой кислоты, все виды этих химических соединений имеют тетраэдрическое строение.
Особенности силикатов
В природе широко распространены (в частности, к ним относятся полевые шпаты, асбест, тальк, слюда и различные виды глины). Соли кремниевой кислоты в большинстве своём плохо растворимы в воде (исключения составляют силикаты калия и натрия). Получение солей происходит при сплавлении едких щёлочей или карбонатами натрия и калия с диоксидом кремния. В остатке выходит диоксид углерода с высокой массовой долей вещества или вода. Примерами таких уравнений могут послужить следующие реакции:
- SiO2 + K2CO3 = K2SiO3 + CO2 (образование углекислого газа).
- SiO2 + 2NaOH = Na2SiO3 + H2O.
- SiO2 + Na2CO3 = Na2SiO3 + CO2.
К свойствам солей относится высокая температура плавления: в среднем — от 1000 до 1300 градусов по Цельсию (такая разновидность силикатов, как каолинит, плавится при t = 1800 и выше). Твёрдость этих веществ по шкале Мооса составляет 6−8 баллов, что является высоким показателем.
Несмотря на то что силикаты не реагируют на отдельные соединения и в целом относятся к классу химически пассивных веществ, они способны взаимодействовать со слабыми кислотами и растворимыми солями. Формула гидролиза представляет собой уравнение: Na2SiO3 + H2O = NaHSiO3 + NaOH. Расплавленные силикаты имеют высокие электролитические свойства.
Ещё одной особенностью солей кремниевых соединений является их возможность замещать атомы кремния на атомы алюминия, образуя при этом алюмосиликаты. Они также нерастворимы в воде и обладают абсорбционными, ионообменными, диэлектрическими и термостойкими свойствами.
Физические и химические свойства
Неорганическая кислота образуется при действии сильных кислот на растворимые силикаты. Вещество представляет собой белый аморфный и стекловидный полимер, имеющий цепочечную структуру. Не вступает в реакцию с другими кислотами и не гидратом аммиака. Так как все поликремниевые соединения относятся к малорастворимым веществам, они образуют коллоидные растворы при реакции с водой. Молярная масса вещества равна 78 а. е. м. (H2SiO3 — 2 атома водорода = 1 • 2, 1 атом кремния = 28 и 3 атома кислорода = 16 • 3).
Кислотные свойства выражены очень слабо (у молекулы вещества степень окисления кремния равна +4), вещество не имеет кислого вкуса или запаха, а также не изменяет окраску индикатора. Согласно таблице сильных и слабых кислот, кремниевая занимает последнюю строчку). Константа диссоциации для метакремниевых соединений составляет K1 = 1,3•10 -10 , K2 = 1,6•10 -12 , а для ортокремниевой K1 = 2•10 -10 , K2 = K3 = K4 = 2•10 -12 .
Вследствие своей неустойчивости химическое вещество при нагревании либо длительном хранении разлагается на оксид кремния и воду (реакция термического разложения H2SiO3 = H2O + SiO2). Каждый атом кремния в кристаллах (SiO2) окружён 4 атомами кислорода, которые, будучи связаны друг с другом, образуют кристаллическую трёхмерную решётку, что обусловливает твёрдость вещества. Некоторые другие химические свойства кремниевых кислот можно проиллюстрировать следующими уравнениями:
- H2SiO3 + 4KOH = K2SiO3 + 4H2O (растворение студенистого кислотного остатка и образование средней соли метасиликата калия и воды).
- 2H4SiO4 = (HO)3SiOSi (OH)3 + H2O (эта реакция называется поликонденсацией).
- Пример взаимодействия с плавиковой кислотой и образованием газообразного фторида кремния: H2SiO3 + 6HF = H2SiF6 + 3H2O = SiF4 (образование газа) + 2HF (фтороводород) + 3H2O.
- CaCl2 + Na2SiO3 = 2NaCl + CaSiO3 (химическая реакция двух солей с выпадением осадка).
В присутствии щёлочных катализаторов — к примеру, NaOH — ортокремниевая кислота может образовывать эфиры-ортосиликаты. В большинстве своём они имеют вид R1R2R3R4SiO3, где R1−4 являются органическими радикалами. Примером такого эфира является распространённый тетраэтилортосиликат с формулой Si (C2H5O)4.
Способы получения
Основной способ получения кремниевой кислоты — косвенным путём, воздействуя сильной кислотой на силикат калия или натрия (Na2SiO3 + 2HCl = H2SiO3 + 2NaCl). При этом невозможно получить кислоту в чистом виде — в водном растворе образуется золь, который через малый промежуток времени превращается в гель.
Кремниевые соединения также можно получить посредством гидролиза хлорсиланов (SiH2Cl2 + 3H2O = H2SiO3 +2HCl + 2H2); конечным продуктом гидролитического расщепления является H2SiO3. Наконец, для промышленных масштабов, а также для лабораторных экспериментов и отдельных опытов по химии могут использоваться методы электродиализа и ионного обмена. Большое внимание уделяется и получению силикагеля — другое название вещества, образовывающегося от перенасыщенных растворов кремниевых кислот. Технология производства включает в себя несколько стадий:
- Возникновение золя и его застудневание в однородную массу (гидрогель).
- Созревание (последующее гелеобразование и разжижение вещества).
- Очищение и промывка геля от солей.
- Высушивание и превращение вещества в ксерогель.
Опытным путём доказано, что наиболее чистый силикагель получается при гидролизе соединений кремния (SiCl4), а также ортокремниевых соединений. Химическая формула получения геля выглядит так: Na2SiO3 + H2SO4 = nSiO2 • mH2O + Na2SO4, где nSiO2 • mH2O — гидратированный аморфный кремнезём.
Применение в различных отраслях
Благодаря пористой структуре силикагеля его часто применяют в качестве абсорбента для поглощения вредных газов и смесей. Для общественности известны медицинские высокопористые гели, эффективные при различного рода отравлениях и недомоганиях. Помимо этого, вещество используется и для создания технических фильтрационных систем.
Кремниевые соединения являются важным строительным элементом для кожи, волос и ногтей, поэтому эти вещества широко используются для производства косметики и лекарственных препаратов. Препараты на основе кремния обеспечивают гибкость соединительных тканей внутренних органов (в частности, кишечника и желудка) и улучшают усвоение кальция, что способствует восстановлению костной ткани.
В нефтяной промышленности гели на основе кремнийсодержащих веществ используются для очистки углеводородов от смол, а в ядерной отрасли при помощи силикагеля производится не только очистка сточных вод, но и разделение изотопов радиоактивных веществ.
Любопытно, что вещества на основе кремниевых соединений находят массу применений в повседневной жизни. К примеру, процесс сушки обуви займёт куда меньше времени, если в промокшие ботинки положить пакетик с соответствующим абсорбентом. Силикагель позволит избавиться от неприятных запахов в помещении или в сумке с вещами. Столовое серебро можно спасти от почернения, положив в шкаф с ценными приборам гелевые шарики на основе силикагеля.
Если необходимо продлить срок службы бритвенных лезвий, то для спасения от ржавчины нужно положить к ним несколько гранул с силикагелем. Это же относится и к хранению старых фотографий, а также других вещей, которые со временем могут потускнеть или изменить свой внешний вид под воздействием окружающей среды. Автолюбителям могут уменьшить запотевание ветрового стекла, всего лишь положив на приборную панель цветы или пакетик с силикагелем.
http://online-otvet.ru/himia/5cea7b4896f4e19a2909124e
http://nauka.club/khimiya/kremnievaya-kislota.html