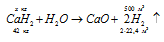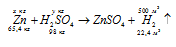Гидрид кальция: способы получения и химические свойства
Гидрид кальция CaH2 — неорганическое бинарное соединение щелочноземельного металла кальция и водорода. Белый, плавится без разложения в атмосфере H2, при дальнейшем нагревании разлагается. Сильный восстановитель.
Относительная молекулярная масса Mr = 42,09 относительная плотность для тв. и ж. состояния d = 1,9; tпл ≈ 1000º C.
Способ получения
1. Гидрид кальция получают реакцией взаимодействия кальция и водорода при 500 — 700º C:
2. Хлорид кальция взаимодействует с водородом при 600 — 700º С и образует гидрат кальция и хлороводородную кислоту:
Химические свойства
1. Гидрид кальция — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами.
1.1. При взаимодействии с кислородом при температуре 300 — 400º C гидрид кальция образует оксид кальция и воду:
1.2. При температуре выше 1000º C г идрид кальция взаимодействует с азотом , образуя нитрид кальция и водород:
2. Гидрид кальция взаимодействует со сложными веществами :
2.1. При взаимодействии с водой гидрид кальция образует гидроксид кальция и газ водород:
2.2. Гидрид кальция вступает в реакцию с кислотами :
2.2.1. С разбавленной хлороводородной кислотой гидрид кальция реагирует с образованием хлорида кальция и газа водорода:
2.2.2. В результате реакции между гидридом кальция и сероводородной кислотой при 500 — 600º С образуется сульфид кальция и водород:
2.3. Гидрид кальция реагирует с газом аммиаком при t = 300º C с образованием амида кальция и водорода:
2.4. Гидрид кальция вступает во взаимодействие с солями :
В результате реакции между гидридом кальция и хлоратом калия при 450 — 550º С образуется хлорид калия, оксид кальция и вода:
3CaH2 + 2KClO3 = 2KCl + 3CaO + 3H2O
3. Гидрид кальция разлагается при температуре выше 1000º C, с образованием кальция и водорода:
Гидриды металлов, получение и свойства
Задача 794.
Как получают гидриды металлов? Составить уравнения реакций: а) получения гидрида кальция; б) взаимодействия его с водой.
Решение:
Соединения водорода с металлами называют гидридами. Гидриды металлов получают при нагревании металла в струе водорода. Гидриды имеют ионное строение, так металл кальций входит в состав СаН2 в виде иона Са 2+ , а водород – в виде аниона Н — . Таким образом, можно сделать вывод, что гидриды – солеподобные соединения.
а) При нагревании в струе водорода металлический кальций соединяется с водородом, образуя гидрид кальция:
б) Гидрид кальция СаН2 – солеподобное вещество белого цвета, которое гидролизуется как соль сильного основания и слабой кислоты по аниону:
Эта реакция может служить удобным методом для получения водорода в лабораторных условиях. Гидрид кальция можно использовать в качестве эффетивного осушителя воздушных, газовых и жидких неводных смесей, а также для количественного определения содержания воды в органических соединениях и кристаллогидратах и т.д. СаН2 служит для обнаружения следов воды.
Задача 795.
Для наполнения аэростатов в полевых условиях иногда пользуются взаимодействием гидрида кальция с водой. Сколько килограммов СаН2 придется израсходовать для наполнения аэростата объемом 500 м 3 (считая условия нормальными)? Сколько потребуется для этой цели цинка и серной кислоты?
Решение:
а) Уравнение реакции имеет вид:
Молекулярная масса СаН2 равна 42 а. е. м., значит, СаН2 – 42кг/кмоль. Массу СаН2 находим из пропорции:
х : 500 = 42 : 44,8; х = (42 . 500)/44,8 = 468,75кг.
б) Уравнение реакции имеет вид:
Массу цинка находим из пропорции:
х : 500 = 65,4 : 22,4; х = (65,4 . 500)/22,4 = 1459,82кг.
Массу серной кислоты находим из пропорции:
у : 500 = 98 : 22,4; х = (98 . 500)/22,4 = 2187,50кг.
Ответ: m(CaH2) = 468,75кг, m(Zn) = 1459,82кг, m(H2SO4) = 2187,50кг.
Задача 796.
Почему водород и кислород не взаимодействуют при обычной температуре, а при 700 °С реакция протекает практически мгновенно?
Решение:
Атомы водорода в молекуле Н2 и атомы кислорода в молекуле О2 соединены между собой очень прочными ковалентными связями. Малая скорость взаимодействия водорода с кислородом при низких температурах обусловлена высокой энергией активации этой реакции. Поэтому любое столкновение между молекулами Н2 и О2 при обычной температуре и атмосферном давлении оказывается неэффективным. И только при повышении температуры, когда кинетическая энергия сталкивающихся молекул Н2 и О2 делается большой, некоторые соударения молекул Н2 и О2 становятся эффективными и приводят к образованию активных центров, что даёт начало реакции взаимодействия водорода с кислородом, т. е. реакция инициируется, и скорость её резко возрастает. При смешивании водорода и кислорода в отношении 2 : 1 можно получить взрыв, если инициировать реакции, например ударом. При 300 °С в смеси Н2 и О2 через несколько дней образуется немного Н2О, а при 500 0 С водород полностью соединяется с кислородом за несколько часов, при нагревании смеси до 700 0 С происходит быстрый подъём температуры и реакция заканчивается со взрывом. Поэтому чтобы взорвать смесь Н2 и О2 нужно подогреть её до 700 °С хотя бы в одном месте.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Cloudflare Ray ID: 6dff1835c83d5953 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
http://buzani.ru/zadachi/khimiya-glinka/1263-gidridy-metallov-zadachi-794-796
http://gomolog.ru/reshebniki/9-klass/eremin-2019/22/3.html