Напишите уравнения реакций горения в кислороде: а) серы; б) алюминия; в) метана (углерод в образующемся оксиде четырехвалентен). Назовите продукты реакций
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,293
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,176
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df1c3b62fac008b • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Горение углерода
Химический механизм горения углерода в достаточной мере еще не раскрыт. Однако в последнее время установлено, что в результате реагирования углерода с кислородом одновременно образуются оба окисла углерода СО и СО2, но в разных соотношениях. При t = 1200 °С образуются оба окисла и в одинаковом количестве. При t= 1600 °С СО образуется вдвое больше, чем С02.
Горение твердого углерода является гетерогенной реакцией, происходящей на поверхности.
Прямая реакция горения углерода:
С + О2 —^ СО2 (основная), но протекают и побочные реакции:
С + С02 —» 2СО (экзотермические реакции);
2СО +02 2С02 (экзотерм.);
2С + 02 -> 2СО (экзотерм.).
Кроме того, в присутствии водяных паров на раскаленной поверхности углерода происходит газификация твердого углерода по реакции
С + Н20 —» СО + Н2 (высокотемпературная область);
С +2Н20 —» С02 + 2Н2 (низкотемпературная область).
Так как реакция горения углерода является гетерогенной, то скорость ее протекания зависит от организации подвода кислорода к поверхности углерода и скорости химической реакции. Подвод О2 осуществляется за счет турбулентной и молекулярной диффузии. Происходящие побочные реакции (образование СО за счет восстановления СО2 и догорания СО в СО2) оказывают влияние на итоговую скорость горения углерода. Наиболее вероятна такая схема: на поверхности углерода образуется СО2, затем С + СО2 —» 2СО; далее в зоне с большим содержанием кислорода 2СО +О2 —» 2СО2.
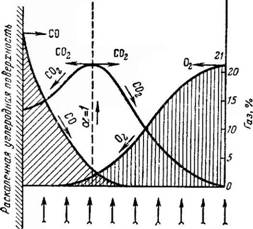
Интенсификация процесса горения может быть осуществлена улучшением газообмена у поверхности углерода (рис. 5.2).
5.3.5. Диффузная и кинетическая области гетерогенного горения
При низких температурах скорость химического взаимодействия горючего и окислителя мала. Она намного меньше скорости их взаимной диффузии, которая поэтому почти не влияет на ход процесса. Считается, что процесс горения протекает в кинетической области и его следует рассматривать как чисто химический процесс.
Область Область избытка
недостатка боздиха (се >/>
Поток бозйуха, омывающий углеродную поверхность
Рис. 5.2. Изменение концентрации газов у поверхности частицы горящего углерода
При высоких температурах или ухудшенных условиях массообмена скорость реакции намного опережает скорость диффузии, которая в данном случае определяет ход процесса. Можно считать, что процесс горения развивается в диффузной области и его следует рассматривать с чисто физической сторо-
Наиболее подробно исследования горения углерода сделаны советскими учеными — школой чл.-корр. АН СССР А. С. Предводителева Дальнейшее развитие исследования гетерогенных процессов в натуральном топливе проводил Г. Ф. Кнорре.
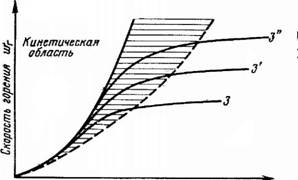
В начальный период реакции, когда температура низка, скорость реакции незначительна, а концентрация кислорода у поверхности горящей частицы топлива велика. При этом скорость горения лимитируется скоростью протекания химической реакции окисления, т. е. кинетикой горения. Горение проходит в кинетической области (рис. 5.3).
Промежуточная Дшррузиопная, область область
Рис. 5.3. Изменение скорости химической реакции в зависимости от температуры
По мере расходования кислорода его концентрация у поверхности частицы уменьшается. Одновременно с этим возрастает температура, а вместе с ней и скорость химической реакции. Кислорода начинает не хватать. Скорость горения начинает лимитироваться скоростью диффузии кислорода. Так горение переходит в диффузную область. В диффузной области скорость горения не зависит от температуры. Между этими областями находится промежуточная переходная область, где влияние кинетики и диффузии соизмеримы. При увеличении интенсивности газообмена у поверхности горящей частицы кривая сдвигается в область больших скоростей химической реакции.
http://gomolog.ru/reshebniki/9-klass/eremin-2019/16/7.html
http://msd.com.ua/kotelnye-ustanovki/gorenie-ugleroda/