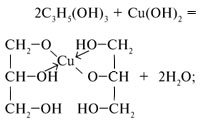
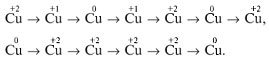Получение и химические реакции меди
Нахождение в природе.
Медь встречается главным образом в виде сульфидных соединений. Наиболее важные минералы — медный блеск Cu2S , медный колчедан (халькопирит) CuFeS2 и борнит Cu3FeS2 входят в состав так называемых полиметаллических сульфидных руд. Реже встречаются кислородсодержащие соединения: малахит (основной карбонат меди) СuСО3 • Сu(ОН)2 , азурит 2СuСО3 • Сu(ОН)2 и куприт СuO2 .
Физические свойства.
Медь — металл красного цвета, плавится при температуре 1083°С, кипит при 2877°С. Чистая медь довольно мягка, легко поддается прокатке и вытягиванию. Примеси увеличивают твердость меди. Медь отличается очень высокой электро- и теплопроводностью. Примеси мышьяка и сурьмы значительно уменьшают электропроводность меди. Медь образует различные сплавы (латуни, бронзы и др.).
Химические свойства.
Медь относится к числу малоактивных металлов. На холоду она очень слабо взаимодействует с кислородом воздуха, покрываясь пленкой оксида, которая препятствует дальнейшему окислению меди. При нагревании медь окисляется полностью:
Сухой хлор на холоду не взаимодействует с медью, однако в присутствии влаги реакция проходит довольно энергично:
При нагревании медь довольно энергично взаимодействует с серой:
Медь может растворятся только в кислотах-окислителях. В концентрированной серной кислоте она растворяется только при нагреваний, a в азотной — и на холоду:
Получение.
Процесс получения меди состоит из нескольких стадий. Сначала сульфидную руду обжигают. При этом часть меди превращается в оксид:
Затем проводят плавку на штейн и получают сульфид меди (I). При этом к огарку прибавляют кокс и песок для образования шлака:
Далее штейн подвергают конвертерной плавке:
Получаемая медь называется черновой. Очищают медь рафинированием. Электролитом служит раствор сульфата меди, анодом — медные болванки ,катодом — пластинка чистой меди. При пропускании электрического тока через электролит медь анода растворяется, а на катоде выделяется чистая медь.
Оксид меди
Обладает основными свойствами. Он может взаимодействовать с кислотами и кислотными оксидами:
Оксид меди не растворим в воде. При нагревании оксида меди и присутствии восстановителя довольно легко происходит его восстановление:
Оксид меди получают окислением меди при нагревании или прокаливанием гидроксида меди:
Оксид меди встречается в природе в продуктах выветривания некоторых медных руд. Он используется в производстве стекла и эмалей как зеленый и синий красители (медно-рубиновое стекло), как окислитель в органическом анализе и в медицине.
Гидроксид меди
Гидроксид меди Сu(ОН)2. Выпадает в виде осадка при действии на растворы солей меди (II) растворов щелочей (но не аммиака):
При действии аммиака на соли меди (II) сначала выпадает гидроксид меди, который очень легко растворяется в избытке аммиака с образованием аммиаката меди:
Аммиакат меди окрашен в интенсивный сине-фиолетовый цвет, Поэтому он позволяет обнаружить малые количества ионов меди (П) в растворе. Эта реакция применяется в аналитической химии.
Гидроксид меди обладает очень слабо выраженными амфотерными свойствами. В кислотах он растворяется легко, в концентрированных растворах щелочей — с большим трудом. В первом случае образуются соли меди, во втором — гидроксокупраты:
Гидроксид меди может восстанавливаться до гемиоксида меди при нагревании С различными не очень сильными восстановителями: альдегидами, сахарами, гидразином, гидроксиламином и др.:
Гемиоксид, или оксид меди (I)
Гемиоксид, или оксид меди (I) , Си20. Обладает только основными свойствами. Часть солей меди (I) хорошо растворима, но довольно неустойчива и легко окисляется кислородом воздуха. Устойчивыми соединениями меди (I) являются, как правило, либо нерастворимые соединения (Cu2S, Cu2O, Cu2I2), либо комплексные соединения ( Cu(NH3) + 2 и др.). Гемиоксид меди применяется для изготовления купроксных выпрямителей переменного тока.
При растворении гемиоксида меди в кислородсодержащих кислотах, например серной, образуются соли меди (II) и медь:
а при растворении в галогеноводородных кислотах — соли меди (I):
Многие соли меди (II) хорошо растворимы в воде, но подвержены гидролизу, поэтому в растворе всегда должен быть небольшой избыток кислоты. Нерастворимыми солями меди (II) являются сульфид CuS, карбонат (основной карбонат) СuСO3• Сu(ОН)2 • 0,5Н2О , оксалат СuС2O4 и фосфат Сu3(РO4)2.
Под действием восстановителей соли меди (II) в кислом растворе могут восстанавливаться до солей меди (I):
Аммиачные растворы солей меди (I) могут взаимодействовать с ацетиленом, образуя ацетиленид меди;
Медь. Химия меди и ее соединений
Положение в периодической системе химических элементов
Медь расположена в 11 группе (или в побочной подгруппе II группы в короткопериодной ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение меди
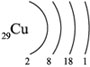
Электронная конфигурация меди в основном состоянии :
+29Cu 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 1s 

3s 


У атома меди уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Медь – твердый металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Медь относительно легко поддается механической обработке. В природе встречается в том числе в чистом виде и широко применяется в различных отраслях науки, техники и производства.
Изображение с портала zen.yandex.com/media/id/5d426107ae56cc00ad977411/uralskaia-boginia-liubvi-5d6bcceda660d700b075a12d
Температура плавления 1083,4 о С, температура кипения 2567 о С, плотность меди 8,92 г/см 3 .
Медь — ценный металл в сфере вторичной переработки. Сдав лом меди в пункт приема, Вы можете получить хорошее денежное вознаграждение. Подробнее про прием лома меди.
Нахождение в природе
Медь встречается в земной коре (0,0047-0,0055 масс.%), в речной и морской воде. В природе медь встречается как в соединениях, так и в самородном виде. В промышленности используют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Также распространены и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2 (OH) 2 CO 3 . Иногда медь встречается в самородном виде, масса которых может достигать 400 тонн .
Способы получения меди
Медь получают из медных руд и минералов. Основные методы получения меди — электролиз, пирометаллургический и гидрометаллургический.
- Гидрометаллургический метод: р астворение медных минералов в разбавленных растворах серной кислоты, с последующим вытеснением металлическим железом.
Например , вытеснение меди из сульфата железом:
CuSO4 + Fe = Cu + FeSO4
- Пирометаллургический метод : получение меди из сульфидных руд. Это сложный процесс, который включает большое количество реакций. Основные стадии процесса:
1) Обжиг сульфидов:
2CuS + 3O2 = 2CuO + 2SO2
2) восстановление меди из оксида, например, водородом:
CuO + H2 = Cu + H2O
- Электролиз растворов солей меди:
Качественные реакции на ионы меди (II)
Качественная реакция на ионы меди +2 – взаимодействие солей меди (II) с щелочами . При этом образуется голубой осадок гидроксида меди(II).
Например , сульфат меди (II) взаимодействует с гидроксидом натрия:
Соли меди (II) окрашивают пламя в зеленый цвет.
Химические свойства меди
В соединениях медь может проявлять степени окисления +1 и +2.
1. Медь — химически малоактивный металл. При нагревании медь может реагировать с некоторыми неметаллами: кислородом, серой, галогенами.
1.1. При нагревании медь реагирует с достаточно сильными окислителями , например , с кислородом , образуя CuО, Cu2О в зависимости от условий:
2Cu + О2 → 2CuО
1.2. Медь реагирует с серой с образованием сульфида меди (II):
Cu + S → CuS
1.3. Медь взаимодействует с галогенами . При этом образуются галогениды меди (II):
Но, обратите внимание:
2Cu + I2 = 2CuI
1.4. С азотом, углеродом и кремнием медь не реагирует:
Cu + N2 ≠
Cu + C ≠
Cu + Si ≠
1.5. Медь не взаимодействует с водородом.
1.6. Медь взаимодействует с кислородом с образованием оксида:
2Cu + O2 → 2CuO
2. Медь взаимодействует и со сложными веществами:
2.1. Медь в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II):
2.2. В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.).
Например , медь не реагирует с разбавленной серной кислотой :
2.3. При этом медь реагирует при нагревании с концентрированной серной кислотой . При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода:
2.4. Медь реагирует даже при обычных условиях с азотной кислотой .
С концентрированной азотной кислотой:
С разбавленной азотной кислотой:
Реакция меди с азотной кислотой
2.5. Растворы щелочей на медь практически не действуют.
2.6. Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей .
Например , медь реагирует с нитратом ртути (II) с образованием нитрата меди (II) и ртути:
Hg(NO 3 ) 2 + Cu = Cu(NO 3 ) 2 + Hg
2.7. Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами :
1. Термическим разложением гидроксида меди (II) при 200°С :
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства) . При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например , оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например , оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например , оксид меди (II) окисляет аммиак :
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Более активные металлы вытесняют медь из оксида.
Например , алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Оксид меди (I)
Оксид меди (I) Cu2O – твердое кристаллическое вещество коричнево-красного цвета.
Способы получения оксида меди (I)
В лаборатории оксид меди (I) получают восстановлением свежеосажденного гидроксида меди (II), например, альдегидами или глюкозой:
Химические свойства оксида меди (I)
1. Оксид меди (I) обладает основными свойствами.
При действии на оксид меди (I) галогеноводородных кислот получают галогениды меди (I) и воду:
Например , соляная кислота с оксидом меди (I) образует хлорид меди (I):
Cu2O + 2HCl = 2CuCl↓ + H2O
2. При растворении Cu2O в концентрированной серной, азотной кислотах образуются только соли меди (II):
3. Устойчивыми соединениями меди (I) являются нерастворимые соединения (CuCl, Cu2S) или комплексные соединения [Cu(NH3)2] + . Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I):
Аммиачные растворы солей меди (I) взаимодействуют с ацетиленом :
СH ≡ CH + 2[Cu(NH3)2]Cl → СuC ≡ CCu + 2NH4Cl
4. В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность:
Например , при взаимодействии с угарным газом, более активными металлами или водородом оксид меди (II) проявляет свойства окислителя :
Cu2O + CO = 2Cu + CO2
А под действием окислителей, например, кислорода — свойства восстановителя :
Гидроксид меди (II)
Способы получения гидроксида меди (II)
1. Гидроксид меди (II) можно получить действием раствора щелочи на соли меди (II).
Например , хлорид меди (II) реагирует с водным раствором гидроксида натрия с образованием гидроксида меди (II) и хлорида натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Химические свойства
Гидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных ).
1. Взаимодействует с кислотами .
Например , взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака , образуя сине-фиолетовое комплексное соединение:
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Но этой реакции в ЕГЭ по химии пока нет!
4. При нагревании гидроксид меди (II) разлагается :
Соли меди
Соли меди (I)
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность . Как восстановители они реагируют с окислителями.
Например , хлорид меди (I) окисляется концентрированной азотной кислотой :
Также хлорид меди (I) реагирует с хлором :
2CuCl + Cl2 = 2CuCl2
Хлорид меди (I) окисляется кислородом в присутствии соляной кислоты:
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
Прочие галогениды меди (I) также легко окисляются другими сильными окислителями:
Иодид меди (I) реагирует с концентрированной серной кислотой :
Сульфид меди (I) реагирует с азотной кислотой. При этом образуются различные продукты окисления серы на холоде и при нагревании:
Для соединений меди (I) возможна реакция диспропорционирования :
2CuCl = Cu + CuCl2
Комплексные соединения типа [Cu(NH3)2] + получают растворением в концентрированном растворе аммиака :
Соли меди (II)
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства.
Например , соли меди (II) окисляют иодиды и сульфиты :
2CuCl2 + 4KI = 2CuI + I2 + 4KCl
Бромиды и иодиды меди (II) можно окислить перманганатом калия :
Соли меди (II) также окисляют сульфиты :
Более активные металлы вытесняют медь из солей.
Например , сульфат меди (II) реагирует с железом :
CuSO4 + Fe = FeSO4 + Cu
Сульфид меди (II) можно окислить концентрированной азотной кислотой . При нагревании возможно образование сульфата меди (II):
Еще одна форма этой реакции:
CuS + 10HNO 3( конц .) = Cu(NO 3 ) 2 + H 2 SO 4 + 8NO 2 ↑ + 4H 2 O
При горении сульфида меди (II) образуется оксид меди (II) и диоксид серы:
2CuS + 3O2 2CuO + 2SO2↑
Соли меди (II) вступают в обменные реакции, как и все соли.
Например , растворимые соли меди (II) реагируют с сульфидами:
CuBr2 + Na2S = CuS↓ + 2NaBr
При взаимодействии солей меди (II) с щелочами образуется голубой осадок гидроксида меди (II):
CuSO 4 + 2NaOH = Cu(OH) 2 ↓ + Na 2 SO 4
Электролиз раствора нитрата меди (II):
Некоторые соли меди при нагревании разлагаются , например , нитрат меди (II):
Основный карбонат меди разлагается на оксид меди (II), углекислый газ и воду:
При взаимодействии солей меди (II) с избытком аммиака образуются аммиачные комплексы:
При смешивании растворов солей меди (II) и карбонатов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
Медь и соединения меди
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
8) Твердое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой, внесли в раствор хлорида натрия, содержащий медные опилки, в результате образовался осадок. Напишите уравнения описанных реакций.
9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Полученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
МЕДЬ И ЕЕ СОЕДИНЕНИЯ
УРОК В 11-м ЕСТЕСТВЕННО-НАУЧНОМ КЛАССЕ
Для повышения познавательной активности и самостоятельности учащихся мы используем уроки коллективного изучения материала. На таких уроках каждый ученик (или пара учеников) получает задание, о выполнении которого он должен отчитаться на этом же уроке, причем его отчет фиксируется остальными учениками класса в тетрадях и является элементом содержания учебного материала урока. Каждый ученик вносит свою лепту в изучение темы классом.
В ходе урока меняется режим работы учеников от интраактивного (режим, при котором информационные потоки замкнуты внутри обучаемых, характерен для самостоятельной работы) к интерактивному (режим, при котором информационные потоки двусторонние, т.е. информация идет и от ученика, и к ученику, происходит обмен информацией). Учитель при этом выступает как организатор процесса, корректирует и дополняет информацию, сообщаемую учениками.
Уроки коллективного изучения материала состоят из следующих этапов:
1-й этап – установочный, на котором учитель объясняет цели и программу работы на уроке (до 7 мин);
2-й этап – самостоятельная работа учащихся по инструкции (до 15 мин);
3-й этап – обмен информацией и подведение итогов урока (занимает все оставшееся время).
Урок «Медь и ее соединения» рассчитан на классы с углубленным изучением химии (4 ч химии в неделю), проводится в течение двух академических часов, на уроке актуализируются знания учащихся по следующим темам: «Общие свойства металлов», «Отношение к металлам концентрированной серной кислоты, азотной кислоты», «Качественные реакции на альдегиды и многоатомные спирты», «Окисление предельных одноатомных спиртов оксидом меди(II)», «Комплексные соединения».
Перед уроком учащиеся получают домашнее задание: повторить перечисленные темы. Предварительная подготовка учителя к уроку заключается в составлении инструктивных карточек для учащихся и подготовке наборов для лабораторных опытов.
ХОД УРОКА
Установочный этап
Учитель ставит перед учащимися цель урока: опираясь на имеющиеся знания о свойствах веществ, спрогнозировать, подтвердить практически, обобщить сведения о меди и ее соединениях.
Учащиеся составляют электронную формулу атома меди, выясняют, какие степени окисления может проявлять медь в соединениях, какими свойствами (окислительно-восстановительными, кислотно-основными) будут обладать соединения меди.
В тетрадях учеников появляется таблица.
Свойства меди и ее соединений
Этап самостоятельной работы
Для подтверждения и дополнения предположений учащиеся выполняют лабораторные опыты по инструкции и записывают уравнения проведенных реакций.
Инструкции для самостоятельной работы парами
1. Прокалите медную проволоку в пламени. Отметьте, как изменился ее цвет. Горячую прокаленную медную проволоку поместите в этиловый спирт. Обратите внимание на изменение ее цвета. Повторите эти манипуляции 2–3 раза. Проверьте, не изменился ли запах этанола.
Запишите два уравнения реакций, соответствующие проведенным превращениям. Какие свойства меди и ее оксида подтверждаются этими реакциями?2. К оксиду меди(I) прилейте соляную кислоту.
Что наблюдаете? Запишите уравнения реакций, учитывая, что хлорид меди(I) – нерастворимое соединение. Какие свойства меди(I) подтверждаются этими реакциями?3. а) В раствор сульфата меди(II) поместите гранулу цинка. Если реакция не идет, нагрейте раствор. б) К оксиду меди(II) прилейте 1 мл серной кислоты и нагрейте.
Что наблюдаете? Запишите уравнения реакций. Какие свойства соединений меди подтверждаются этими реакциями?4. В раствор сульфата меди(II) поместите полоску универсального индикатора.
Объясните результат. Запишите ионное уравнение гидролиза по I ступени.
К раствору карбоната натрия прилейте раствор сульфата мед(II).
Что наблюдаете? Запишите уравнение реакции совместного гидролиза в молекулярном и ионном видах.5. К сульфату меди(II) прилейте избыток гидроксида натрия.
Что наблюдаете?
К полученному осадку прилейте раствор аммиака.
Какие изменения произошли? Запишите уравнения реакций. Какие свойства соединений меди доказывают проведенные реакции?6. К сульфату меди(II) прилейте раствор йодида калия.
Что наблюдаете? Составьте уравнение реакции. Какое свойство меди(II) доказывает эта реакция?7. В пробирку с 1 мл концентрированной азотной кислоты поместите небольшой кусочек медной проволоки. Закройте пробирку пробкой.
Что наблюдаете? (Пробирку отнесите под тягу.) Запишите уравнение реакции.
В другую пробирку налейте соляной кислоты, поместите в нее небольшой кусочек медной проволоки.
Что наблюдаете? Объясните свои наблюдения. Какие свойства меди подтверждаются этими реакциями?8. К сульфату меди(II) прилейте избыток гидроксида натрия.
Что наблюдаете? Полученный осадок нагрейте. Что произошло? Запишите уравнения реакций. Какие свойства соединений меди подтверждаются этими реакциями?9. К сульфату меди(II) прилейте избыток гидроксида натрия.
Что наблюдаете?
К полученному осадку прилейте раствор глицерина.
Какие изменения произошли? Запишите уравнения реакций. Какие свойства соединений меди доказывают эти реакции?10. К сульфату меди(II) прилейте избыток гидроксида натрия.
Что наблюдаете?
К полученному осадку прилейте раствор глюкозы и нагрейте.
Что получилось? Запишите уравнение реакции, используя для обозначения глюкозы общую формулу альдегидов
.
Какое свойство соединения меди доказывает эта реакция?
11. К сульфату меди(II) прилейте: а) раствор аммиака; б) раствор фосфата натрия.
Что наблюдаете? Запишите уравнения реакций. Какие свойства соединений меди доказывают проведенные реакции?
Этап обмена информацией и подведение итогов
Учитель задает вопрос, касающийся свойств конкретного вещества. Учащиеся, выполнявшие соответствующие опыты, докладывают о проведенном эксперименте и записывают уравнения реакций на доске. Затем учитель и ученики дополняют сведения о химических свойствах вещества, которые невозможно было подтвердить реакциями в условиях школьной лаборатории.
Порядок обсуждения химических свойств соединений меди
1. Как медь реагирует с кислотами, с какими еще веществами может реагировать медь?
Записываются уравнения реакций меди с:
• концентрированной и разбавленной азотной кислотой:
• концентрированной серной кислотой:
• соляной кислотой в присутствии кислорода:
2. Какие свойства проявляют оксид и хлорид меди(I)?
Обращается внимание на осно’вные свойства, способность к комплексообразованию, окислительно-восстановительную двойственность. Записываются уравнения реакций оксида меди(I) с:
• соляной кислотой до образования CuCl:
• реакций восстановления и окисления Cu2O:
• диспропорционирования при нагревании:
3. Какие свойства проявляет оксид меди(II)?
Обращается внимание на осно’вные и окислительные свойства. Записываются уравнения реакций оксида меди(II) с:
CuO + 2H + = Cu 2+ + H2O;
4. Какие свойства проявляет гидроксид меди(II)?
Обращается внимание на окислительные, осно’вные свойства, способность к комплексообразованию с органическими и неорганическими соединениями. Записываются уравнения реакций с:
• уравнение реакции разложения:
5. Какие свойства проявляют соли меди(II)?
Обращается внимание на реакции ионного обмена, гидролиза, окислительные свойства, комплексообразование. Записываются уравнения реакций сульфата меди с:
3Cu 2+ + 2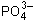
Cu 2+ + Zn = Cu + Zn 2+ ;
и уравнения реакций:
Cu 2+ + HOH = CuOH + + H + ;
• совместного гидролиза с карбонатом натрия с образованием малахита:
2Cu 2+ + 2 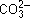
В дополнение можно рассказать учащимся о взаимодействии оксида и гидроксида меди(II) с щелочами, что доказывает их амфотерность:
Подводится итог: с повышением степени окисления возрастают окислительные свойства соединений меди. Ионы меди способны к комплексообразованию. У соединений меди проявляются осно’вные свойства, хотя оксид и гидроксид меди(II) в жестких условиях могут реагировать с щелочами, проявляя слабую амфотерность.
Оставшееся время урока можно потратить на выполнение упражнений и решение расчетных задач.
Упражнение 1. Осуществите цепочку превращений:
Cu 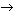
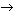
Упражнение 2. Предложите не менее восьми способов получения хлорида меди(II).
Упражнение 3. Составьте цепочки превращений, соответствующие следующим схемам, и осуществите их:
Задача 1. Сплав меди с алюминием обработали сначала избытком щелочи, а затем избытком разбавленной азотной кислоты. Вычислите массовые доли металлов в сплаве, если известно, что объемы газов, выделившихся в обеих реакциях (при одинаковых условиях), равны между собой
[1, с. 237, № 1464].
(Ответ. Массовая доля меди – 84%.)
Задача 2. При прокаливании 6,05 г кристаллогидрата нитрата меди(II) получено 2 г остатка. Определите формулу исходной соли [2, с. 204, № 836].
Задача 3. Медную пластинку массой 13,2 г опустили в 300 г раствора нитрата железа(III) с массовой долей соли 0,112. Когда ее вынули, оказалось, что массовая доля нитрата железа(III) стала равной массовой доле образовавшейся соли меди(II). Определите массу пластинки после того, как ее вынули из раствора [2, с. 204, № 841].
(Ответ. 10 г.)
Домашнее задание. Выучить материал, записанный в тетради. Составить цепочку превращений по соединениям меди, содержащую не менее десяти реакций, и осуществить ее.
ЛИТЕРАТУРА
1. Пузаков С.А., Попков В.А. Пособие по химии для поступающих в вузы. Программы. Вопросы, упражнения, задачи. Образцы экзаменационных билетов. М.: Высшая школа, 1999, 575 с.
2. Кузьменко Н.Е., Еремин В.В. 2000 задач и упражнений по химии. Для школьников и абитуриентов. М.: 1-я Федеративная книготорговая компания, 1998, 512 с.
http://chemege.ru/cuprum/
http://him.1sept.ru/2004/32/26.htm







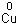
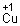
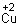
 .
.