Урок №24. Оксид серы (IV). Сернистая кислота и её соли
Сернистый ангидрид; сернистый газ – SO 2
Физические свойства
Бесцветный газ с резким запахом; хорошо растворим в воде (в 1V H 2 O растворяется 40V SO 2 при н.у.); более чем в два раза тяжелее воздуха, ядовит; t°пл. = -75,5°C; t°кип. = -10°С.
Обесцвечивает многие красители, убивает микроорганизмы.
Получение
1) При сжигании серы в кислороде:
S + O 2 = t = SO 2
2) Окислением сероводорода и сульфидов:
2H 2 S + 3O 2 = t = 2SO 2 + 2H 2 O
2CuS + 3O 2 = t = 2SO 2 + 2CuO
4FeS 2 + 11O 2 = t = 2Fe 2 O 3 + 8SO 2
3) Обработкой солей сернистой кислоты – сульфитов минеральными кислотами:
Na 2 SO 3 + 2HCl = 2NaCl + SO 2 ↑ + H 2 O
4) При окислении неактивных металлов концентрированной серной кислотой:
Cu + 2H 2 SO 4 (конц) → CuSO 4 + SO 2 ↑ + 2H 2 O
Химические свойства
1. SO 2 – проявляет окислительно-восстановительные свойства
SO 2 — восстановитель (S +4 – 2ē → S +6 )
2SO 2 + O 2 ← кат-V2O5 → 2SO 3
Обесцвечивает бромную воду:
SO 2 + Br 2 + 2H 2 O = H 2 SO 4 + 2HBr
Окисляется азотной кислотой, озоном и оксидом свинца (IV):
SO 2 + 2HNO 3 = H 2 SO 4 + 2NO 2
Обесцвечивает раствор перманганата калия – качественная реакция на сернистый га з:
5SO 2 + 2KMnO 4 + 2H 2 O = K 2 SO 4 + 2MnSO 4 + 2H 2 SO 4
SO 2 — окислитель (S +4 + 4ē → S 0 )
SO 2 + С = t = S + СO 2
SO 2 + 2CO = t = 2СО 2 + S
SO 2 + 2H 2 S = t = 3S + 2H 2 O
2. Сернистый ангидрид — кислотный оксид
При растворении SO 2 в воде образуется слабая и неустойчивая сернистая кислота H 2 SO 3 (существует только в водном растворе)
Свойства сернистой кислоты
Сернистая кислота диссоциирует ступенчато:
(первая ступень, образуется гидросульфит – анион)
HSO 3 — ↔ H + + SO 3 2-
(вторая ступень, образуется анион сульфит)
H 2 SO 3 образует два ряда солей — средние (сульфиты) и кислые (гидросульфиты).
Как и все кислоты, сернистая кислота меняет цвет растворов индикаторов. Метиловый оранжевый в растворе кислоты становится красным. В старину дамские соломенные шляпки отбеливали сернистой кислотой. Раствор сернистой кислоты отбеливает ткани из растительного материала, шерсти, шелка.
Качественной реакцией на соли сернистой кислоты является взаимодействие соли с сильной кислотой, при этом выделяется газ SO 2 с резким запахом:
Na 2 SO 3 + 2HCl = 2NaCl + SO 2 ↑+ H 2 O
2H + + SO 3 2- = SO 2 ↑+ H 2 O
Сернистая кислота H 2 SO 3. проявляет восстановительные свойства:
Сернистая кислота взаимодействует с раствором йода, обесцвечивая его. При этом образуются йодоводородная и серная кислоты.
H 2 SO 3 + I 2 + H 2 O = H 2 SO 4 + 2НI
Водные растворы сульфитов щелочных металлов окисляются на воздухе:
2SO 3 2- + O 2 = 2SO 4 2-
3. Взаимодействие со щелочами
Ba(OH) 2 + SO 2 → BaSO 3 ↓ (сульфит бария) + H 2 O
Ba(OH) 2 + 2SO 2 (избыток) = Ba(HSO 3 ) 2 (гидросульфит бария)
4. Взаимодействие с основными оксидами
SO 2 + CaO = CaSO 3
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
Задание №1. Закончите уравнения химических реакций, составьте электронный баланс, укажите процессы окисления и восстановления, окислитель и восстановитель:
Задание №2. Осуществите превращения по схемам:
1) S → H 2 S → SO 2 → Na 2 SO 3 → BaSO 3 → SO 2
2) SO 2 + Br 2 , H 2 O →А → Na 2 SO 4 → BaSO 4
3) FeS 2 → SO 2 →Na 2 SO 3 +HCl → A + O 2 → B → H 2 SO 4
4) SO 2 +KMnO 4 , H 2 O → A + BaCl 2 → B
5) SO 2 → S → K 2 S → H 2 S → PbS → SO 2
6) H 2 SO 3 +I 2 → A +Cu → B +NaOH → C
7) K 2 SO 3 → SO 2 → MgSO 3 → SO 2 → KHSO 3 → SO 2
Уравнения реакций ионного обмена напишите в полном и кратком ионном виде.
Оксид серы (IV)
Оксид серы (IV) – это кислотный оксид . Бесцветный газ с резким запахом, хорошо растворимый в воде.
Cпособы получения оксида серы (IV)
1. Сжигание серы на воздухе :
2. Горение сульфидов и сероводорода:
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например , сульфит натрия взаимодействует с серной кислотой:
4. Обработка концентрированной серной кислотой неактивных металлов.
Например , взаимодействие меди с концентрированной серной кислотой:
Химические свойства оксида серы (IV)
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя .
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов .
Например , оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например , оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например , при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
Оксид серы (IV) SO2, сернистый газ
Взаимодействуя с кислородом, сера образует два оксида:
- SO2 (IV) — сернистый газ (сернистый ангидрид, диоксид серы)
- SO3 (VI) — серный ангидрид
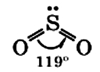
Молекула сернистого газа сильно полярна, угловой формы (угол между связями составляет 119°):
Физические свойства сернистого газа:
- бесцветный ядовитый газ с резким запахом;
- в 2 раза тяжелее воздуха;
- хорошо растворим в воде — при н.у. в 1 объеме воды растворяется 40 объемов SO2 (IV) с образованием сернистой кислоты.
Химические свойства сернистого газа
Сернистый газ является типичным кислотным оксидом.
- сернистый газ реагирует с основаниями с образованием гидросульфитов (кислые соли) и сульфитов (средние соли):
- реакции сернистого газа с основными оксидами:
- с водой образует сернистую кислоту, которая существует только в растворе и относится к двухосновным кислотам:
Ступенчатая диссоциация сернистой кислоты с образованием гидросульфит-иона на первой ступени диссоциации, и сульфит-иона — на второй:
- пример реакции сернистой кислоты в качестве восстановителя:
- пример реакции сернистой кислоты в качестве окислителя:
Сернистая кислота может образовывать средние соли (сульфиты) — Na2SO3, и кислые соли (гидросульфиты) — NaHSO3.
В окислительно-восстановительных реакциях сернистый газ может выступать, как в роли окислителя (восстанавливаясь в S и H2S), так и в роли восстановителя (окисляясь в H2SO4), т.к. сера в этом соединении занимает промежуточную степень окисления +4.
- в реакции с сероводородом сернистый газ является окислителем:
- в реакции с кислородом при нагревании сернистый газ является восстановителем:
Получение и применение сернистого газа
В промышленности сернистый газ получают или сжиганием серы, или как побочный продукт обжига сульфидных руд, например, железного колчедана.
В лабораторных условиях диоксид серы можно получить действием концентрированных кислот на соли сернистой кислоты (гидросульфиты и сульфиты), а также в процессе реакции серной кислоты с тяжелым металлом.
Сернистый газ используют для:
- получения оксида серы (VI);
- получения серной кислоты;
- получения сульфитов и гидросульфитов;
- отбеливания тканей в текстильной промышленности;
- уничтожения вредных микроорганизмов в качестве дезинфицирующего средства при консервировании продуктов питания.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
http://chemege.ru/oksid-sery-iv/
http://prosto-o-slognom.ru/chimia/503_oksid_sery_SO2.html