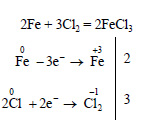Составить уравнение реакций для переходов железа
Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ:
а) Железо ⟶ Хлорид железа (II) ⟶ Гидроксид железа (II) ⟶ Гидроксид железа (III) ⟶ Оксид железа (III) ⟶ Железо;
б) Железо ⟶ Хлорид железа (III) ⟶ Гидроксид железо (III) ⟶ Сульфат железа (III) ⟶ Железа ⟶ Оксид дижелеза(III)-железа(II) ⟶ Железо ⟶ Карбид трижелеза;
в) Нитрат железа (III) ⟶ Оксид железа (III) ⟶ Оксид железа (II) ⟶ Железо ⟶ Сульфид железа (II) ⟶ Оксид железа (III) ⟶ Хлорид железа (III) ⟶ Роданид железа (III);
г) Железо ⟶ Сульфид железа (II) ⟶ Хлорид железа (II) ⟶ Хлорид железа (III) ⟶ Гексацианоферрат (II) железа (III);
д) Дисульфид железа (II) ⟶ Оксид железа (III) ⟶ Железо ⟶ Хлорид железа (III) ⟶ Хлорид железа (II) ⟶ Гексацианоферрат (III) железа (II);
е) Оксид железа (II) ⟶ Диоксоферрат (III) натрия ⟶ Хлорид железа (III) ⟶ Гидроксид железа (III) ⟶ Феррат калия ⟶ Сульфат железа (III) ⟶ Оксид железа (III) ⟶ Сульфат железа (III) ⟶ Гексационоферрат (II) железа(III)-калия.
Для реакций, протекающих в растворе с участием ионов, составьте ионные уравнения. К уравнениям всех окислительно-восстановительных реакций составьте схему электронного баланса или покажите переход электронов стрелкой.
| Fe + 2HCl = FeCl2 + H2↑ | ||||
| Fe 0 — 2ē ⟶ Fe +2 | 2 | 2 | 1 | восстановитель (окисление) |
| 2H + + 2ē ⟶ H2 0 | 2 | 1 | окислитель (восстановление) | |
FeCl2 + 2NaOH = 2NaCl + Fe(OH)2↓
Fe 2+ + 2Cl — + 2Na + + 2OH — = 2Na + + 2Cl — + Fe(OH)2↓
Fe 2+ + 2OH — = Fe(OH)2↓
| 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 | ||||
| Fe +2 — 1ē ⟶ Fe +3 | 1 | 4 | 4 | восстановитель (окисление) |
| O2 0 + 4ē ⟶ 2O -2 | 4 | 1 | окислитель (восстановление) | |
| Fe2O3 + 3CO `overset(t)(=)` 2Fe + 3CO2 | ||||
| C +2 — 2ē ⟶ C +4 | 2 | 6 | 3 | восстановитель (окисление) |
| Fe +3 + 3ē ⟶ Fe 0 | 3 | 2 | окислитель (восстановление) | |
| 2Fe + 3Cl2 = 2FeCl3 | ||||
| Fe 0 — 3ē ⟶ Fe +3 | 3 | 6 | 2 | восстановитель (окисление) |
| Cl2 0 + 2ē ⟶ 2Cl — | 2 | 3 | окислитель (восстановление) | |
FeCl3 + 3NaOH = 3NaCl + Fe(OH)3↓
Fe 3+ + 3Cl — + 3Na + + 3OH — = 3Na + + 3Cl — + Fe(OH)3↓
Fe 3+ + 3OH — = Fe(OH)3↓
| 3Zn + Fe2(SO4)3 = 3ZnSO4 + 2Fe | ||||
| Zn 0 — 2ē ⟶ Zn +2 | 2 | 6 | 3 | восстановитель (окисление) |
| Fe +3 + 3ē ⟶ Fe 0 | 3 | 2 | окислитель (восстановление) | |
| 3Fe + 2O2 = FeO∙Fe2O3 | ||||
| Fe 0 — 2ē ⟶ Fe +2 | 8 | 8 | 1 | восстановитель (окисление) |
| 2Fe 0 — 6ē ⟶ 2Fe +3 | ||||
| O2 0 + 4ē ⟶ 2O -2 | 4 | 2 | окислитель (восстановление) | |
| FeO∙Fe2O3 + 4CO `overset(t)(=)` 3Fe + 4CO2 | ||||
| C +2 — 2ē ⟶ C +4 | 2 | 8 | 4 | восстановитель (окисление) |
| Fe +2 + 2ē ⟶ Fe 0 | 8 | 1 | окислитель (восстановление) | |
| 2Fe +3 + 6ē ⟶ Fe 0 | ||||
| 4Fe + 3C `overset(t)(=)` Fe4C3 | ||||
| Fe 0 — 3ē ⟶ Fe +3 | 3 | 12 | 4 | восстановитель (окисление) |
| C 0 + 4ē ⟶ C +4 | 4 | 3 | окислитель (восстановление) | |
| 4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2↑ | ||||
| 2O -2 — 4ē ⟶ O2 0 | 4 | 4 | 1 | восстановитель (окисление) |
| N +5 + 1ē ⟶ N +4 | 1 | 4 | окислитель (восстановление) | |
| Fe2O3 + CO `overset(t)(=)` 2FeO + CO2 | ||||
| C +2 — 2ē ⟶ C +4 | 2 | 2 | 1 | восстановитель (окисление) |
| Fe +3 + 1ē ⟶ Fe +2 | 1 | 2 | окислитель (восстановление) | |
| FeO + CO `overset(t)(=)` Fe + CO2 | ||||
| C +2 — 2ē ⟶ C +4 | 2 | 2 | 1 | восстановитель (окисление) |
| Fe +2 + 2ē ⟶ Fe 0 | 2 | 1 | окислитель (восстановление) | |
| Fe + S = FeS | ||||
| Fe 0 — 2ē ⟶ Fe +2 | 2 | 2 | 1 | восстановитель (окисление) |
| S 0 + 2ē ⟶ S -2 | 2 | 1 | окислитель (восстановление) | |
| 4FeS + 7O2 = 2Fe2O3 + 4SO2↑ | ||||
| Fe +2 — 1ē ⟶ Fe +3 | 7 | 28 | 4 | восстановитель (окисление) |
| S -2 — 6ē ⟶ S +4 | ||||
| O2 0 + 4ē ⟶ 2O -2 | 4 | 7 | окислитель (восстановление) | |
FeCl3 + 3KSCN = 3KCl + Fe(SCN)3
Fe 3+ + 3Cl — + 3K + + 3SCN — = 3K + + 3Cl — + Fe(SCN)3
Fe 3+ + 3SCN — = Fe(SCN)3
| Fe + S = FeS | ||||
| Fe 0 — 2ē ⟶ Fe +2 | 2 | 2 | 1 | восстановитель (окисление) |
| S 0 + 2ē ⟶ S -2 | 2 | 1 | окислитель (восстановление) | |
FeS + 2HCl = FeCl2 + H2S↑
FeS + 2H + + 2Cl — = Fe 2+ + 2Cl — + H2S↑
FeS + 2H + = Fe 2+ + H2S↑
| 2FeCl2 + Cl2 = 2FeCl3 | ||||
| Fe +2 — 1ē ⟶ Fe +3 | 1 | 2 | 2 | восстановитель (окисление) |
| Cl2 0 + 2ē ⟶ 2Cl — | 2 | 1 | окислитель (восстановление) | |
| 4FeS2 + 11O2 `overset(t)(=)` 2Fe2O3 + 8SO2↑ | ||||
| Fe +2 — 1ē ⟶ Fe +3 | 11 | 44 | 4 | восстановитель (окисление) |
| 2S — — 10ē ⟶ 2S +4 | ||||
| O2 0 + 4ē ⟶ 2O -2 | 4 | 11 | окислитель (восстановление) | |
| Fe2O3 + 3CO `overset(t)(=)` 2Fe + 3CO2 | ||||
| C +2 — 2ē ⟶ C +4 | 2 | 6 | 3 | восстановитель (окисление) |
| Fe +3 + 3ē ⟶ Fe 0 | 3 | 2 | окислитель (восстановление) | |
| 2Fe + 3Cl2 = 2FeCl3 | ||||
| Fe 0 — 3ē ⟶ Fe +3 | 3 | 6 | 2 | восстановитель (окисление) |
| Cl2 0 + 2ē ⟶ 2Cl — | 2 | 3 | окислитель (восстановление) | |
| 2FeCl3 `overset(t)(=)` 2FeCl2 + Cl2↑ | ||||
| 2Cl — — 2ē ⟶ Cl2 0 | 2 | 2 | 1 | восстановитель (окисление) |
| Fe +3 + 1ē ⟶ Fe +2 | 1 | 2 | окислитель (восстановление) | |
| 4FeO + 2Na2O + O2 `overset(t)(=)` 4NaFeO2 | ||||
| Fe +2 — 1ē ⟶ Fe +3 | 1 | 4 | 4 | восстановитель (окисление) |
| O2 0 + 4ē ⟶ 2O -2 | 4 | 1 | окислитель (восстановление) | |
NaFeO2 + 4HCl = NaCl + FeCl3 + 2H2O
NaFeO2 + 4H + + 4Cl — = Na + + Cl — + Fe 3+ + 3Cl — + 2H2O
NaFeO2 + 4H + = Na + + Fe 3+ + 2H2O
FeCl3 + 3NaOH = 3NaCl + Fe(OH)3↓
Fe 3+ + 3Cl — + 3Na + + 3OH — = 3Na + + 3Cl — + Fe(OH)3↓
Fe 3+ + 3OH — = Fe(OH)3↓
Составьте уравнения реакций железа с простыми и сложными веществами Покажите переход электронов и поясните, что окисляется и что восстанавливается, что является окислителем и что восстановителем.
Окислителем является хлор, восстановителем – железо.
Окислителем является водород, восстановителем – железо.
Окислителем является свинец, восстановителем – железо.

задача №16
к главе «Глава V. Металлы».
Схемы превращений веществ. Составление уравнений реакций превращений железа
Задание 237.
Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe → FeSO4 → Fe(OH)2 → Fe(OH)3 → FeCl3
Решение:
Уравнения реакций, которые надо провести для осуществления следующих превращений:
Задание 429 (ш)
Составьте молекулярные и ионно-молекулярные уравнения реакций, которые надо провести для осуществления превращений:
Fe → FeCl2 → Fe(CN)2 → К4[Fe(CN)6] → К3[Fe(CN)6]
К окислительно-восстановительным реакциям составьте электронные уравнения.
Решение:
Молекулярные и ионно-молекулярные уравнения реакций, которые надо провести для осуществления превращений: Fe → FeCl2 → Fe(CN)2 → К4[Fe(CN)6] → К3[Fe(CN)6]
а) Fe + 2HCl = FeCl2 + H2↑ (молекулярная форма);
Fe + 2H + = Fe 2+ + H2 0 (ионно-молекулярная форма).
б) FeCl2 + 2KCN = Fe(CN)2↓ + 2KCl (молекулярная форма);
Fe 2+ + 2CN — = Fe(CN)2↓ (ионно-молекулярная форма).
в) В избытке цианида калия осадок Fe(CN)2 растворяется вследствие образования комплексного соединения К4[Fe(CN)6]:
Fe(CN)2 + 4KCN → К4[Fe(CN)6] (молекулярная форма);
Fe(CN)2 + 4CN — → [Fe(CN)6] 4- (ионно-молекулярная форма).
г) При действии хлора или брома на раствор жёлтой кровяной соли анион [Fe(CN)6] 4- превращается в анион [Fe(CN)6] 3- :
Данная реакция является окислительно-восстановительной, так как атом железа увеличивает свою степень окисления от +2 до +3, т. е. проявляет свойства восстановителя; атомы хлора уменьшают свою степень окисления от 0 до -1, т. е. проявляют свойства окислителя:
http://5terka.com/node/142
http://buzani.ru/zadachi/obshchaya-khimiya/871-uravneniya-reaktsij-prevrashchenij-zheleza-zadanie-237